Пшениця моделі захворювань
Пшениця (Triticum spp.Пшениця є другою за значенням серійною культурою. Пшеницю вирощують у дуже широкому діапазоні кліматичних умов, від субтропічного зимового виробництва до шотландського 11-місячного прохолодного клімату з його величезною продуктивністю. Як і всі хвороби рослин, деякі з них мають більш історичні аспекти, а інші в основному залежать від клімату.
Кліматичні хвороби - це хвороби, зумовлені кліматом: У "The хвороби іржіякі є більш важливими в теплих кліматичних зонах, є переважно кліматично зумовленими захворюваннями. Фузаріозна сажка на його здатність утворювати токсини впливає історія поля, а також кліматична ситуація; цього не станеться, якщо клімат не буде сприятливим для інфекції під час цвітіння. Також Septoria tritici Залежно від зливових дощів та тривалої вологості листя, хвороба може інфікувати колосся, а потім і кукурудзу.
Хвороби з історичними аспектами: Борошниста роса Блюмерія зерниста (Blumeria graminis)що відбувається в широкому кліматичному діапазоні, в основному залежить від історії родовища. Псевдоцеркоспорела herpotrichoides (Хвороба очей), Gaeumannomyces graminis (Take-all, Schwarzbeinigkeit) та Rhizoctonia cerealis (жовта партія) здебільшого залежать від історії місця і мало залежать від клімату.
Хвороба Pyricularia grisea детально описана в розділі "Хвороби рису" і тут називається Magnaporthe grisea.
Коричнева іржа
Збудник Puccinia triticina потребує таких самих умов навколишнього середовища, як і пшеничний лист. Гриб здатний інфікувати рослинну тканину протягом періоду роси тривалістю не більше трьох годин при температурі близько 20°C, однак при більш тривалому періоді роси відбувається більше інфікувань. При більш низьких температурах необхідний більш тривалий період роси, наприклад, при 10°C необхідний 12-годинний період роси. За температури періоду роси вище 32°C (Stubbs et al., 1986) або нижче 2°C інфекції виникають рідко, якщо взагалі виникають.
Більшість важких епідемій виникають, коли уредінії та/або латентні інфекції перезимовують на певному пороговому рівні на посівах пшениці, або коли пшениця, посіяна навесні, є реципієнтом екзогенного інокулюму на ранній стадії, як правило, до колосіння. Сильні епідемії та втрати можуть виникати, коли прапорцевий листок інфікується до появи антени (Честер, 1946). Puccinia triticina є основним патогеном пшениці, її безпосередніх предків та штучно створеної культури тритикале.
Альтернативні хости
Гриб виробляє свої статеві гамети (пікніоспори та рецептивні гіфи) на альтернативному хазяїні. Більшість дослідників іржі припускають, що Thalictrum speciosissimum (Таліктрум особливий) (з родини Ranunculaceae) є основним альтернативним хазяїном для P. recondita f. sp. tritici в Європі. Альтернативний хазяїн заражається, коли теліоспори проростають у присутності вільної вологи. Утворюються базидіоспори (1n), які здатні переноситися на невеликі відстані (кілька метрів) і заражати альтернативних хазяїв. Приблизно через сім-десять днів після зараження з'являються пікніди з пікніоспорами та сприйнятливими гіфами. Вони слугують гаметами, а запліднення відбувається, коли нектар, що містить пікніоспори, переноситься комахами, бризками дощу або за допомогою когезії на сприйнятливі гіфи іншого типу спарювання. Через сім-десять днів на нижній поверхні листка з'являються особливі чашечки, з яких утворюються аеціоспори, що переносяться вітром і спричиняють інфекцію, проникаючи через продихи листків пшениці. Відстані, які долають аеціоспори, виявляються відносно невеликими.
Життєвий цикл (бура іржа)
На малюнку поруч показано життєвий цикл для P. triticina і P. triticiduri та цикл розвитку хвороби для листкової іржі пшениці. Час настання кожної події та частота деяких подій (статевий цикл, сезон вирощування пшениці та зелений міст) можуть відрізнятися в різних регіонах світу.
Альтернативний хазяїн наразі забезпечує незначну кількість прямих інокуляцій P. triticina в пшеницю, але може бути механізмом генетичного обміну між расами і, можливо, популяціями. Патоген виживає в період між посівами пшениці в багатьох регіонах на "зеленому мості" з добровільно посіяної (самосіяної) пшениці (див. розділ "Епідеміологія"). Інокулят у вигляді уредініоспор може переноситися вітрами з одного регіону в інший. Статевий цикл має важливе значення для P. triticiduri. Теліоспори можуть проростати незабаром після розвитку, а зараження базидіоспорами може відбуватися протягом усього циклу вирощування пшениці.
Уредініоспори починають проростати через 30 хвилин після контакту з вільною водою при температурі від 15° до 25°C. Зародкова трубка росте вздовж поверхні листка, поки не досягне продиху; потім утворюється аппресорій, за яким одразу ж слідує розвиток продихового кілочка і підпродихового пухирця, з якого розвиваються первинні гіфи. Гаусторіальна материнська клітина розвивається проти клітини мезофілу, і відбувається пряме проникнення. Гаусторій формується всередині живої клітини хазяїна в умовах сумісної взаємодії хазяїна і патогена. Розвиваються вторинні гіфи, що призводить до появи додаткових гаусторіальних материнських клітин і гаусторій. При несумісній реакції хазяїна і патогена гаусторії не розвиваються або розвиваються повільніше. Коли клітина хазяїна гине, гине і гаусторія гриба. Залежно від того, коли або скільки клітин задіяно, взаємодія хазяїна і патогена призведе до видимої реакції резистентності (Rowell, 1981, 1982).
Проростання спор до спороношення може відбуватися протягом семи-десяти днів за оптимальних і постійних температур. При низьких температурах (від 10° до 15°C) або добових коливаннях необхідний більш тривалий період. Гриб може виживати у вигляді безводної міцелії протягом місяця або більше, коли температура близька до нуля або нижче нуля. Максимум спороношення досягається приблизно через чотири дні після першого спороношення (при температурі близько 20°C). Хоча кількість може сильно варіювати, в середньому на одну уредінієву грибницю утворюється близько 3 000 спор на добу. Такий рівень продукування може тривати протягом трьох тижнів або більше, якщо лист пшениці залишається живим протягом цього часу (Chester, 1946; Stubbs et al., 1986). Урединії (пустули) червоного кольору, овальної форми, розкидані і проникають крізь епідерміс (Рис. 12). Уредініоспори від оранжевого до темно-червоного кольору, ехоподібні, кулясті і зазвичай мають діаметр від 20 до 28 мкм (Рис. 13). Теліоспори (рис. 14) темно-коричневі, двоклітинні з товстими стінками, округлі або сплюснуті на верхівці (рис. 15). Puccinia triticiduri відрізняється від P. triticina тим, що для появи уредініоспор потрібно від 10 до 12 днів, а початкове утворення теліоспор часто відбувається протягом 14 днів після первинного зараження. Уредінії мають жовтувато-коричневий колір і утворюють набагато менше уредініоспор на одну уредінію, а протягом декількох днів в осередку ураження утворюються переважно теліоспори. Також P. triticiduri інфекція, ймовірно, знаходиться на нижній поверхні листя.
Теліоспори P. triticina утворюються під епідермісом за несприятливих умов або при старінні і залишаються на листках. Листяні тканини можуть розсіюватися або переміщуватися вітром, тваринами чи людьми на значні відстані. Базидіоспори утворюються і вивільняються у вологих умовах, що обмежує їх поширення. Базидіоспори також гіалінові і чутливі до світла, що ще більше обмежує їхнє поширення до десятків метрів. Аеціоспори більш схожі на уредініоспори за здатністю переноситися вітровими течіями, але їх транспортування на великі відстані чомусь не було відмічено. Puccinia triticiduri продукує велику кількість теліоспор протягом декількох тижнів після первинного зараження, утворюючи темне кільце телії навколо кожного місця інфікування.
Джерело: Пшениця іржавіє: Р.П. Сінгх, Х. Хуерта-Еспіно, А.П. Рульфс
Модель інфекції Puccinia tritici
Puccinia tritici інфікування відбувається після:
- Кілька годин вологого листя при оптимальних температурних умовах. Грибок може інфікувати в широкому діапазоні температур.
- Модель припускає, що для розвитку інфекції необхідна накопичена погодинна температура повітря 90°C вологості листя в діапазоні температур повітря від 5°C до 30°C.
Вологість листя для накопичених середньогодинних температур за 90°C
- (якщо T <= 22.5°C then ∑(Th) else ∑ (22.5-(Th-22.5))
- 5°C < Temp. < 30°C
У FieldClimate Puccinia tritici інфекція показана жовтою лінією (див. вище). Захворювання схожі на P. graminisале з нижчим температурним порогом 5°C. Якщо виявлено інфекцію 100%, слід врахувати лікувальні заходи захисту рослин (системне застосування). Якщо ризик становить 80% і прогноз погоди передбачає збільшення періодів вологості листя, можна застосовувати захисне листкове обприскування.
Чорна іржа
Стеблова або чорна іржа пшениці викликається P. graminis f. sp. tritici. Свого часу це була хвороба, якої боялися в більшості пшеничних регіонів світу. Страх перед стебловою іржею був не зовсім зрозумілим, оскільки, здавалося б, здоровий урожай за три тижні до збору врожаю міг перетворитися на чорний клубок зламаних стебел і зморщеного зерна до моменту збору врожаю. В Європі та Північній Америці видалення альтернативного господаря зменшило кількість комбінацій вірулентності та кількість місцевого посівного матеріалу (аеціоспор). Крім того, в деяких регіонах були виведені скоростиглі сорти, які дозволили зібрати другий урожай або уникнути цвітіння і наливання зерна в спекотну погоду. Скоростиглі сорти уникають значної шкоди, спричиненої стебловою іржею, уникаючи періоду росту гриба. Широке розповсюдження стійких сортів у всьому світі зменшило вплив цієї хвороби як важливого фактору виробництва. Хоча зміни у вірулентності патогену зробили деякі резистентності неефективними, стійкі сорти, як правило, були виведені раніше, ніж патоген. Вражаючі епідемії, що розвинулися на сорті Еврика (Sr6 в Австралії) в 1940-х роках і на сортах Лі (Sr9g, Sr11, Sr16), Ленгдон (Sr9e, +) і Юма (Sr9e, +) в США в середині 1950-х років, насправді були винятками в минулому. Досвід в інших частинах світу був схожим (Luig and Watson, 1972; Roelfs, 1986; Saari and Prescott, 1985). Сьогодні стеблова іржа значною мірою знаходиться під контролем у всьому світі.
Епідеміологія
Епідеміологія ВІЛ-інфекції P. graminis схожий на P. triticina. Мінімальна, оптимальна та максимальна температури для проростання спор становлять 2°, 15°-24° та 30°C відповідно (Hogg et al., 1969), а для спороношення - 5°, 30° та 40°C відповідно, що приблизно на 5,5°C вище в кожній категорії, ніж для P. triticina. Стеблова іржа має більше значення наприкінці вегетації, на пізньостиглих сортах пшениці та на менших висотах. Пшениця, посіяна навесні, особливо вразлива у вищих широтах, якщо джерела інокуляту розташовані з навітряного боку. На півдні Великих рівнин Північної Америки є великі площі пшениці осіннього посіву, які забезпечують посівний матеріал для пшениці весняного посіву на півночі. У теплому вологому кліматі стеблова іржа може бути особливо сильною через тривалий період сприятливих умов для розвитку хвороби за наявності місцевого джерела збудника.
Стеблова іржа відрізняється від листкової тим, що потребує більш тривалого періоду роси (від шести до восьми годин). Крім того, багато проникаючих кілочків не можуть розвиватися з аппрессоріуму, якщо їх не стимулювати світлом принаймні 10 000 люкс протягом трьох годин, поки рослина повільно висихає після періоду роси. Максимальне зараження досягається при 8-12 годинах роси при 18°C з наступним освітленням понад 10 000 люкс, поки роса повільно висихає, а температура підвищується до 30°C (Rowell, 1984). Освітленість в полі рідко буває обмеженою, оскільки роса часто з'являється вранці. Однак, коли вечірні роси та/або дощі супроводжуються вітрами, що спричиняють висихання до сходу сонця, інфекція розвивається повільніше. У теплицях причиною низького рівня інфікування часто є недостатнє освітлення. Вплив світла, ймовірно, впливає на рослину, а не на грибкову систему, оскільки уредініоспори, ін'єковані всередину листкової пластинки, призводять до успішного проникнення гриба без потрапляння світла на гриб. Уредінії стеблової іржі з'являються як на поверхні листя, так і на поверхні стебла, а також на листкових піхвах, колосках, остюках і навіть на зерні.
Пустула стеблової іржі (уредіній) може виробляти 10 000 уредініоспор на день (Katsuya and Green, 1967; Mont, 1970). Це більше, ніж у листкової іржі, але інфекційність нижча: лише один проросток з десяти призводить до успішного зараження. Уредінії стеблової іржі, що знаходяться переважно на тканинах стебла і листкової піхви, часто виживають довше, ніж уредінії листкової іржі, які частіше обмежуються листковими пластинками. Швидкість розвитку цих двох хвороб дуже схожа.
Уредініоспори стеблової іржі досить стійкі до атмосферних умов, якщо вміст вологи в повітрі помірний (20-30%). Транспортування на великі відстані відбувається щорічно (800 км) через Великі рівнини Північної Америки (Roelfs, 1985a), майже щорічно (2000 км) з Австралії до Нової Зеландії (Luig, 1985) і щонайменше тричі за останні 75 років (8 000 км) зі Східної Африки до Австралії (Watson and de Sousa, 1983).
Аеціоспори також можуть бути джерелом збудника стеблової іржі пшениці. Історично це було важливим у Північній Америці та Північній і Східній Європі. Це джерело посівного матеріалу, як правило, було ліквідоване або значно зменшене після видалення барбарису звичайного або європейського (Берберис звичайний (Berberis vulgaris)) від близькості пшеничних полів. Аеціоспори інфікують пшеницю подібно до уредініоспор.
Господарі
Пшениця, ячмінь, тритикале та кілька споріднених видів є основними господарями для P. graminis f. sp. tritici. Однак, близькоспоріднений збудник, P. graminis f. sp. secalisвірулентний для більшості ячменю та деяких видів пшениці (наприклад, лінія E). Puccinia graminis f. sp. secalis може атакувати Sr6 і Sr11 на фоні хазяїна лінії E (Luig, 1985). Первинним альтернативним хазяїном у природі був B. vulgaris L.вид, що походить з Європи, хоча інші види були сприйнятливі до нього в тепличних умовах. Альтернативні хазяї зазвичай сприйнятливі до всіх або до жодного з особливих форм P. graminis.
Альтернативні хости
Основний альтернативний хост для P. graminis це B. vulgarisяка була поширена людиною в північних широтах Північної півкулі. Завдяки своєму прямостоячому, кущистому росту з великою кількістю гострих колючок, він був чудовим живоплотом вздовж кордонів полів. З деревини робили рукоятки для інструментів, з кори отримували барвник, а з плодів варили джеми. Поселенці, які прибули до Північної Америки з Європи, привезли барбарис із собою. Разом з людьми барбарис поширився на захід і став натуралізованою рослиною від Пенсильванії через східні Дакоти і на південь до північно-східного Канзасу. Багато видів барбарису, магонії та махоберісу схильні до P. graminis (Roelfs, 1985b). Канадський барбарис або барбарис Аллегені, B. canadensisслід додати до цього списку.
Альтернативний господар був основним джерелом нових комбінацій генів вірулентності та агресивності патогена (Groth and Roelfs, 1982). Кількість варіацій патогену зробила селекцію на стійкість складною, якщо не неможливою. З комбінацій вірулентності, присутніх в одному році, багато з них не повторювалися наступного року, але з'являлося багато нових (Roelfs, 1982). Барбарис був джерелом інокуляту (аеціоспор) на початку сезону. Як правило, заражені кущі знаходилися поблизу зернових полів попереднього сезону, тому інокулят подорожував на короткі відстані без втрат у кількості та життєздатності, пов'язаних з транспортуванням на великі відстані. Один великий кущ барбарису може продукувати близько 64 х 109 аеціоспор за кілька тижнів (Stakman, 1923). Це еквівалентно щоденному виробництву 20 мільйонів уредіній на площі 400 м2.
Барбарис був основним джерелом збудника стеблової іржі в Данії (Hermansen, 1968) та Північній Америці (Roelfs, 1982). Успіх у зменшенні епідемій стеблової іржі в Північній Європі та Північній Америці після видалення барбарису поблизу пшеничних полів, ймовірно, призвів до переоцінки ролі цього альтернативного хазяїна у створенні щорічних епідемій в інших регіонах.
Стійкість до P. graminis в Берберис. Повідомляється, що це є наслідком нездатності патогена безпосередньо проникати крізь жорстку кутикулу (Melander and Craigie, 1927). Berberis vulgaris стає стійким до інфекції приблизно через 14 днів після розгортання листя. Однак, інфекції виникають на ягодах, колючках і стеблах, що свідчить про те, що зміцнення кутикули може бути не настільки важливим, як вважалося раніше. Під час нещодавнього тестування альтернативних сортів-хазяїв спостерігалася гіперчутлива реакція, особливо на Berberis spp. (Магонія).
Життєвий цикл
У більшості регіонів світу життєвий цикл P. graminis f. sp. tritici складається з безперервних уредініальних поколінь. Гриб поширюється повітряно-крапельним шляхом з уредініоспорами від однієї рослини пшениці до іншої та з поля на поле. Первинний посівний матеріал може виникати на місцевому рівні (ендемічний) з рослин-добровольців або переноситися на великі відстані (екзодемічний) вітром і осідати під час дощу. У Північній Америці P. graminis щорічно долає 2 000 км від південних посівів озимої пшениці до найпівнічніших посівів ярої пшениці за 90 днів або менше, і в уредініальному циклі може пережити зиму на рівні моря принаймні до 35° пн. ш. Сніг може забезпечити укриття, яке іноді дозволяє P. graminis виживати як інфекція на озимій пшениці навіть за суворих мінусових температур, що спостерігаються на 45° пн. ш. (Roelfs and Long, 1987). Статевий цикл рідко зустрічається, за винятком тихоокеанського північного заходу США (Roelfs and Groth, 1980) та деяких регіонів Європи (Spehar, 1975; Zadoks and Bouwman, 1985). Хоча статевий цикл забезпечує велике генетичне різноманіття (Roelfs and Groth, 1980), він також призводить до появи великої кількості менш пристосованих особин через часті рецесивні гени вірулентності (Roelfs and Groth, 1988) і перерозподіл генів агресивності. Puccinia graminis успішно розробила стратегію безстатевого розмноження, яка, вочевидь, дозволяє грибу зберігати необхідні гени у вигляді блоків, що час від часу змінюються шляхом мутацій та селекції.
Проростання урединіоспор починається через одну-три години за оптимальних температур (табл. 13.2) у присутності вільної води. Період зволоження або роси повинен тривати шість-вісім годин за сприятливої температури, щоб спори проросли і утворили зародкову трубку та аппресорій. Видимий розвиток зупиняється на стадії апперсоніуму, доки не буде забезпечено принаймні 10 000 люкс (оптимальним є 16 000 люкс) світла. Світло стимулює утворення проникаючого кілочка, який входить у закриту стому. Якщо зародок пересихає в період проростання, процес безповоротно зупиняється. Процес проникнення займає близько трьох годин при підвищенні температури з 18° до 30°C (Rowell, 1984). Потреба у світлі для інфікування робить P. graminis набагато складнішим для роботи в теплиці, ніж P. recondita. Швидше за все, світло рідко має вплив у польових умовах, за винятком випадків, коли роса зникає до світанку.
Уредініоспори розвиваються в пустулах (уредініях), які розривають епідерміс і оголюють маси червонувато-коричневих спор. Уредінії більші, ніж у листкової іржі, мають овальну або видовжену форму, з пухкою або розірваною епідермальною тканиною по краях (Рис. 16). Уредініоспори червонувато-коричневі, еліптичні або яйцеподібні, ехоподібні структури розміром від 24 до 32 мкм х 18-22 мкм (Рис. 17).
У міру дозрівання хазяїна телії (рис. 18) утворюються безпосередньо з уредініоспорових інфекцій або ж теліоспори можуть утворюватися в зрілій уредініальній пустулі. Теліоспори темно-коричневі двоклітинні, дещо клиноподібної форми. Вони мають товсті стінки і мають розмір від 40 до 60 мкм х 18-26 мкм. Апікальна клітина округла або злегка загострена (рис. 19). Теліоспори є дикаріотичними (n + n) і залишаються на соломі до весни. За цей час відбувається каріогамія і теліоспори стають диплоїдними (2n). Під впливом весняних дощів і сприятливих температур теліоспора проростає, припиняє мейоз і утворює чотириклітинний базидій. Кожна клітина утворює рильце з однією гаплоїдною базидіоспорою (1n). Гіалінові базидіоспори переносяться вітром на невеликі відстані (метри) до куща барбарису. Базидіоспори проростають і проникають безпосередньо. Для максимального зараження тканина листя барбарису повинна бути віком менше двох тижнів. Інфікування базидіоспорою призводить до утворення пікніди (1n). Пікніда продукує сприйнятливі гіфи та пікніоспори одного типу спарювання (+ або -), які слугують жіночими та чоловічими гаметами для гриба. Пікніоспори одного типу спарювання повинні бути перенесені на рецептивні гіфи протилежного типу спарювання, щоб ініціювати розвиток аеціоспор. Перенесення пікніоспор часто здійснюється комахами, яких приваблює пікніальний нектар, що виділяється пікнієм. Спарюванню + і - типів також можуть сприяти бризки дощу, розчісування листя, великі тварини та сусідні інфекції, які об'єднуються. Аеціоспори є дикаріотичними (n + n) і утворюються в аеції, як правило, на нижній поверхні листя барбарису через сім-десять днів після запліднення. Аеціоспори є продуктом генетичної рекомбінації і можуть відрізнятися за своєю вірулентністю та агресивністю. Ступінь варіації залежить від відмінностей між батьківськими ізолятами. Puccinia graminis f. sp. tritici схрещували з іншими особливими формами, і схрещування з P. graminis f. sp. secalis було відносно плідним (Johnson, 1949). В Австралії є дані, що вказують на рекомбінацію стеблової іржі пшениці та іржі скабруму (P. graminis f. sp. секас) (Burdon та ін., 1981; Luig та Watson, 1972).
Аеціоспори гідроскопічно вивільняються з аеції і переносяться повітрям на пшеницю на відстані від кількох метрів до кількох кілометрів. Аеціоспори потребують таких самих умов для інфікування, як і уредініоспори. Зараження аеціоспорами призводить до утворення дикаріотичних (n + n) уредіній з уредініоспорами. Потім повторюваний безстатевий цикл включає уредініоспори, які продукують уредінії приблизно за 14-денний цикл за оптимальних умов. У польових умовах, де температура сильно коливається, цикл може бути як подовженим, так і вкороченим. Як правило, нижчі температури в полі, принаймні на ранніх стадіях циклу розвитку культури, мають тенденцію до подовження латентного періоду. На півночі Індії латентний період стеблової іржі становив 31 день (Joshi and Palmer, 1973).
Джерело: Пшениця іржавіє: Р.П. Сінгх, Х. Хуерта-Еспіно, А.П. Рульфс
Модель інфекції Puccinia gramnis
Puccinia graminis інфікування відбувається після:
- Кілька годин вологого листя при оптимальних температурних умовах. Грибок може інфікувати в широкому діапазоні температур.
- Модель припускає, що інфекція потребує накопиченої погодинної температури повітря 80°C вологості листя в діапазоні температур повітря від 10°C до 35°C. Вона віддає перевагу трохи вищим температурам, ніж P. tritici а за інфекцією має слідувати сонячне світло.
Вологість листя для накопичених середньогодинних температур 80°C з наступним періодом освітлення (150 Вт/м²) для накопичених середньогодинних температур 30°C
- (if T <= 24°C then ∑(Th) else ∑ Th-24
- 10°C < Temp. < 35°C
У FieldClimate P. graminis інфекція розраховується за вищеописаних умов (зелена лінія). Якщо показано зараження 100%, це означає, що умови були сприятливими для гриба, і необхідно врахувати заходи захисту рослин (лікувальні).
Жовта іржа
Смугаста або жовта іржа пшениці, спричинена P. striiformis f. sp. tritici може бути настільки ж шкідливою, як і стеблова іржа. Однак смугаста іржа має нижчу оптимальну температуру для розвитку, що обмежує її поширення як основної хвороби в багатьох регіонах світу. Смугаста іржа є головним чином важливою хворобою пшениці взимку, ранньою весною або на великих висотах.
Смугаста іржа пшениці може бути причиною смугастої іржі ячменю (Stubbs, 1985). В Європі, в основному, на боротьбу зі смугастою іржею P. striiformis еволюціонував, який зазвичай зустрічається на ячмені і рідко на інших, окрім найбільш сприйнятливих, пшеницях (Zadoks, 1961). Puccinia striiformis f. sp. hordei був інтродукований до Південної Америки, де поширився по всьому континенту (Dubin and Stubbs, 1986), а пізніше був виявлений у Мексиці та Сполучених Штатах (Roelfs et al., 1992).
Епідеміологія
Пухирчатка смугаста (Puccinia striiformis) має найнижчі температурні вимоги серед трьох збудників іржі пшениці. Мінімальна, оптимальна і максимальна температури для зараження смугастою іржею становлять 0°, 11° і 23°C відповідно (Hogg et al., 1969). Пухирчатка смугаста (Puccinia striiformis) часто може активно перезимовувати на пшениці, посіяній восени. Більшість епідеміологічних досліджень були проведені в Європі і нещодавно переглянуті Zadoks і Bouwman (1985) та Rapilly (1979).
В Європі, P. striiformis перелітна іржа на пшениці (Zadoks, 1961). Кількість перезимувалої іржі залежить від кількості пшениці-добровольця, яка, в свою чергу, є функцією вологості в міжсезоння. Потім уредініоспори переносяться на пшеницю, посіяну восени. У північно-західній Європі зимують лише уредініоміцелії в живих тканинах листя, оскільки температура -4°C вбиває відкриті спороносні ураження. Приховані ураження можуть вижити, якщо лист виживе. В інших регіонах світу сніг може ізолювати спороношення від низьких температур, тому температура повітря нижче -4°C не знищує ураження іржею. Латентний період смугастої іржі взимку може становити до 118 днів, а під сніговим покривом - до 150 днів (Zadoks, 1961).
У районах поблизу екватора смугаста іржа має тенденцію до ендемічного циклу переміщення з менших висот на більші і повертається відповідно до фенології сільськогосподарських культур (Saari and Prescott, 1985). У більш північних широтах цикл стає довшим, і смугаста іржа переміщується з гірських районів до передгір'їв і рівнин.
Через свою чутливість до ультрафіолету уредініоспори смугастої іржі, ймовірно, не переносяться у життєздатному стані так далеко, як уредініоспори листкової та стеблової іржі. Maddison and Manners (1972) виявили, що уредініоспори смугастої іржі втричі чутливіші до ультрафіолету, ніж уредініоспори стеблової іржі. Проте, Zadoks (1961) повідомляє, що смугаста іржа переноситься вітром у життєздатному стані на відстань понад 800 км. Інтродукція смугастої іржі пшениці в Австралію і Південну Африку та смугастої іржі ячменю в Колумбію, ймовірно, відбулася за сприяння людини через авіаперельоти (Dubin and Stubbs, 1986; O'Brien? et al., 1980). Однак поширення смугастої іржі з Австралії до Нової Зеландії, на відстань 2 000 км, ймовірно, відбулося через повітряні уредініоспори (Beresford, 1982). Можливо, середньостатистична спора смугастої іржі має меншу ймовірність перенесення повітрям у життєздатному стані на великі відстані, ніж спори інших видів іржі пшениці, але, безумовно, деякі спори повинні бути здатні вижити при транспортуванні на великі відстані за особливих і сприятливих умов. Існує кілька прикладів послідовної міграції смугастої іржі. Вірулентність гена Yr2 (сорти Siete Cerros, Kalyansona і Mexipak) була вперше зафіксована в Туреччині, а через деякий час була простежена на субконтиненті Індії і Пакистану (Saari and Prescott, 1985) і може бути пов'язана з погодними системами, які називаються "Західним збуренням". Як уже згадувалося, смугаста іржа ячменю в Південній Америці мігрувала з місця її появи в Колумбії до Чилі протягом декількох років (Dubin and Stubbs, 1986).
Більшість досліджених регіонів світу мають місцеве або сусіднє джерело посівного матеріалу з пшениці-добровольця (Line, 1976; Stubbs, 1985; Zadoks and Bouwman, 1985). Однак деякі дані вказують на те, що інокулят походить з незернових трав (Hendrix та ін., 1965; Tollenaar і Houston, 1967). Майбутні дослідження епідеміології смугастої іржі повинні враховувати не тільки наявність іржі на прилеглих травах, а й той факт, що іржа повинна з'явитися на травах до її появи на зернових культурах. Необхідно довести, що фенотип вірулентності є однаковим для обох хазяїв, і що він переміщується з трави на пшеницю протягом вегетаційного періоду.
Епідемії смугастої іржі в Нідерландах можуть бути викликані лише одним уредініумом на гектар, що пережив зиму, якщо весняний сезон сприятливий для розвитку іржі (Zadoks and Bouwman, 1985). Візуальне виявлення одного уредініума на гектар є малоймовірним, проте в міру розвитку вогнищ навколо початкового уредініума його стає дедалі легше виявити.
Господарі
Пухирчатка смугаста (Puccinia striiformis) патоген трав і зернових культур: пшениці, ячменю, тритикале та жита. Смугаста іржа - єдина іржа пшениці, яка постійно поширюється за межі початкової точки зараження в рослині.
Альтернативні хости
Відомі лише теліальна та уредініальна стадії смугастої іржі. Ерікссон і Хеннінг (1894) шукали альтернативного хазяїна серед видів Boraginaceae. Tranzschel (1934) припустив, що Aecidium valerianellaіржа валеріанелли, може бути пов'язана з P. striiformis. Мейнс (1933) вважав, що P. koeleriae Arth., P. arrhenatheri Eriks. і P. montanensis Ellisякі мають аецидний стан на Berberis та Mahonia spp. можуть бути пов'язані з P. striiformis.
Штрайб (1937) та Харт і Беккер (1939) зазнали невдачі у спробах заразити Берберис., Магонія і Valerianella spp. Альтернативний господар іржі, P. agropyri Елл і Еван, це Клематис вітальба. Ця іржа дуже нагадує P. striiformis Таким чином, Viennot-Bourgin (1934) припустив, що альтернативним господарем смугастої іржі може бути родина клематисових. Теліоспори швидко проростають, утворюючи базидіоспори (Wright and Lennard, 1980), і теліоспори, ймовірно, не допомагають грибу вижити взимку. Епідеміологічним фактором, який слід враховувати, є можливість інфікування альтернативного хазяїна наприкінці літа, так що аеціоспори можуть інфікувати щойно засіяну пшеницю або трави пізньої прохолодної пори року. У деяких високогірних районах Західної Азії для дозрівання врожаю пшениці може знадобитися 13 місяців. У таких випадках можливе ранньовесняне інфікування альтернативного хазяїна.
Життєвий цикл
Пухирчатка смугаста (Puccinia striiformis) найімовірніше, є геміформною іржею, оскільки її життєвий цикл складається лише з уредініальної та теліальної стадій. Уредії розвиваються у вигляді вузьких, жовтих, лінійних смуг, переважно на листках і колосках (Рис. 20). При зараженні качанів пустули з'являються на внутрішніх поверхнях остюків і лемми (Рис. 21). Уредініоспори від жовтого до оранжевого кольору, більш-менш кулясті, ехоподібні, діаметром від 28 до 34 мкм (Рис. 22). Під час теліального розвитку на листках утворюються вузькі чорні смуги. Теліоспори темно-коричневі, двоклітинні, за розміром і формою подібні до P. triticina (Рис. 23). Популяції смугастої іржі можуть існувати, змінювати вірулентність і спричиняти епідемії незалежно від альтернативного хазяїна. Уредініоспори є єдиним відомим джерелом інокуляту для пшениці, вони проростають і заражають при більш низьких температурах.
Джерело: Пшениця іржавіє: Р.П. Сінгх, Х. Хуерта-Еспіно, А.П. Рульфс
Пухирчатка смугаста (Puccinia striiformis) Модель інфекції
Пухирчатка смугаста (Puccinia striiformis) це іржа пшениці прохолодного клімату, оптимальна температура для якої починається від 15°C. Зараження відбувається після декількох годин намокання листя за оптимальних температурних умов. Грибок може інфікувати в широкому діапазоні температур. Модель припускає, що для зараження необхідна накопичена погодинна температура повітря 80°C вологості листя в діапазоні температур повітря від 5°C до 20°C. У періоди з низькою інтенсивністю освітлення інфікування не відбувається.
Вологість і освітленість листя для накопичених середньогодинних температур для 80°C
- (if T )
- 5°C < Temp. < 20°C
У FieldClimate інфекція з P. striiformis показано 23 серпня після тривалого періоду зволоження листя при температурі близько 15°C (червона лінія). Після цього необхідно враховувати лікувальні стратегії захисту рослин (системні), тоді як до того, як інфекція досягла рівня 100%, можна застосовувати захисні засоби.
Фузаріозна сажка
Фузаріозна сажка або парша дрібних зерен викликається грибком Fusarium graminearum (Schwabe), хоча Нідерланди та інші регіони Центральної Європи повідомляють F. culmorum як найбільш поширений вид (Snidjers, 1989). У Польщі F. culmorum, F. graminearum і F. nivale показали схожі рівні вірулентності від помірного до сильного, тоді як F. avenaceum виявився середньо- та помірно вірулентним. Однак у кількох дослідженнях, спрямованих на ідентифікацію збудника, аж 18 Fusarium spp. були виділені та ідентифіковані (Mihuta-Grimm and Foster, 1989; Reis, 1985).
Стаття від L. ГілкрістПарша Х.Я. Дубіна поширена в теплих, вологих регіонах, де цвітіння збігається з періодами дощів. Захворюваність на цю хворобу зростала протягом останніх десяти років з різних причин. Мабуть, найважливішою причиною є збільшення площ, на яких пшениця сіється з кукурудзою або іншими зерновими культурами. Іншими причинами є зміни в системі землеробства з метою захисту ґрунтів та переміщення посівів пшениці з традиційних на більш вологі, нетрадиційні райони (Gilchrist et al., 1997).
Фузаріозна парша спричиняє значні виробничі втрати в усьому світі, які можуть сягати 50 відсотків. Аналогічно, в Парагваї погодні умови в 1972 і 1975 роках сприяли епідеміям фузаріозу і септоріозу, які разом призвели до втрат до 70 відсотків (Viedma, 1989). Польща, Нідерланди, Великобританія, колишня Чехословаччина, Російська Федерація, Франція та Австрія є деякими з європейських країн, які повідомляють про захворюваність паршею. Території Канади, США, Мексики, Гватемали, Бразилії, Еквадору, Уругваю та Аргентини в Америці сильно уражені фузаріозом (Ireta and Gilchrist, 1994).
Парша може спричинити значні втрати врожаю та якості, а також токсикози у тварин і людей (Ireta and Gilchrist, 1994; Baht et al., 1989; Luo, 1988; Snidjers, 1989; Marasas et al., 1988). Збитки від парші в Сполучених Штатах оцінювалися більш ніж в 1 млрд. доларів США в 1993 році і 1 млрд. 500 млн. доларів США в 1994 році. У Китаї, за оцінками, парша може вражати до 7 млн. га, і в роки епідемії може бути втрачено 2,5 млн. тонн зерна. Захворювання, пов'язані з фузаріозним мікотоксином у людей, були зареєстровані в Китаї, Індії та Японії, тоді як захворювання у тварин були зареєстровані в багатьох частинах світу (Dubin et al., 1997).
На сьогоднішній день у всьому світі існують правила щодо мікотоксинів (Van Egmond та Dekker, 1995). Однак у багатьох країнах ці норми не застосовуються, і багато людей, особливо в сільській місцевості, вживають зернові без будь-якого контролю, або у вигляді зерен, або опосередковано у вигляді м'яса, отриманого від тварин, яких годували зараженим зерном. У таблиці 16.1 показано основні ефекти на свиней і птицю, спричинені найбільш важливими токсинами, що виробляються деякими Фузаріоз видів.
Вологі та теплі погодні умови в період від колосіння до дозрівання посилюють ураженість паршею. Точкою проникнення F. graminearum є колос, особливо квіткові органи. Це впливає на зав'язування насіння та налив зерна. Заражені колоски швидко втрачають хлорофіл і стають блідими. Пізніше вони набувають рожевого або персикового кольору, особливо біля основи та країв колосків (Рис. 41). Якщо умови навколишнього середовища залишаються сприятливими, інфекція поширюється на сусідні колоски, а в деяких випадках може вразити весь колос, включаючи рахіс і його квітконіжку. За сильного розвитку інфекції пошкоджені зерна покриваються міцелієм і набувають вигляду рожевої ватоподібної маси. За помірного рівня розвитку хвороби зерно може бути зморщеним, малої ваги та білуватого кольору (надгробне зерно).
Основні токсичні ефекти на свиней та птицю, спричинені найбільш важливими токсинами, що виробляються деякими видами Fusarium
| Мікотоксин | Клінічні ознаки |
| Зеараленон | Набрякла червона вульва; випадіння піхви у свиней; у поросят-сисунів може спостерігатися збільшення вульви; проблеми з фертильністю |
| Ботоксин (дезоксиніваленол, DON) | Зниження споживання корму та приросту ваги у свиней з концентрацією ДОН >2 мг/кг корму; блювота; відмова від корму при дуже високих концентраціях ДОН (>20 мг/кг корму)a |
| Інші трихотецени Т-2 токсин HT-2 токсин Діацетоксісцирпенол | Більш токсичний, ніж DON; зниження споживання корму; блювота; подразнення шкіри та шлунково-кишкового тракту; нейротоксичність; ненормальне потомство; підвищена чутливість до хвороб; кровотечі |
| Охаратоксин | Вражає переважно проксимальні канальці нирок у свиней та птиці; нирки сильно збільшені та бліді; у птиці - жирова дистрофія печінки |
амг/кг = частин на мільйон (ppm).
Джерело: Тренгольм та ін., 1984.
Fusarium graminearum (Plate 42) може вражати рослини пшениці на всіх стадіях росту, викликаючи хвороби проростків, стебла та кореневі гнилі. Первинна інфекція може виникати через аскоспори або макроконідії, що осідають на колосках та видавлених пиляках. Для успішного зараження колосків макроконідіями зазвичай достатньо температури від 10° до 30°C і відносної вологості вище 95% протягом 40-60 годин (Ireta, 1989).
Fusarium graminearum є одним з небагатьох Фузаріоз вид, який утворює перитеції в польових умовах (Платівка 43, Платівка, 44). Перитеції представляють собою статеву стадію гриба Gibberella zeae і утворюються на пшеничній клейковині. Перитеції відіграють важливу роль у виживанні патогена з року в рік (Khonga and Sutton, 1988) і співіснують з міцелієм у залишках попередньої культури, утворюючи початкове джерело інокуляту для розвитку парші. Дослідження, проведені в Китаї, показали, що найнижча температура для розвитку перитеціїв становить від 7° до 10°C, а найбільш придатна - від 15° до 20°C. Найнижча вологість ґрунту для утворення перитеціїв становила 50-60%, а найбільш придатна - 70-80% (Wang, 1997).
Фактори, що визначають розвиток хвороби, включають клімат, рівень посівного матеріалу та стадію росту пшениці. Епідемії парші пшениці залежать в основному від кількості первинного, а не вторинного посівного матеріалу. Інвазія відбувається переважно в період цвітіння. Вторинне зараження конідіями (вклейка 45) відбувається після того, як на полі з'являються хворі колоски.
Пожнивні рештки та культурні практики відіграють важливу роль у збереженні F. graminearum і, як наслідок, епідемії. Інфекції на пшениці, висіяній на полях з кукурудзяними рештками, можуть бути в два-три рази сильнішими (Teich and Nelson, 1984). Загалом, патоген був сапрофітом лише на стерні рису в районах рисово-пшеничної сівозміни та на стеблах кукурудзи в посушливих районах Китаю (Wang, 1997). Якщо залишки заорюються, виживання перитеції знижується і зменшується первинне джерело інокуляту (Reis, 1989).
Fusarium graminearum є факультативним паразитом і патогенним для багатьох інших трав, включаючи звичайні бур'яни та зернові культури (жито, рис, ячмінь і тритикале). Якщо такі практики, як сівозміна з не-господарями або поводження з пожнивними рештками, не є ефективними окремо, вони можуть у комплексі зменшити джерело первинного збудника хвороби. Контроль хвороб ефективно ґрунтується на інтегрованому управлінні, що включає належні агрономічні практики, використання стійких або толерантних сортів і застосування хімічних засобів.
Біологія фузаріозної сажки
Випадкові патогени
ВГК викликається грибками роду Fusarium. Найпоширенішими видами, що викликають FHB, є Fusarium graminearum (сексуальна стадія - Gibberella zeae). Це той самий грибок, який часто асоціюється з стебловою гниллю кукурудзи. Ще один Фузаріоз видами, що викликають FHB, є Fusarium culmorum. Обидва. F. graminearum і F. culmorum також може викликати кореневу гниль дрібних зерен. На ячмені, два інших Фузаріоз видів, F. poae і F. avenaceumтакож може спричинити загнивання ядра.
Виживання та поширення
Гриб зберігається і розмножується на заражених пожнивних рештках дрібних зернових і кукурудзи. У вологу погоду спори грибів переносяться вітром або розбризкуються на качани зернових культур. Спори можуть потрапляти зсередини посіву або заноситися вітром з сусідніх посівів, іноді на значні відстані. Пшениця і тверда пшениця сприйнятливі до інфекції з періоду цвітіння (запилення) до стадії твердого тіста розвитку ядра. Спори гриба-збудника можуть потрапляти на відкриті пиляки під час цвітіння, а потім проростати в зерно, остюки або інші частини колоса. Для ярого ячменю, який цвіте, коли качан знаходиться в колосі, зараження найчастіше відбувається після періоду цвітіння, коли качан пробивається крізь листкову піхву. Інфекція в обох культурах може тривати до дозрівання зерна за сприятливих умов навколишнього середовища для організму (організмів).
Найсприятливішими умовами для інфікування є тривалі періоди (від 48 до 72 годин) високої вологості та високої температури (від 75 до 85 градусів за Фаренгейтом (від 24°C до 30°C)). Однак інфікування відбувається і при більш низьких температурах, коли висока вологість зберігається довше, ніж 72 години. Ранні інфекції можуть утворювати спори, що переносяться повітрям, які спричиняють вторинне поширення хвороби, особливо якщо культура має нерівномірне цвітіння через пізні кущіння.
Оскільки розвиток FHB залежить від сприятливих умов навколишнього середовища від цвітіння (поява качанів у ячменю) до розвитку ядра, частота виникнення та інтенсивність хвороби змінюється з року в рік. Комбінація факторів, які можуть призвести до значних втрат врожаю та якості, включає в себе: надлишок посівного матеріалу, тривалі або повторювані періоди вологості та високої вологості в період цвітіння (поява колоса у ячменю) до формування ядра, а також використання дуже сприйнятливого сорту.
Модель інфекції фузаріозної сажки
Відомо, що грибкові агенти, які належать до комплексу фузаріозної сажки пшениці, полюбляють теплі температури від 20°C до 30°C та тривалі вологі періоди. Кількаденні періоди вологості листя призводять до появи ранніх видимих симптомів. Але симптоми можуть з'явитися і після більш тривалого латентного періоду, якщо інфекція супроводжується періодом зволоження листя протягом 18 годин або навіть коротшого часу. Симптоми можуть з'явитися і після штучної інокуляції при температурі 15°C.
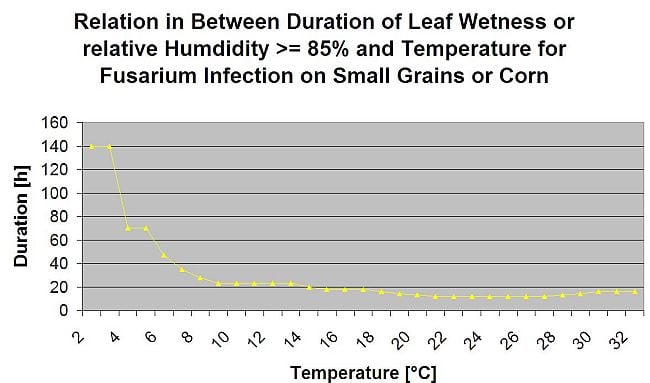


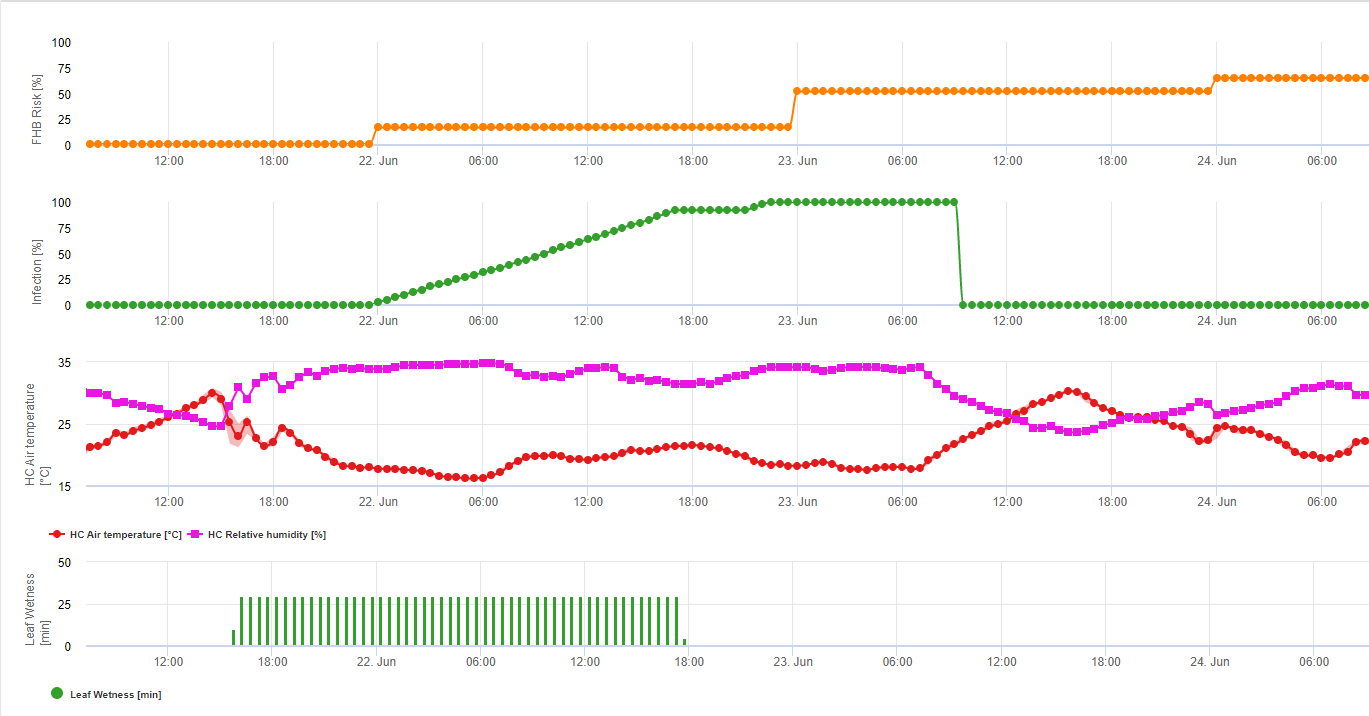
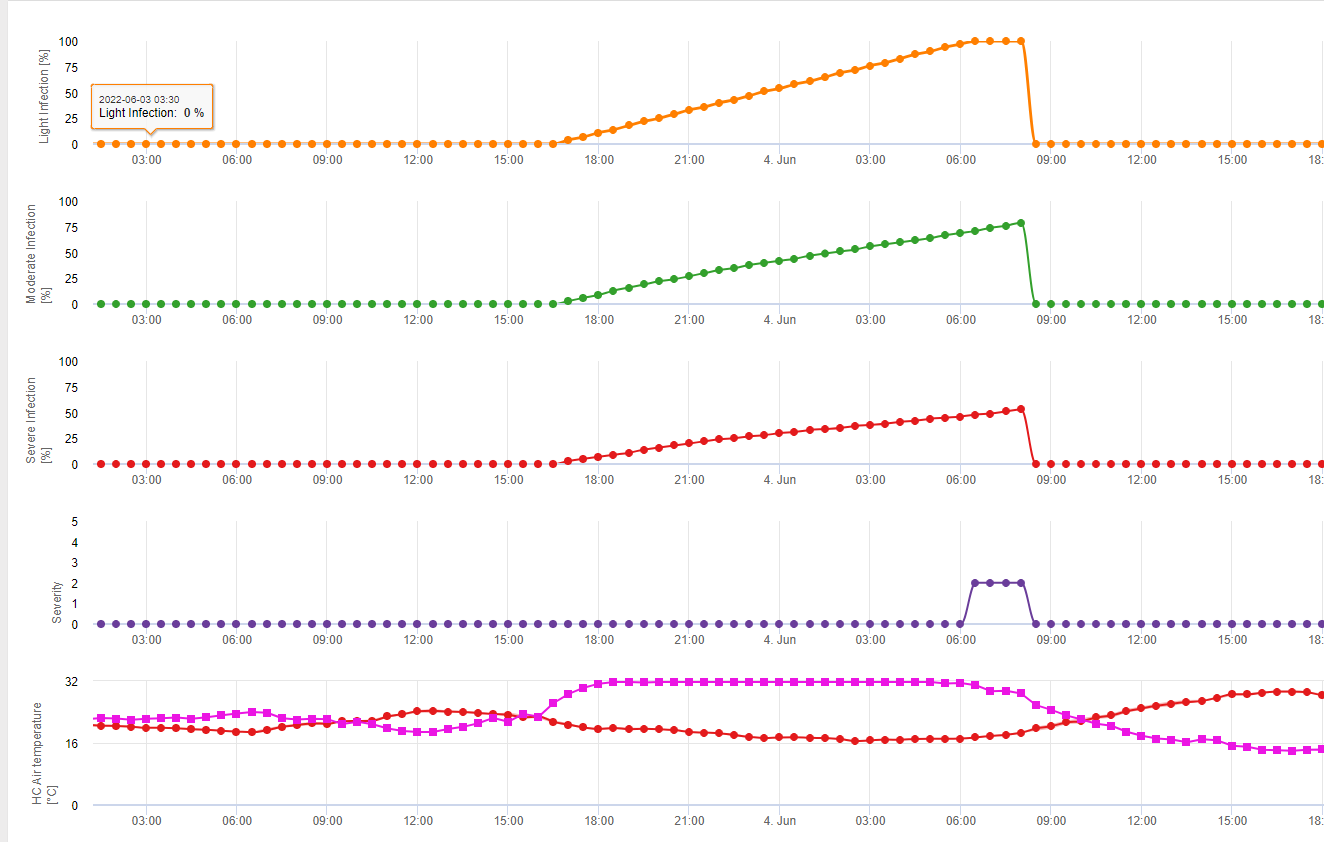
Підсумовуючи всі різні комбінації температур і вологості, які ми знайшли в літературі, ми вирішили вказати на інфекцію фузаріозної сажки, якщо температура і період вологості листя або періоди з відносною вологістю понад 85% перевищують значення, наведені на наступному графіку.
Інфекції починають розвиватися при дощі з опадами 2 мм. Зараження фузаріозом можна вважати, якщо показник розвитку інфекції досягає 100%. Розрахунок цього показника розвитку відбувається за співвідношенням між тривалістю вологих умов і температурою, що показано на графіку вище.
Ця модель використовується для візуалізації днів інфікування та кліматичних умов під час клімату. Знання фермерів про стадію розвитку різних сортів пшениці дає можливість прийняти рішення про застосування лікувального спрею одразу після зараження.
Попередження про мікотоксин фузаріозу
Випробування на зараження фузаріозною сажкою з подовженим періодом вологості листя призводять до високого вмісту мікотоксинів. З цієї інформації випливає, що період намокання листя протягом 48 годин або більше на стадіях 61 і 69 призводить до високого ризику накопичення мікотоксинів. Досліди, проведені під час аналізу ДОН у комерційно вирощуваній пшениці, показали, що періоди вологості листя, достатньо тривалі для інфікування після первинної інфекції на стадії 61-69, також можуть підвищити значення ДОН. У випадку більш тривалих періодів вологості листя мікотоксини можуть збільшуватися до стадії 85. FieldClimate накопичує показник ризику, пропорційний прогресу інфекції, для кожного успішного періоду інфікування протягом періоду, який був обраний для цих розрахунків. 6 щойно завершених періодів інфікування призведуть до ризику 100%. Зазвичай період вологості листя, що призводить до фузаріозної інфекції, довший, ніж мінімально необхідний. Тому більшість фузаріозних інфекцій призводять до збільшення ризику більш ніж на 17%. Значення ризику, що вказує на проблемну ситуацію з мікотоксинами, залежить від історії поля. Пшениця, вирощена після необробленої кукурудзи або необроблена пшениця після необробленої кукурудзи, може нести лише невеликий ризик, якщо вона не була обприскана в оптимальній ситуації. У необприсканій пшениці слід очікувати підвищених значень DON вже після 35% ризику. Пшениця після необробленої пшениці після будь-якої іншої культури, крім кукурудзи або пшениці, може нести вищий ризик 50%. Якщо ми маємо пшеницю після кукурудзи або пшениці з обробітком ґрунту, ризик може бути збільшений до 70%. Пшениця першого року повинна бути протестована на DON, якщо ризик перевищує 100%.
1) Модель ризику фузаріозної сажки який показує ризиковані періоди часу для інфікування. При досягненні інфікування 100% (зелена лінія) ризик (синя лінія) є дуже високим і умови для грибка є сприятливими для інфікування. Залежно від методу застосування (лікувальний, профілактичний) ризикований період часу показаний синьою лінією.
2) Фузаріозна сажка: У цій моделі інфікування FHB розраховується за допомогою опадів (необхідно 2 мм), відносної вологості (вище 85%) або вологості листя, температури під час процесу. Якщо інфікованість досягає 100%, то оптимальні умови для розвитку грибкового патогену досягнуті. Далі модель розраховує ризик мікотоксину FHB.
Плямиста пляма на листі
Існує дві основні септоріозні хвороби пшениці. Це септоріозна плямистість, спричинена грибком Septoria tritici Septoria tritici (телеоморф: Mycophaerella graminicola), та Септорія вузлувата (Septoria nodorum) плямистості, спричиненої грибком Septoria nodorum (телеоморф: Leptosphaeria nodorum). Обидві хвороби спричиняють серйозні втрати врожаю, які коливаються від 31 до 53% (Eyal, 1981; Babadoost and Herbert, 1984; Polley and Thomas, 1991). У всьому світі уражено понад 50 млн га пшениці, яка переважно вирощується в районах з великою кількістю опадів. Протягом останніх 25 років ці хвороби зростали і стали основним обмежувальним фактором для виробництва пшениці в певних регіонах. Під час сильних епідемій зерна сприйнятливих сортів пшениці стають щуплими і не придатними для помелу. Епідемії септоріозної та нодорозної плямистостей пшениці пов'язані зі сприятливими погодними умовами (часті дощі та помірні температури), специфічними культуральними практиками, доступністю посівного матеріалу та наявністю сприйнятливих сортів пшениці (Eyal et al., 1987).
Septoria spp. Біологія
За Еріком де Вольфом, пляма Septoria Tritici, Університет штату Канзас, квітень 2008 року Septoria tritici плямистість, відома як крапчаста плямистість листя, спричинена грибком Septoria tritici. Вона поширена в усіх регіонах світу, де вирощують пшеницю, і є серйозною проблемою в багатьох регіонах. Найбільшої шкоди септоріозна плямистість завдає, коли хвороба вражає верхні листки і качани сприйнятливих сортів наприкінці сезону.
Симптоми
Septoria tritici Симптоми плямистості вперше з'являються восени. Початковими симптомами є невеликі жовті плями на листі. З віком ці ураження часто набувають світло-коричневого відтінку, а плодові тіла гриба можна помітити на остюках, вбудовані в уражені ділянки. Ураження мають неправильну форму і варіюються від еліптичних до довгих і вузьких (рис. 1). Ураження містять маленькі, круглі, чорні цятки, які є плодовими тілами гриба. Чорні плодові тіла схожі на зерна чорного перцю і зазвичай їх можна побачити без допомоги лупи. Хвороба починається з нижніх листків і поступово переходить на прапорцевий листок. Листові піхви також схильні до ураження. У вологі роки крапчаста плямистість листя може переходити на качани і викликати коричневі ураження на колоссях і остюках, відомі як плямистість колосся. З віком ці ураження часто набувають світло-коричневого кольору, а плодові тіла гриба часто можна побачити вбудованими в ураження на остюках.
Фаза плямистості може спричинити значні втрати врожаю, але взаємозв'язок між тяжкістю хвороби та втратами врожаю недостатньо вивчений. Septoria tritici плямистість можна сплутати з іншими хворобами листя, які мають дуже схожі симптоми: плямистістю та Stagonspora nodorum наприклад, плямистості. Зазвичай рослини уражуються більш ніж однією з цих хвороб листя, і для точного діагностування найбільш поширених хвороб може знадобитися лабораторне обстеження. Лабораторне дослідження майже завжди потрібне, щоб визначити причину появи плямистостей. Знання виду не є важливим для прийняття рішення щодо обприскування, оскільки всі три хвороби однаково реагують на фунгіциди. Однак знання того, які хвороби найбільш поширені, є важливою частиною селекції сортів, оскільки різні гени контролюють стійкість до хвороб.
Найнадійніший спосіб відрізнити плямистість Septoria tritici від інших захворювань - це наявність чорних плодових тіл гриба. Гриб, що спричиняє засмагу, не утворює такого типу репродуктивних структур. Однак у вологих умовах гриб, що викликає плямистість Stagonospora nodorum, утворює світло-коричневі плодові тіла. Крім різниці в кольорі, ці структури також менші, ніж ті, що утворює Septoria tritici.
Життєвий цикл
Septoria tritici виживає влітку на залишках попереднього врожаю пшениці та ініціює інфікування восени. Існують певні докази того, що гриб здатний виживати в асоціації з іншими рослинами-господарями та насінням пшениці. Ці джерела гриба, ймовірно, є найбільш важливими за відсутності пшеничних решток. Незалежно від сівозміни або практики управління пожнивними рештками, зазвичай є достатньо посівного матеріалу, щоб ініціювати осінню інфекцію. Septoria tritici плямистості сприяє прохолодна волога погода. Оптимальний температурний діапазон - від 16 до 21 °C, проте інфікування може відбуватися і взимку за температури до 5 °C. Для зараження потрібно, щоб листя було вологим щонайменше 6 годин, а для максимального зараження - до 48 годин. Після зараження грибу потрібно від 21 до 28 днів, щоб розвинути характерні чорні плодові тіла і виробити нове покоління спор. Спори, що утворюються в цих плодових тілах, виділяються у вигляді липкої маси і потребують дощу, щоб потрапити на верхні листки і качани.
Зараження через Septoria tritici
Пікнідіоспори S. tritici проростають у вільній воді з обох кінців спори або з інтеркалярних клітин (Weber, 1922). Проростання спор починається приблизно через 12 годин після контакту з листком. Зародкові трубки ростуть хаотично по поверхні листка. Вебер (1922) спостерігав лише пряме проникнення між клітинами епідермісу, але інші дослідники дійшли висновку, що проникнення як через відкриті, так і через закриті продихи є основним способом проникнення в хазяїна (Benedict, 1971; Cohen and Eyal, 1993; Hilu and Bever, 1957). Кема та ін. (1996) спостерігали лише продихове проникнення. Гіфи, що проростають через продихи, звужуються до діаметру близько 1 мкм, а потім стають ширшими після досягнення підпродихової порожнини.
Гіфи ростуть паралельно поверхні листка під клітинами епідермісу, потім через мезофіл до клітин нижнього епідермісу, але не в епідерміс. Гаусторії не утворюються, а ріст гіф обмежується клітинами склеренхіми навколо судинних пучків, за винятком випадків, коли гіфи дуже щільні. Судинні пучки не інвазуються. Гіфи ростуть міжклітинно вздовж клітинних стінок через мезофіл, розгалужуючись на перегородці або в середині клітини. Макроскопічні симптоми не з'являються протягом приблизно 9 днів, за винятком випадкових мертвих клітин, але клітини мезофілу швидко гинуть через 11 днів. Пікніди розвиваються в субтоматичних камерах. Гіфи рідко проростають у клітини хазяїна (Hilu and Bever, 1957; Kema et al, 1996; Weber, 1922).
Успішне зараження відбувається лише після щонайменше 20 годин високої вологості. Лише кілька коричневих плям розвиваються, якщо листя залишається вологим протягом 5-10 годин після осадження спор (Holmes and Colhoun, 1974) або до 24 годин (Kema et al., 1996). Відносини хазяїн-паразит є однаковими як на стійких, так і на сприйнятливих пшеницях. Проростання спор на поверхні листя однакове незалежно від сприйнятливості. Кількість успішних проникнень приблизно однакова, але ріст гіф відбувається швидше на сприйнятливих сортах, що призводить до більшого ураження. Гіфи поширюються 44 Сесія 2 - Б.М. Кунфер за межі некротичних ділянок у всіх сортів. Токсин може відігравати певну роль у патогенезі (Cohen and Eyal, 1993; Hilu and Bever, 1957). На противагу цьому, колонізація була значно знижена на стійкій лінії (Kema et al., 1996).
Стагоноспори (септоріоз) та збудники септоріозу зернових: Інфекційний процес
Б.М. Канфер, кафедра патології рослин, Університет Джорджії, Гріффін, штат Джорджія
Процес зараження найбільш інтенсивно вивчався для Stagonospora (Septoria) nodorum та Septoria tritici. Одне поглиблене дослідження на тему Septoria passerinii є доступною. Майже вся інформація стосується інфікування пікнідоспорами. Однак процес інфікування іншими споровими формами досить схожий. Представлена інформація здебільшого стосується інфікування листків за оптимальних умов. Деякі дослідження були проведені з інтактними проростками, тоді як інші - з відокремленими листками. Інфікування колеоптиля та проростка пшениці S. nodorum був детально описаний Бейкером (1971) і переглянутий Кунфером (1983). Хоча точних порівнянь не проводилося, схоже, що інфекційний процес має багато спільного в кожній системі хазяїн-паразит і є типовим для багатьох некротрофних патогенів. Інформація про фактори, що впливають на розвиток симптомів і вираженість хвороби, не включена, але була розглянута іншими авторами (Eyal et al., 1987; King et al., 1983; Shipton et al., 1971). Включено короткий опис факторів, що впливають на тривалість життя спор на поверхні листка.
Роль циркуляції та виживання спор на поверхні листка Найбільш детальна інформація про функцію кільця, що оточує пікнідоспори, які виділяються з пікнідія, міститься у S. nodorum. Циррус - це гель, що складається з білкових і сахаридних сполук. Його склад і функції подібні до складу та функцій інших грибів Sphaeropsidales (Fournet, 1969; Fournet et al., 1970; Griffiths and Peverett, 1980). Основними функціями компонентів цирруса є захист пікнідіоспор від десикації та запобігання передчасному проростанню.
Циррус захищає пікнідоспори так, що деякі з них залишаються життєздатними щонайменше 28 днів (Fournet, 1969). Коли циррус розводили водою, якщо концентрація розчину цирруса була >20%, проростало менше 10% пікнідіоспор. При меншій концентрації компоненти забезпечують поживні речовини, які стимулюють проростання спор і подовження зародкових трубок. Довжина зародкових трубок збільшувалася до концентрації цирруса 15%, а потім помірно зменшувалася за вищих концентрацій (Harrower, 1976). Бреннан та ін. (Brennan et al., 1986) повідомили про більшу схожість у розведеній рідині цирруса. Компоненти вихору знижували схожість при відносній вологості 10-60%. Після того, як спори дисперговані, стимулюючий вплив циррусної рідини, ймовірно, є незначним (Гріффітс і Певеретт, 1980).
При відносній вологості 35-45% спори S. tritici в циррі залишалися життєздатними щонайменше 60 днів (Gough and Lee, 1985). Компоненти цирруса можуть діяти як інгібітори проростання спор, або ж високий осмотичний потенціал цирруса може перешкоджати проростанню. Пікнідіоспори S. nodorum не виживали протягом 24 годин при відносній вологості вище 80% при 20 C. Спори виживали два тижні або більше при відносній вологості <10% (Griffiths and Peverett, 1980). Коли рідина цирруса S. nodorum розбавляли водою, близько двох третин пікнідоспор втрачали життєздатність протягом 8 годин, а через 30 годин при денному світлі проростала лише 5%. Коли спори зберігалися в темряві, 40% залишалися життєздатними через 30 годин (Brennan et al., 1986).
Сухі конідії S. nodorumу затінку та під прямими сонячними променями виживали на відкритому повітрі щонайменше 56 годин (Fernandes and Hendrix, 1986a). Проростання пікнідоспор S. nodorum пригнічувалося безперервним УФ-В (280-320 нм), тоді як проростання S. tritici не було. Подовження зародкових трубок під впливом безперервного ультрафіолетового випромінювання пригнічувалося для обох грибів порівняно з темрявою (Rasanayagam et al., 1995).
Зараження Septoria nodorum
Процес проникнення в організм хазяїна і розвиток S. nodorum в листі було детально вивчено кількома дослідниками (Baker and Smith, 1978, Bird and Ride 1981, Karjalainen and Lounatmaa, 1986; Keon and Hargreaves, 1984; Straley, 1979; Weber, 1922). Пікнідіоспори, як правило, розташовуються в заглибленнях між двома епідермальними клітинами, і багато спроб проникнення в листки починаються саме там. Спори проростають на поверхні листка у відповідь на вільну вологу (Fernandes and Hendrix, 1986b). Вони починають проростати через 2-3 години після осадження, а через 8 годин проростання може досягати 90%. Проникнення в листя починається приблизно через 10 годин після осадження спор (Bird and Ride, 1981; Brönnimann et al., 1972; Holmes and Colhoun, 1974).
На початку проростання зародкова трубка оточена аморфним матеріалом, який прикріплюється до листка. Зародкові трубки, що ростуть з обох кінців спори та з інтеркалярних клітин, мають тенденцію рости вздовж заглиблень між клітинами і часто орієнтовані вздовж довгої осі листка (O'Reilly and Downes, 1986). Гіфи зі спор, що не знаходяться в заглибленнях, ростуть хаотично з рідкісним розгалуженням (Straley, 1979). Утворюється аппресорій з інфекційним кілочком, який проникає крізь кутикулу і периклінальну стінку епідермальних клітин безпосередньо в клітинний просвіт, що призводить до швидкої загибелі клітини.
У багатьох випадках проникнення спочатку відбувається субкутикулярно або бічний ріст гіфи всередині клітинної стінки, перш ніж вона проростає в цитоплазму (Bird and Ride, 1981; O'Reilly and Downes, 1986). Проникнення як через відкриті, так і через закриті продихи також відбувається і може бути швидшим, ніж пряме проникнення (Harrower, 1976; Jenkins, 1978; O'Reilly and Downes, 1986; Straley, 1979). Зародкові трубки розгалужуються на продихах і з'єднаннях клітин епідермісу. Проникнення зародкової трубки в продихи може відбуватися без утворення продиху. Іноді проникнення відбувається через трихоми (Straley, 1979). Очевидно, більшість спроб проникнення є невдалими, оскільки в клітинах на місці спроби проникнення утворюються щільні сосочки (Karjalainen and Lounatmaa, 1986; Bird and Ride, 1981).
Після проникнення клітини епідермісу швидко відмирають і здерев'яніють, а гіфи вростають у мезофіл. Клітини мезофілу деформуються, і здерев'янілий матеріал відкладається поза деякими клітинами, які потім руйнуються. Здерев'яніння відбувається до того, як гіфи досягнуть клітини. Процес однаковий у всіх сортів, але у стійких сортів розвивається повільніше. Гіфи ростуть міжклітинно між клітинами епідермісу, а потім у мезофіл. Після проникнення в мезофіл руйнування хлоропластів починається через 6-9 днів (Karjalainen and Lounatmaa, 1986).
Однак швидкість фотосинтезу починає знижуватися вже через добу після зараження і до появи симптомів (Krupinsky et al, 1973). Склеренхімна тканина навколо судинних пучків запобігає інфікуванню судинної тканини. Судинні пучки блокують поширення гіфів через мезофіл, за винятком випадків, коли тканина склеренхіми молода і не повністю сформована (Baker and Smith, 1978).
Stagonospora nodorum виділяє широкий спектр ферментів, що руйнують клітинну стінку, включаючи амілазу, пектинметилестеразу, полігалактуронази, ксиланази та целюлазу in vitro та під час зараження листя пшениці (Baker, 1969; Lehtinen, 1993; Magro, 1984). Інформація, пов'язана з деградацією клітинної стінки ферментами, узгоджується з гістологічними спостереженнями. Ці ферменти можуть діяти разом з токсинами. Чутливість до ферментів може бути пов'язана зі стійкістю та швидкістю колонізації грибів (Magro, 1984). Як і багато некротрофів, збудники септоріозу та стагоноспори продукують фітотоксичні сполуки in vitro. Погіршення стану і загибель клітин до початку росту гіфів у тканину мезофілу (Bird and Ride, 1981) узгоджується з продукуванням токсинів. Однак, остаточна роль токсинів в інфекційному процесі та їх зв'язок зі стійкістю хазяїна не встановлені (Bethenod et al, 1982; Bousquet et al, 1980; Essad and Bousquet, 1981; King et al, 1983). Відмінності в діапазоні господарів між адаптованими до пшениці та ячменю штамами S. nodorum може бути пов'язана з виробленням токсинів (Bousquet і Kollmann, 1998). Ініціація проростання спор і відсоток пророслих спор не залежать від сприйнятливості хазяїна (Bird and Ride, 1981; Morgan 1974; Straley, 1979; Straley and Scharen, 1979; Baker and Smith, 1978).
Bird і Ride (1981) повідомили, що розширення зародкових трубок на поверхні листя відбувалося повільніше на стійких, ніж на сприйнятливих сортах. Цей механізм, що проявляється щонайменше через 48 годин після осадження спор, вказує на стійкість до проникнення до подовження зародкових трубочок. На стійких сортах було менше успішних проникнень, і проникнення відбувалося повільніше на стійких сортах (Baker and Smith, 1978; Bird and Ride, 1981). Було запропоновано лігніфікацію для обмеження інфекції як у стійких, так і у сприйнятливих сортів, але інші фактори сповільнювали розвиток гриба на стійких лініях. У сприйнятливих лініях гіфи, що швидше ростуть, можуть уникати лігніфікації клітин хазяїна. Через чотири дні після інокуляції ячменю ізолятом пшеничного біотипу гриба S. nodorumгіфи проростали крізь кутикулу, а іноді і в зовнішні целюлозні шари клітинних стінок епідермісу. Товсті сосочки відкладалися під проникними гіфами, і клітини не проникали (Keon and Hargreaves, 1984).
Зараження Septoria passerinii
Грін і Діксон (Green and Dickson, 1957) представили детальний опис процесу зараження S. passerinii на ячмені. Процес зараження схожий на S. tritici. Як і для S. tritici, час, необхідний для проникнення в листя, значно довший, ніж для S. nodorum. Зародкові трубки розгалужуються і ростуть по поверхні листка хаотично, але іноді вздовж заглиблень між клітинами епідермісу. Проникнення в листки відбувається майже виключно через продихи. Проростаючі гіфи набухають, і якщо проникнення не вдається, гіфи продовжують витягуватися. Через 48 годин після осадження спор проникнення не відбувається. Через 72 години зародкові трубки потовщуються над продихами, ростуть між охоронними клітинами, на поверхнях додаткових клітин і проникають у підпродихові порожнини. Пряме проникнення між клітинами епідермісу спостерігається дуже рідко.
Проростання спор і проникнення в рослину є однаковими на стійких і сприйнятливих сортах. На стійких сортах спостерігається значно менше поширення гіф всередині листя, а сосочки спостерігаються на багатьох, але не на всіх клітинних стінках. Гіфи ростуть під епідермою від одного продиху до іншого, але не проникають між клітинами епідерми. Мезофіл колонізується, але гаусторії не утворюються. Після того, як клітини мезофілу некротизуються, клітини епідермісу руйнуються. Розвиток міцелію в листі рідкісний і зазвичай блокується судинними пучками. У молодих листках, якщо судинна оболонка менш розвинена, гіфи проходять між пучком і епідермісом. Пікніди утворюються в субтоматних порожнинах, переважно на верхній поверхні листка (Green and Dickson, 1957).
Фактори, що впливають на довговічність спор на листковій поверхні Серед збудників стагоноспорозу та септоріозу зернових культур достовірна інформація про інфекційний процес була отримана лише для S. nodorum, S. triticiі S. passerinii. Як і багато інших некротрофних патогенів, жодна з груп збудників не викликає гіперчутливої реакції. Істотна відмінність в інфекційному процесі між збудниками септоріозу та стагоноспори полягає в тому, що проростання і проникнення спор відбувається набагато швидше для збудників септоріозу S. nodorum ніж для S. tritici і S. passerinii. Це має значний вплив на епідеміологію захворювань.
Збудники септоріозу проникають у рослину переважно через продихи, тоді як S. nodorum проникає як безпосередньо, так і через продихи. S. nodorum швидко проникає і вбиває клітини епідермісу, але S. tritici та S. passerinii не вбивають клітини епідермісу, поки гіфи не проростуть через мезофіл листка і не почнеться швидкий некроз. Гістологічні дослідження росту гриба після проникнення в організм хазяїна збігаються з даними епідеміологічних досліджень резистентності хазяїна. Резистентність сповільнює швидкість колонізації хазяїна, але не має помітного впливу на процес розвитку ураження.
Механізми, що контролюють реакцію хазяїна, пов'язані з ферментами, токсинами або іншими метаболітами, що вивільняються патогенами під час інфікування, все ще залишаються незрозумілими. Існує мало інформації про інфікування аскоспорами. Процес зараження, ймовірно, дуже схожий на процес зараження пікнідоспорами. Аскоспори Phaeosphaeria nodorum проростають в широкому діапазоні температур, а їхні зародкові трубки проникають безпосередньо в листок. Однак, за даними Rapilly та ін. (1973), аскоспори, на відміну від пікнідоспор, не проростають у вільній воді.
Модель інфекції, спричиненої септоріозом
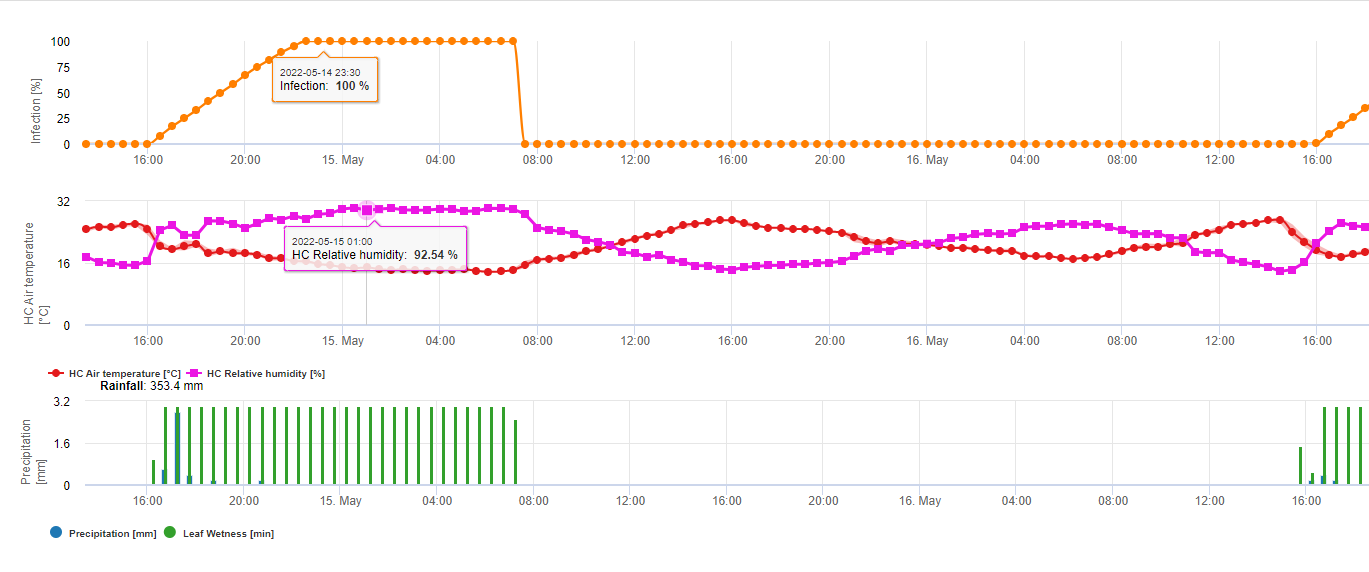
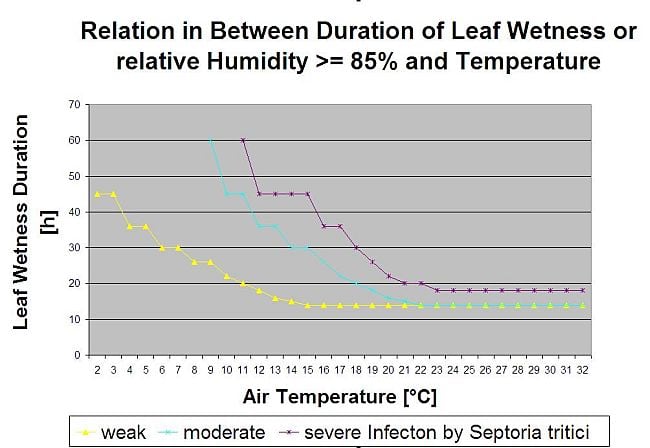
Зараження септоріозом можливе при низьких температурах, тоді як температура нижче 7°C може не призвести до інфікування протягом 2 днів. Оптимальна температура для розвитку хвороби досягається в діапазоні від 16 до 21°C. Зараження можливе в період високої відносної вологості повітря або вологості листя протягом 14 годин або довше. Щоб відповідати цим умовам, ми вирішили розділити моделі на слабкі, помірні та сильні інфекції. Слабкі інфекції можуть бути задані, якщо патоген може інфікувати тканину хазяїна. Це означає, що слабкі інфекції можуть мати місце, якщо температури мінімальні, а періоди зволоження листя мають критичну тривалість. Помірне інфікування відбувається за умов, коли більшість випробувань на інфекційність призводять до задовільних результатів, а сильне інфікування відбувається за умов, коли патоген має оптимальні умови для інфікування.


Починається інфікування після дощу 0,5 мм. Ми вирішили не використовувати модель утворення пікнід. Умовою, необхідною для утворення пікнід, вважається період з відносною вологістю повітря вищою за 85%. Очікується, що час життя пікнід становить 24 години. У всіх кліматичних зонах, де Septoria tritici має можливість інфікувати, ми знайдемо 2 години, що відповідають цим умовам, майже кожного дня на сході сонця.
Оцінка тяжкості інфекції
Для того, щоб мати змогу оцінити інфекційний тиск Septoria tritici між стадіями 10 (колеоптиль першого листкового жолоба) і 32 (другий вузол принаймні на 2 см вище вузла 1), а також між 32 і 51 (початок колосіння), ми повинні оцінити ступінь тяжкості інфекції, виходячи з кліматичних умов. Ця оцінка проводиться за шкалою від 1 до 5. Ступінь тяжкості 1 ставиться, якщо умови для слабкої інфекції виконані, а дощ випав менше 5 мм, в іншому випадку відповідний показник тяжкості буде дорівнювати 2. Ступінь важкості 3 присвоюється, якщо виконані умови для помірного зараження і випало менше 5 мм опадів. Якщо під час помірного зараження випало більше 5 мм опадів, а під час сильного зараження - менше 5 мм опадів, то ступінь вираженості інфекції дорівнює 4.
Сильна інфекція з кількістю опадів понад 5 мм відповідає значенню ступеня тяжкості 5.
Septoria tritici оцінка тиску хвороби
Клімат - це лише один з факторів, що впливає на розвиток хвороб на полях. Іншими двома факторами є історія поля та сприйнятливість вирощуваного сорту. Якщо ми можемо накопичити значення тяжкості хвороби від стадії 10 до стадії 32 до значення 4, ми можемо очікувати слабкого тиску хвороби з боку клімату. Якщо це значення досягає 6, ми можемо очікувати помірного тиску хвороб, а якщо воно досягає 10, ми можемо очікувати високого тиску хвороб з боку клімату. Знаючи сприйнятливість сорту та історію поля, ми зможемо прийняти рішення про те, обприскувати чи не обприскувати за слабкого або помірного тиску хвороб у цій ситуації. Накопичене значення 10 може призвести до обприскування на стадії 32 в будь-якому випадку. Рішення про обприскування на більш пізніх стадіях більше залежить від весняного клімату. Якщо ми зможемо накопичити значення ураженості, починаючи зі стадії 10, до значення 6, ми можемо очікувати слабкого тиску хвороби. Якщо це значення досягає 10, ми можемо очікувати помірного тиску хвороби, а якщо це значення досягає 15, ми можемо очікувати високого тиску хвороби, що залежить від кліматичної ситуації.
У FieldClimate ми показуємо Septoria tritici Тяжкість разом з трьома різними ступенями тяжкості інфекції на одному графіку (див. вище). Надмірна кількість опадів і тривалий період вологості листя створюють умови для розвитку важкої інфекції через S. tritici були повними 14 та 16 травня. Рівні тяжкості досягли найвищого значення 5 14 травня, що означає високий ризик інфікування.
Біологія інфекції Stagonospora nodorum дещо відрізняється від біології S. tritici, але ця різниця не є достатньо великою для окремої моделі. Тому ми пропонуємо використовувати цю модель для всього комплексу стагноспорозних і септоріозних хвороб зернових культур, включаючи S. passerinii. S. tritici і S. passerinii як правило, потребують більш тривалого періоду зволоження листя, ніж S. nodorum. У районах з високим тиском S. nodorum інфекції, класифіковані як слабкі, що мають ступінь тяжкості 2, слід лікувати більш серйозно, ніж в інших областях.
Для Септорія вузлувата (Septoria nodorum) модель ризику показана в FieldClimate (див. вище). Високий ризик був визначений 17 червня та 7 липня (100%). Залежно від сприйнятливої до інфекції стадії рослини, необхідно вжити заходів захисту рослин, якщо ризик досягне 80% (також див. прогноз погоди, захист рослин). Якщо ризик становить 100% і інфекція вже виявлена, для захисту рослин необхідно вжити системних заходів захисту рослин (лікувальне застосування).
Рисовий вибух
У тропіках спори фузаріозу присутні в повітрі протягом усього року, що сприяє безперервному розвитку хвороби. Інфекція, спричинена грибком, пошкоджує гірський рис сильніше, ніж зрошуваний. Вона рідко вражає листкові піхви. Первинне зараження починається там, де насіння густо висівається в розсадні ящики для механічної пересадки.
У країнах з помірним кліматом вона перезимовує в заражених рослинних рештках або в насінні. Похмуре небо, часті дощі та мряка сприяють розвитку і поширенню рисової сажки. Високий вміст азоту, висока відносна вологість і вологе листя сприяють розвитку інфекції, спричиненої грибком. Швидкість спороношення є найвищою при підвищенні відносної вологості до 90% або вище. За вологості листя оптимальна температура для проростання патогена становить 25-28 °C. Вирощування рису в аеробному ґрунті на водно-болотних угіддях, де переважає стрес від посухи, також сприяє зараженню.
Гриб викликає рисову хворобу. Його конідієносці утворюються у вигляді скупчень з кожної продихи. Вони рідко бувають поодинокими з 2-4 перегородками. Базальна частина конідієносців набрякла і звужується до світлішої верхівки. Конідії гриба мають розмір 20-22 х 10-12 мкм. Конідії 2-сепаровані, напівпрозорі, злегка потемнілі. Вони оберненояйцеподібні і звужуються на верхівці. При основі вони усічені або витягнуті в короткий зубчик.
Крім рослини рису, гриб також виживає на Agropyron repens (L.) Gould, Agrostis palustris, A. tenuis, Alopecurus pratensis, Andropogon sp., Anthoxanthum odoratum, Arundo donax L., Avena byzantina, A. sterilis, A. sativa, Brachiaria mutica (Forssk.) Stapf, Bromus catharticus, B. inermis, B. sitchensis, Canna indica, Chikushichloa aquatica, Costus speciosus, Curcuma aromatica, Cynodon dactylon (L.) Pers, Cyperus rotundus L., C. compressus L., Dactylis glomerata, Digitaria sanguinalis (L.) Scop, Echinochloa crus-galli (L.) P. Beauv., Eleusine indica (L.) Gaertn., Eragrostis sp., Eremochloa ophiuroides, Eriochloa villosa, Festuca altaica, F. arundinacea, F. elatior, F. rubra, Fluminea sp, Glyceria leptolepis, Hierochloe odorata, Holcus lanatus, Hordeum vulgare, Hystrix patula, Leersia hexandra Sw., L. japonica, L. oryzoides, Lolium italicum, L. multiflorum, L. perenne, Muhlenbergia sp, Musa sapientum, Oplismenus undulatifolius (Ard.) Roem. & Schult., Panicum miliaceum L., P. ramosum (L.) Stapf, P. repens L., Pennisetum typhoides (L.) R. Br., Phalaris arundinacea L., P. canariensis, Phleum pratense, Poa annua L., P. trivialis, Saccharum officinarum, Secale cereale, Setaria italica (L.) P. Beauv, S. viridis (L.) P. Beauv., Sorghum vulgare, Stenotaphrum secundatum, Triticum aestivum, Zea mays L., Zingiber mioga, Z. officinale та Zizania latifolia.
Конідії утворюються на уражених ділянках рослини рису приблизно через 6 днів після інокуляції. Кількість спор збільшується зі збільшенням відносної вологості. Більшість спор утворюється і вивільняється вночі. Після проростання спор відбувається інфікування. Інфекційні трубки утворюються з аппресорії, а пізніше проникають через кутикулу та епідерміс. Після проникнення в клітину інфекційна трубка утворює везикулу, з якої утворюються гіфи. У клітині гіфи вільно ростуть.
Рисова сажка вражає рослину на будь-якій стадії росту. Часто повністю гинуть сходи або рослини на стадії кущіння. Аналогічно, сильне зараження волоті зазвичай призводить до втрати врожаю рису.
Антракноз
Модель Р. Солані на полях оцінює ризик виникнення цієї хвороби на основі температури, вологості листя та глобальної радіації. Перевірка триває 120 годин:
- У разі послідовного зволоження листків вони накопичують залежні від температури значення за кожну хвилину.
- 12 °C до 15 °C накопичується 1 за хвилину
- 16 °C до 17 °C накопичується 2 на хвилину
- 18°C і вище накопичується 4 на хвилину - Наприкінці періодів зволоження листя він оцінює накопичені значення
- якщо вони більші за 4096, то ризик збільшується на 64 пункти і від значення віднімається 4096>.
- якщо залишок більший за 2048, то ризик збільшується на 16 і від значення віднімається 2048
- якщо залишок більший за 1024, то ризик збільшується на 4 і від значення віднімається 1024 - Якщо глобальна радіація постійно перевищує 800 Вт/м², накопичуйте час у хвилинах, а якщо радіація зменшується, оцінюйте значення:
- Value > 512 = RiskValue - 32 бали , Value - 512
- Value > 256 = RiskValue - 8 балів , Value - 256
- Значення >128 = RisKValue - 2 пункти, Значення -128
Результатом роботи моделі є значення ризику від 0 до 100, що вказує на сприятливий час для Р. Солані в полях.
Система підтримки
Модель вказує на періоди з високим ризиком захворювання. У періоди з низьким ризиком обприскування не потрібно проводити. У періоди з помірним ризиком інтервал між обприскуваннями може бути збільшений, а в періоди з високим ризиком інтервал між обприскуваннями може бути зменшений або потрібно використовувати більш ефективні препарати.
Література
Хвороби іржі
- Anikster, Y., Bushnell, W.R., Eilam, T., Manisterski, J. & Roelfs, A.P. 1997. Puccinia recondita, що викликає іржу листя на культивованих пшеницях, диких пшеницях та житі. Can. J. Bot., 75: 2082-2096.
- Азбукіна, З. 1980. Економічне значення особливих хазяїв іржастих грибів зернових на радянському Далекому Сході. У праці 5-ї Європейської та середземноморської конференції з іржі зернових культур, с.199-201. Барі, Рим.
- Бересфорд, Р.М. 1982. Смугаста іржа (Puccinia striiformis), нова хвороба пшениці в Новій Зеландії. Cer. Rusts Bull, 10: 35-41.
- Біффен, Р.Х. 1905. Менделівські закони успадкування та селекція пшениці. J. Agric. Sci., 1: 4-48.
- Борлауг, Н.Е. 1954. Мексиканське виробництво пшениці та його роль в епідеміології стеблової іржі в Північній Америці. Фітопатологія, 44: 398-404.
- Бухенауер, Х. 1982. Хімічний та біологічний контроль іржі зернових. В К.Д. Скотт та А.К. Чакраворті, ред.. Іржаві гриби, с. 247-279. Лондон, Академічна преса.
- Burdon, J.J., Marshall, D.R. & Luig, N.H. 1981. Ізоферментний аналіз вказує на те, що вірулентний збудник іржі злаків є соматичним гібридом. Nature, 293: 565-566.
- Казуллі, Ф. 1988. Перезимівля листкової іржі пшениці на півдні Італії. Матеріали 7-ї Європейської та середземноморської конференції з іржі зернових культур, 5-9 вересня, с. 166-168. Відень.
- Честер, К.С. 1946. Природа та запобігання іржі злаків на прикладі листкової іржі пшениці. В Chronica botanica. Уолтан, штат Массачусетс, США. 269 сторінок.
- Крейгі, J.H. 1927. Експерименти щодо статі у іржавих грибів. Nature, 120: 116-117.
- Cummins, G.B. & Caldwell, R.M. 1956. Достовірність біномалій у комплексі грибів іржі листя злаків та трав. Фітопатологія, 46: 81-82.
- Cummins, G.B. & Stevenson, J.A. 1956. Контрольний список північноамериканських іржастих грибів (Uredinales). Plant Dis. Rep. Suppl., 240: 109-193.
- d'Oliveira, B. & Samborski, D.J. 1966. Особлива стадія Puccinia recondita на Ranunculaceae та Boraginaceae в Португалії. In Proc. Конференція з іржі злаків, Кембридж, с. 133-150.
- DeBary, A. 1866. Neue Untersuchungen uber die Uredineen insbesondere die Entwicklung der Puccinia graminis und den Zusammenhang duselben mit Aecidium berberis. In Monatsber Preuss. Akad. Wiss., Berlin, p. 15-20.
- de Candolle, A. 1815. Uredo rouille des cereales. У Flora francaise, famille des champignons, с. 83.
- Дубін, Х.Д. та Стаббс, Р.В. 1986. Епідемічне поширення смугастої іржі ячменю в Південній Америці. Plant Dis., 70: 141-144.
- Дубін, Х.Д. та Торрес, Е. 1981. Причини та наслідки епідемії іржі листя пшениці 1976-1977 рр. на північному заході Мексики. Ann. Rev. Phytopath., 19: 41-49.
- Eriksson, J. 1894. Uber die Spezialisierung des Parasitismus bei dem Getreiderostpilzen. Ber. Deut. Bot. Ges., 12: 292-331.
- Eriksson, J. & Henning, E. 1894. Die Hauptresultate einer neuen Untersuchung uber die Getreideroste. Z. Pflanzenkr., 4: 66-73, 140-142, 197-203, 257-262.
- Ерікссон, Й. та Хеннінг, Е. 1896. Die Getreideroste. Ihre Geschichte und Natur sowie Massregein gegen dieselben, p. 463. Стокгольм, П.А. Норстедт і Сонер.
- Ezzahiri, B., Diouri, S. & Roelfs, A.P. 1992. Роль альтернативного хазяїна, Anchusa italica, в епідеміології Puccinia recondita f. sp. tritici на твердій пшениці в Марокко. У F.J. Zeller & G. Fischbeck, eds. Матеріали 8-ї Європейської та середземноморської конференції з іржі та пліснявіння зернових культур, 1992, с. 69-70. Heft 24 Weihenstephan, Німеччина.
- Фонтана, Ф. 1932. Спостереження над іржею зерна. П.П. Піроне, пер. Класика № 2. Вашингтон, округ Колумбія, Амер. Фітопатол. Товариство. (Вперше опубліковано в 1767 році).
- Грін, Г.Дж. та Кемпбелл, А.Б. 1979. Сорти пшениці, стійкі до Puccinia graminis tritici на заході Канади: їх розвиток, продуктивність та економічна цінність. Can. J. Plant Pathol., 1: 3-11.
Грот, Я.В. та Рульфс, А.П. 1982. Вплив статевого та безстатевого розмноження на чисельність рас у популяціях іржастих грибів злаків. Фітопатологія, 72: 1503-1507. - Хейр, Р.А. та Макінтош, Р.А. 1979. Генетичні та цитогенетичні дослідження стійкості дорослих рослин сорту Надія та споріднених сортів до іржі пшениці. Z. Pflanzenzüchtg, 83: 350-367.
- Hart, H. & Becker, H. 1939. Beitrage zur Frage des Zwischenwirts fur Puccinia glumarum Z. Pflanzenkr. (Pflanzenpathol.) Pflanzenschutz, 49: 559-566.
- Хендрікс, Д.В., Берлі, Д.Р. і Ту, Д.К. 1965. Перезимівля смугастої іржі на великих висотах на Тихоокеанському північному заході-1963. Plant Dis. Rep., 49: 275-278.
- Германсен, Й.Е. 1968. Дослідження поширення та виживання іржі та борошнистої роси зернових у Данії. Contrib. No. 87. Копенгаген, кафедра патології рослин, Королівський ветеринарний коледж. Сільськогосподарський коледж. 206 с.
- Херст, Д.М. і Херст, Г.В. 1967. Транспортування спор на великі відстані. В P.H. Gregory & J.L. Monteith, eds. Повітряно-крапельні мікроби, с. 307-344. Видавництво Кембриджського університету.
- Хогг, В.Х., Хунам, К.Е., Маллік, А.К. та Задокс, Я.К. 1969. Метеорологічні фактори, що впливають на епідеміологію іржі пшениці. WMO Tech. Записка № 99. 143 с.
- Huerta-Espino, J. & Roelfs, A.P. 1989. Фізіологічна спеціалізація листкової іржі на твердій пшениці. Фітопатологія, 79: 1218 (анотація).
- Hylander, N., Jorstad, I. & Nannfeldt, J.A. 1953. Enumeratio uredionearum Scandinavicarum. Opera Bot., 1: 1-102.
- Johnson, R. 1981. Стійка стійкість до хвороб. В J.F. Jenkyn & R.T. Plumb, eds. Стратегії боротьби з хворобами зернових, с. 55-63. Оксфорд, Великобританія, Блеквелл.
- Джонсон, Т. 1949. Міжсортові схрещування у Puccinia graminis. Can. J. Res. Sect. C, 27: 45-63.
- Джоші, Л.М. та Палмер, Л.Т. 1973. Епідеміологія стеблової, листкової та смугастої іржі пшениці на півночі Індії. Plant Dis. Rep., 57: 8-12.
- Кацуя, К. та Грін, Г.Дж. 1967. Репродуктивні потенціали рас 15B і 56 стеблової іржі пшениці. Can. J. Bot., 45: 1077-1091.
- Кілпатрік, Р.А. 1975. Нові сорти пшениці та тривалість стійкості до іржі, 1971-1975. USDA, Agric. Res. Serv. Північно-Східний регіон, ARS-NE 64. 20 стор.
- Le Roux, J. & Rijkenberg, F.H.J. 1987. Патотипи Puccinia graminis f. sp. tritici з підвищеною вірулентністю до Sr24. Plant Dis., 71: 1115-1119.
- Lewellen, R.T., Sharp, E.L. & Hehn, E.R. 1967. Основні та мінорні гени стійкості пшениці до Puccinia striiformis та їх реакція на зміни температури. Can. J. Bot., 45: 2155-2172.
- Лайн, Р.Ф. 1976. Фактори, що сприяли епідемії смугастої іржі на пшениці в долині Сакраменто в Каліфорнії в 1974 році. Plant Dis. Rep., 60: 312-316.
- Лайн, Р.Ф., Каюм, А. та Мілус, Е. 1983. Довготривала стійкість до смугастої іржі пшениці. В доповіді 4th Int. Cong. Патології рослин, с. 204. Мельбурн.
- Luig, N.H. 1985. Епідеміологія в Австралії та Новій Зеландії. В A.P. Roelfs & W.R. Bushnell, eds. Іржа зернових, т. 2, Хвороби, поширення, епідеміологія та контроль, с. 301-328. Орландо, штат Флорида, США, Академічна преса.
- Luig, N.H. & Rajaram, S. 1972. Вплив температури та генетичного фону на експресію генів хазяїна та взаємодію з Puccinia graminis tritici. Фітопатологія, 62: 1171-1174.
- Луїг, Н.Х. та Ватсон, І.А. 1972. Роль диких і культурних трав у гібридизації особливих форм Puccinia graminis. Aust. J. Biol. Sci., 25: 335-342.
- Maddison, A.C. & Manners, J.G. 1972. Сонячне світло та життєздатність уредіоспор іржі злаків. Trans. Br. Mycol. Soc., 59: 429-443.
- Мейнс, Е.Б. 1932. Спеціалізація хазяїна на листковій іржі злаків Puccinia rubigovera. Mich. Acad. Наук, 17: 289-394.
- Мейнс, Є.Б. 1933. Дослідження, що стосуються гетерозисної іржі. Мікологія, 25: 407-417.
- Мейнс, Е.Б. та Джексон, Х.С. 1926. Фізіологічна спеціалізація листкової іржі пшениці, Puccinia triticina Erikss. Фітопатологія, 16: 89-120.
- Manners, J.G. 1960. Puccinia striiformis Westend. var. dactylidis var. nov. Trans. Br. Mycol. Soc., 43: 65-68.
- Макінтош, Р.А. 1976. Генетика пшениці та пшеничної іржі з часів Фаррера: Меморіальна промова Фаррера 1976. J. Aust. Inst. Agric. Sci., 42: 203-216.
- Макінтош, Р.А. 1992. Тісний генетичний зв'язок генів, що забезпечують стійкість дорослих рослин до іржі листя та смугастої іржі у пшениці. Plant Pathol., 41: 523-527.
- McIntosh, R.A., Luig, N.H., Milne, D.L. & Cusick, J. 1983. Вразливість тритикале до стеблової іржі пшениці. Can. J. Plant Pathol., 5: 61-69.
- McIntosh, R.A., Hart, G.E., Devos, K.M., Gale, M.D. & Rogers, W.J. 1998. Каталог генних символів для пшениці. Матеріали 9-го Міжнар. симпозіуму з генетики пшениці. Симпозіуму з генетики пшениці, 2-7 серпня 1998 року. Саскатун, Саскачеван, Канада.
- Меландер, Л.В. та Крейгі, Д.Х. 1927. Природа стійкості Berberis spp. до Puccinia graminis. Фітопатологія, 17: 95-114.
- Монт, Р.М. 1970. Вивчення неспецифічної стійкості до стеблової іржі у ярої пшениці. Магістерська дисертація. Сент-Пол, штат Міннесота, США, Університет Міннесоти. 61 стор.
- Nagarajan, S. & Joshi, L.M. 1985. Епідеміологія на індійському субконтиненті. В A.P. Roelfs & W.R. Bushnell, eds. Іржа зернових, т. 2, Хвороби, поширення, епідеміологія та контроль, с. 371-402. Орландо, штат Флорида, США, Академічна преса.
- О'Брайен, Л., Браун, Д.С., Янг, Р.М. та Паскоу, Т. 1980. Виникнення та поширення смугастої іржі пшениці в штаті Вікторія та сприйнятливість комерційних сортів пшениці. Aust. Plant Pathol. Soc. Newsl., 9: 14.
- Perez, B. & Roelfs, A.P. 1989. Стійкість до іржі листя пшениці сухопутних сортів та їх похідних. Фітопатологія, 79: 1183 (анотація).
- Преторіус, З.А., Сінгх, Р.П., Вагуар, В.В. та Пейн, Т.С. 2000. Виявлення вірулентності до гена стійкості до стеблової іржі пшениці Sr31 у Puccinia graminis f. sp. tritici в Уганді. Фітопатологія, 84: 203.
- Раджарам, С., Сінгх, Р.П. та ван Гінкель, М. 1996. Підходи до виведення пшениці для широкої адаптації, стійкості до іржі та посухи. Р.А. Річардс, К.В. Ріглі, Х.М. Роусон, Г.Й. Ребецке, Д.Л. Девідсон та Р.І.С. Бреттелл, ред.. Матеріали 8-ї Асамблеї Товариства селекції пшениці Австралії, с. 2-30. Канберра, Австралійський національний університет.
- Рапіллі, Ф. 1979. Епідеміологія жовтої іржі. Ann. Rev. Phytopathol., 17: 5973.
- Роббелен, Г. і Шарп, Е.Л. 1978. Спосіб успадкування, взаємодія та застосування генів, що обумовлюють стійкість до жовтої іржі. Fortschr. Pflanzenzucht. Beih. Z. Pflanzenzucht, 9: 1-88.
- Roelfs, A.P. 1978. Оцінка втрат, спричинених іржею дрібнозернистих злаків у США 1918-1976 рр. Misc. Publ. USDA, 1363: 1-85.
Roelfs, A.P. 1982. Вплив знищення барбарису на стеблову іржу в Сполучених Штатах. Plant Dis., 66: 177-181. - Roelfs, A.P. 1985a. Епідеміологія в Північній Америці. В A.P. Roelfs & W.R. Bushnell, eds. Іржа зернових, т. 2, Хвороби, поширення, епідеміологія та контроль, с. 403-434. Орландо, штат Флорида, США, Академічна преса.
- Roelfs, A.P. 1985b. Стеблова іржа пшениці та жита. В A.P. Roelfs & W.R. Bushnell, eds. Іржа зернових, т. 2, Хвороби, поширення, епідеміологія та контроль, с. 3-37. Орландо, штат Флорида, США, Академічна преса.
- Roelfs, A.P. 1986. Розвиток та вплив регіональних епідемій іржі зернових. В K.J. Leonard & W.E. Fry, eds. Епідеміологія хвороб рослин, т. 1, с. 129-150. Нью-Йорк, штат Нью-Йорк, США, Макміллан.
- Roelfs, A.P. 1988. Генетичний контроль фенотипів у стеблової іржі пшениці. Ann. Rev. Phytopathol., 26: 351-367.
- Roelfs, A.P. & Groth, J.V. 1980. Порівняння фенотипів вірулентності в популяціях стеблової іржі пшениці, що розмножуються статевим і нестатевим шляхом. Фітопатологія, 70: 855-862.
- Roelfs, A.P. & Groth, J.V. 1988. Puccinia graminis f. sp. tritici, чорна стеблова іржа Triticum spp. Успіхи в патології рослин, т. 6, Генетика патогенних грибів, с. 345-361. Лондон, Академічна преса.
- Roelfs, A.P. & Long, D.L. 1987. Розвиток Puccinia graminis у Північній Америці протягом 1986 року. Plant Dis., 71: 1089-1093.
- Roelfs, A.P. & Martell, L.B. 1984. Розповсюдження сечокислих спор з точкового джерела в межах пшеничного пологу. Фітопатологія, 74: 1262-1267.
- Roelfs, A.P., Huerta-Espino, J. & Marshall, D. 1992. Смугаста іржа ячменю в Техасі. Plant Dis., 76: 538.
- Роуелл, Дж. Б. 1981. Зв'язок подій після проникнення у проростків пшениці Idaed 59 з низькою сприйнятливістю до інфекції Puccinia graminis f. sp. tritici. Фітопатологія, 71: 732-736.
- Rowell, J.B. 1982. Контроль стеблової іржі пшениці за допомогою низької сприйнятливості до інфекції, зумовленої одним домінантним геном. Фітопатологія, 72: 297-299.
- Роуелл, Дж. Б. 1984. Контрольована інфекція Puccinia graminis f. sp. tritici в штучних умовах. В кн.: A.P. Roelfs & W.R. Bushnell. A.P. Roelfs & W.R. Bushnell, eds. Іржа зернових, т. 1, Походження, специфіка, структура та фізіологія, с. 291-332. Орландо, штат Флорида, США, Академічна преса.
- Саарі, Е.Е. та Прескотт, Д.М. 1985. Світовий розподіл по відношенню до економічних втрат. В A.P. Roelfs & W.R. Bushnell, eds. Іржа зернових, т. 2, Хвороби, поширення, епідеміологія та контроль, с. 259-298. Орландо, штат Флорида, США, Академічна преса.
Саарі, Е.Е., Янг, Г.К., молодший та Фернкамп, М.Ф. 1968. Зараження північноамериканського Thalictrum spp. Puccinia recondita f. sp. tritici. Фітопатологія, 58: 939-943. - Самборський, Д.Й. 1985. Іржа листя пшениці. A.P. Roelfs і W.R. Bushnell, eds. Іржа зернових, т. 2, Хвороби, поширення, епідеміологія та контроль, с. 39-59. Орландо, штат Флорида, США, Академічна преса.
- Савіл, Д.Б.О. 1984. Таксономія грибів іржі злаків. У W.R. Bushnell & A.P. Roelfs, eds. Іржа злаків, т. 1, Походження, специфіка, структура та фізіологія, с. 79-112. Орландо, штат Флорида, США, Академічна преса.
- Шарп, Е.Л. та Волін, Р.Б. 1970. Додаткові гени в кондиційній стійкості пшениці до смугастої іржі. Фітопатологія, 601: 1146-1147.
- Сінгх, Р.П. 1992. Генетична асоціація гена стійкості до листкової іржі Lr34 зі стійкістю дорослих рослин до смугастої іржі у м'якої пшениці. Фітопатологія, 82: 835-838.
- Singh, R.P. & Rajaram, S. 1992. Генетика стійкості дорослих рослин до листкової іржі у "Frontana" та трьох пшениць CIMMYT. Геном, 35: 24-31.
- Singh, R.P. & Rajaram, S. 1994. Генетика стійкості дорослих рослин до смугастої іржі у десяти ярих м'яких пшениць. Euphytica, 72: 1-7.
- Singh, R.P., Mujeeb-Kazi, A. & Huerta-Espino, J. 1998. Lr46: ген, що забезпечує повільну стійкість до листкової іржі у пшениці. Фітопатологія, 88: 890-894.
- Сковманд, Б., Фокс, П.Н. та Віллареал, Р.Л. 1984. Тритикале в комерційному сільському господарстві: прогрес та перспективи. Adv. Агроном, 37: 1-45.
- Спехар, В. 1975. Епідеміологія іржі пшениці в Європі. Матеріали 2-ї Міжнар. Конф. з озимої пшениці, 9-19 червня, с. 435-440. Загреб, Югославія.
- Стакман, Е.К. 1923. Хвороби пшениці. 14. Проблема іржі пшениці в Сполучених Штатах. Матеріали 1-ої Пан-Тихоокеанської. Наук. конгресу, с. 88-96.
- Straib, W. 1937. Untersuchungen uben dasn Vorkommen physiologischen Rassen der Gelbrostes (Puccinia glumarum) in den Jahren 1935-1936 und uber die Agressivitat eninger neuer Formes auf Getreide un Grasern. Arb. Biol. Reichsant. Land. Fortw. Berlin-Dahlem, 22: 91-119.
- Стаббс, Р.В. 1985. Смугаста іржа. В A.P. Roelfs & W.R. Bushnell, eds. Іржа зернових, т. 2, Хвороби, поширення, епідеміологія та контроль, с. 61-101. Орландо, штат Флорида, США, Академічна преса.
- Stubbs, R.W. & de Bruin, T. 1970. Bestrijding van gele roest met het systemische fungicide oxycaroxin 'Plantvax'. Gewasbescherming, 1: 99-104.
- Стаббс, Р.В., Прескотт, Д.М., Саарі, Е.Е. та Дубін, Х.Дж. 1986. Посібник з методології боротьби з хворобами зернових, с. 46. Мексика, DF, CIMMYT.
- Сандервірт, С.Д. та Рульфс, А.П. 1980. Теплична оцінка стійкості дорослих рослин Sr2 до стеблової іржі пшениці. Фітопатологія, 70: 634-637.
- Толленаар, Х. і Х'юстон, Б.Р. 1967. Дослідження епідеміології смугастої іржі, Puccinia striiformis West у Каліфорнії. Can. J. Bot., 45: 291-307.
- Тоццетті, Г.Т. 1952. В. Алімургія: Справжня природа, причини та сумні наслідки іржі, клопів, сажки та інших хвороб пшениці та вівса в полі. У Л.Р. Техон, пер. Фітопатологічна класика № 9, с. 139. Сент-Пол, штат Міннесота, США, Американське фітопатол. Товариство. (Вперше опубліковано в 1767 році).
- Tranzschel, W. 1934. Promezutocnye chozjaeva rzavwiny chlebov i ich der USSR. (Альтернативні господарі грибів іржі злаків та їх поширення в СРСР). У Бюл. Захист рослин, сер. 2, с. 4-40. (Російською мовою з німецьким резюме).
- Viennot-Bourgin, G. 1934. La rouille jaune der graminees. Ann. Ec. Natl. Agric. Grignon Ser., 3, 2: 129-217.
- Уоллворк, Х. і Джонсон, Р. 1984. Трансгресивне розділення для стійкості до жовтої іржі у пшениці. Euphytica, 33: 123-132.
- Уотсон, І.А. та де Соуза, К.Н.А. 1983. Транспортування спор Puccinia graminis tritici на великі відстані в Південній півкулі. In Proc. Linn. Soc. N.S.W., 106: 311-321.
- Райт, Р.Г. та Леннард, Д.Х. 1980. Походження нової раси Puccinia striiformis. Trans. Br. Mycol. Soc., 74: 283-287.
- Задокс, Я.К. 1961. Жовта іржа на пшениці дослідження епідеміології та фізіологічної спеціалізації. Neth. J. Plant Pathol., 67: 69-256.
- Zadoks, J.C. & Bouwman, J.J. 1985. Епідеміологія в Європі. В A.P. Roelfs & W.R. Bushnell, eds. Іржа зернових, т. 2, Хвороби, поширення, епідеміологія та контроль, с. 329-369. Орландо, штат Флорида, США, Академічна преса
Фузаріозна сажка
- Бахт, К.В., Біду, Р., Рамакрішна, Ю. та Мунші, Р.Л. 1989. Спалах трихотеценового токсикозу, пов'язаний зі споживанням пошкоджених пліснявою пшеничних продуктів у долині Кашмір, Індія. Ланцет, с. 35-37.
- Бай, Г. 1995. Парша пшениці: епідеміологія, успадкування стійкості та молекулярні маркери, пов'язані зі стійкістю сорту. Докторська дисертація. Західний Лафайєт, штат Індіана, США, Університет Пердью.
- Chen, P., Liu, D. & Sun, W. 1997. Нові контрзаходи селекції пшениці на стійкість до парші. В H.J. Dubin, L. Gilchrist, J. Reeves & A. McNab, eds. Фузаріозна головня: глобальний стан та перспективи на майбутнє. Мексика, DF, CIMMYT.
- Діас де Акерманн, М. та Колі, М.М. 1997. Дослідження фузаріозної сажки пшениці в Уругваї. В H.J. Dubin, L. Gilchrist, J. Reeves & A. McNab, eds. Фузаріозна головешка: глобальний стан та перспективи на майбутнє. Мексика, DF, CIMMYT.
- Dill-Macky, R. 1997. Фузаріозна сажка: Нещодавні епідемії та дослідницькі зусилля на верхньому середньому заході США. В H.J. Dubin, L. Gilchrist, J. Reeves & A. McNab, eds. Фузаріозна головня: глобальний стан та перспективи на майбутнє. Мексика, DF, CIMMYT.
- Дубін, Х.Д., Гілкріст, Л., Рівз, Д. та Макнаб, А. 1997. Фузаріозна парша качана: глобальний стан та перспективи на майбутнє. Мексика, DF, CIMMYT.
- Галич, М.Т.В. 1997. Фузаріоз колоса в Аргентині. В H.J. Dubin, L. Gilchrist, J. Reeves & A. McNab, eds. Фузаріозна парша: глобальний стан та перспективи на майбутнє. Мексика, DF, CIMMYT.
- Гілкріст, Л., Раджарам, С., Муджиб-Казі, А., ван Гінкель, М., Вівар, Х. та Пфайффер, В. 1997. В H.J. Dubin, L. Gilchrist, J. Reeves & A. McNab, eds. Фузаріозна парша колоса: глобальний стан та перспективи на майбутнє. Мексика, DF, CIMMYT.
- Ireta, J. 1989. Seleccion de un modelo de crecimiento para la fusariosis del trigo causada por Fusarium graminearum Schw. В M.M. Kohli, ed. Taller sobre la Fusariosis de la espiga en America del Sur. Мексика, DF, CIMMYT.
- Ireta, M.J. & Gilchrist, L. 1994. Фузаріозна головешка пшениці (Fusarium graminearum Schwabe). Спеціальний звіт по пшениці № 21b. Мексика, DF, CIMMYT.
- Khonga, E.B. & Sutton, J.C. 1988. Виробництво інокуляту та виживання Giberella zeae у залишках кукурудзи та пшениці. Can. J. Plant Pathol., 10(3): 232-240.
- Ло, X.Y. 1988. Забруднення токсином фузаріозу в Китаї. Proc. Japan Assoc. Mycotoxicology Suppl., 1: 97-98. Марасас, В.Ф.О., Яскевіц, К., Вентер, Ф.С. та Шальквик, Д.Д. 1988. Зараження кукурудзи Fusarium moniliforme в районах раку стравоходу в Транскеї. S. AF. Med. J., 74: 110-114.
- Міхута-Грімм, Л. та Фостер, Р.Л. 1989. Парша на пшениці та ячмені в південному Айдахо та оцінка обробки насіння для знищення Fusarium spp. Plant Dis., 73: 769-771.
- Міллер, Дж.Д. та Армісон, П.Г. 1986. Деградація дезоксиніваленолу суспензійними культурами стійкого до фузаріозної сажки сорту пшениці Фронтана. Can. J. Plant Pathol., 8: 147-150.
- Міллер, Д.Д., Янг, Д.К. та Семпсон, Д.Р. 1985. Дезоксиніваленол та стійкість до фузаріозу ярих зернових культур. J. Phytopathol., 113: 359-367.
- Рейс, Е.М. 1985. Doencas do trigo III. Фузаріоз. Бразилія, Merck Sharp Dohme.
- Рейс, Е.М. 1989. Фузаріоз: біологія та епідеміологія Gibberella zeae en trigo. В M.M. Kohli, ed. Taller sobre la Fusariosis de la espiga en America del Sur. Мексика, DF, CIMMYT.
- Schroeder, H.W. & Christensen, J.J. 1963. Фактори, що впливають на стійкість пшениці до парші, спричиненої Gibberella zeae. Фітопатологія, 53: 831-838.
- Сніджерс, К.Х.А. 1989. Поточний стан селекції пшениці на стійкість до фузаріозної сажки та проблеми мікотоксинів у Нідерландах. Фонд селекції сільськогосподарських рослин, Вагенінген. В M.M. Kohli, ed. Taller sobre la Fusariosis de la espiga en America del Sur. Мексика, DF, CIMMYT.
- Snijders, C.H.A. 1990. Успадкування стійкості до фузаріозу голови, спричиненого Fusarium culmorum у озимої пшениці Euphytica, 50: 11-18.
- Тейч, А.Х. та Нельсон, К. 1984. Дослідження фузаріозної сажки та можливих наслідків культурних практик на пшеничних полях в окрузі Лембтон у 1983 році. Can. Plant Dis. Surv., 64(1): 11-13.
- Тренхолм, Х.Л., Френд, Д.Х. та Гамільтон, Р.М.Г. 1984. Вомітоксин та зеараленон у кормах для тварин. Публікація Міністерства сільського господарства Канади 1745 E.
- Van Egmond, H.P. & Dekker, W.H. 1995. Світові правила щодо мікотоксинів у 1994 році. Nat. Токсини, 3: 332.
- Viedma, L. 1989. Importancia y distribucion de la fusariosis de trigo en Paraguay. В M.M. Kohli, ed. Taller sobre la Fusariosis de la espiga en America del Sur. Мексика, DF, CIMMYT.
- Ван, Ю.З. 1997. Епідеміологія та боротьба з паршею пшениці в Китаї В H.J. Dubin, L. Gilchrist, J. Reeves & A. McNab, eds. Фузаріозна головня: глобальний стан та перспективи на майбутнє. Мексика, DF, CIMMYT.
- Ван, Ю.З. та Міллер, Д.Д. 1988. Вплив метаболітів на тканину пшениці щодо стійкості до фузаріозної сажки. J. Phytopathol., 122: 118-125.
Фузаріозна сажка
- Infection und Ausbreitung von Fusarium spp. an Weizen in Abhängigkeit der Anbaubedingungen im Rheinland, Lienemann, K.
- E.-C. Oerke und H.-W. Dehne
Вплив активності води, температури та рН на ріст ізолятів Fusarium moniliforme та Fusarium proliferatum з кукурудзи, Sonia Marin, Vicente Sanchis та Naresh Magan - Взаємодія Fusarium graminearum та F. moniliforme у качанах кукурудзи: розвиток хвороби, біомаса гриба та накопичення мікотоксинів, Л. М. Рейд, Р. В. Нікол, Т. Уеллет, М. Савард, Д. Д. Міллер, Д. К. Янг, Д. В. Стюарт та А. В. Шаафсма
- Evaluierung von Einflussfaktoren auf den Fusarium-Ährenbefall des Weizens, Wolf, P. F. J.; Schempp, H.; Verreet, J.-A.
Septoria spp.
- Бейкер, C.J. 1971. Морфологія інфекції розсади Leptosphaeria nodorum. Trans. Brit. Mycol. Soc. 56:306-309.
- Бейкер, C.J. 1969. Дослідження Leptosphaeria nodorum Müller та Septoria tritici Desm. на пшениці. Докторська дисертація. Ексетерський університет.
- Бейкер Е.А., Сміт І.М. 1978. Розвиток стійких та сприйнятливих реакцій у пшениці на інокуляцію Septoria nodorum. Trans. Brit. Mycol. Soc. 71:475-482.
- Бенедикт, В.Г. 1971. Диференційований вплив інтенсивності світла на зараження пшениці Septoria tritici Desm. за контрольованих умов навколишнього середовища. Physiol. Pl. Pathol. 1:55-56.
- Берд, П.М., і Райд, Д.П. 1981. Стійкість пшениці до Septoria nodorum: розвиток гриба по відношенню до здерев'яніння хазяїна. Physiol. Pl. Pathol. 19:289-299.
- Збудники стагоноспори та септоріозу зернових культур: Інфекційний процес 45 Bethenod, O., Bousquet, J., Laffray, D., and Louguet, P. 1982. Reexamen des modalités d'action de l'ochracine sur la conductance stomatique des feuilles de plantules de blé, Triticum aestivum L., cv "Etoile de Choisy".Agronomie 2:99-102.
- Bousquet, J.F., and Kollman, A. 1998. Варіації у продукуванні метаболітів ізолятами Septoria nodorum, адаптованими до пшениці або ячменю. J. Phytopathol. 146:273-277.
- Bousquet, J.F., Belhomme de Franqueville, H., Kollmann, A., and Fritz, R. 1980. Action de la septorine, phytotoxine synthétisée par Septoria nodorum, sur la phosphorylation oxydative dans les mitochondries isolées de coléoptiles de blé. Can. J. Bot. 58:2575-2580.
- Бреннан, Р.М., Фітт, Б.Д.Л., Колхун, Дж. і Тейлор, Г.С. 1986. Фактори, що впливають на проростання пікнідоспор Septoria nodorum. J. Phytopathol. 117:49-53.
- Брьоніманн, А., Саллі, Б.К. та Шарп, Е.Л. 1972. Дослідження Septoria nodorum на ярій пшениці в Монтані. Plant Dis. Reptr. 56:188-191.
- Cohen, L., and Eyal, Z. 1993. Гістологія процесів, пов'язаних з інфікуванням стійких і сприйнятливих сортів пшениці Septoria tritici. Plant Pathol. 42:737-743.
- Кунфер, Б.М. 1983. Епідеміологія та боротьба з септоріозом, що переноситься насінням. Seed Sci. Tecnol. 11:707- 718.
- Essad, S., and Bousquet, J.F. 1981. Action de l'ochracine, phytotoxine de Septoria nodorum Berk., sur le cycle mitotique de Triticum aestivum L. Agronomie 1:689-694.
- Еяль, З., Шарен, А.Л., Прескотт, Д.М. та ван Гінкель, М. 1987. Септоріоз пшениці: Концепції та методи управління хворобами. CIMMYT. Мексика, Д.Ф. 46 с.
- Fernandes, J.M.C., and Hendrix, J.W. 1986a. Життєздатність конідій Septoria nodorum в природних умовах у Вашингтоні. Fitopathol. Bras. 11:705-710.
- Фернандес, Ж.М.К., та Хендрікс, Д.В. 1986b. Вплив вологості та температури листя на ріст гіфів та розвиток симптомів на листках пшениці, інфікованих Septoria nodorum. Fitopathol. Bras. 11:835-845.
- Fournet, J. 1969. Properiétés et role du cirrhe du Septoria nodorum Berk. Ann. Фітопатол. 1:87-94. Fournet, J., Pauvert, P., and Rapilly, F. 1970. Propriétés des gelées sporifères de quelques Sphaeropsidales et Melanconiales. Ann. Phytopathol. 2:31-41.
- Гоф, Ф.Дж. і Лі, Т.С. 1985. Вплив вологи на виділення та виживання конідій Septoria tritici. Фітопатологія 75:180-182.
- Грін, Г.Дж. та Діксон, Д.Г. 1957. Патологічна гістологія та сортові реакції при септоріозній плямистості листя ячменю. Фітопатологія 47:73-79.
- Гріффітс, Е. та Певеретт, Х. 1980. Вплив вологості та екстракту цирруса на виживання спор Septoria nodorum. Trans. Brit. Mycol. Soc. 75:147-150.
- Харроуер, К.М. 1976. Функція цирруса у Leptosphaeria nodorum. Інформаційний бюлетень APPS 5:20-21.
- Hilu, H.M., and Bever, W.M. 1957. Інокуляція, перезимівля та взаємовідносини сприйнятливого та патогенного організмів на видах Triticum. Фітопатологія 47:474-480.
- Holmes, S.J.I., and Colhoun, J. 1974. Інфекція пшениці Septoria nodorum та S. tritici. Trans. Brit. Mycol. Soc. 63:329-338.
- Дженкінс, П.Д. 1978. Взаємодія при захворюваннях зернових. Докторська дисертація. Університет Уельсу.
- Karjalainen, R., and Lounatmaa, K. 1986. Ультраструктура проникнення та колонізації листя пшениці Septoria nodorum. Physiol. Mol. Pl. Pathol. 29:263-270.
- Kema, G.H.J., DaZhao, Y., Rijkenberg, F.H.J., Shaw, M.W., and Baayen, R.P. 1996. Гістологія патогенезу Mycosphaerella graminicola в пшениці. Фітопатологія 86:777-786.
- Keon, J.P.R., and Hargreaves, J.A. 1984. Реакція клітин епідермісу листя ячменю на інфекцію Septoria nodorum. New Phytol. 98:387-398.
- Кінг, Д.Е., Кук, Р.Д. та Мелвілл, С.К. 1983. Огляд септоріозу пшениці та ячменю. Ann.Appl. Biol. 103:345-373.
- Крупинський, Я.М., Шарен, А.Л. та Шилінгер, Я.А. 1973. Варіації збудника Septoria nodorum Berk. у зв'язку з органною специфічністю, видимою інтенсивністю фотосинтезу та врожайністю пшениці. Physiol. Pl. Pathol. 3:187-194.
- Лехтінен, У. 1993. Ферменти, що руйнують клітинну стінку рослин Septoria nodorum. Physiol. Mol. Pl. Pathol. 43:121-134.
- Магро, П. 1984. Продукція ферментів, що розщеплюють полісахариди, в культурі та під час патогенезу. Plant Sci. Letters 37:63-68.
- Морган, В.М. 1974. Фізіологічні дослідження хвороб пшениці, спричинених Septoria spp. та Fusarium culmorum. Докторська дисертація. Лондонський університет.
- О'Рейлі, П., і Даунс, М.Дж. 1986. Форма виживання Septoria nodorum на безсимптомній озимій пшениці. Trans. Brit. Mycol. Soc. 86:381-385.
- Rapilly, F., Foucault, B., and Lacazedieux, J. 1973. Études sur l'inoculum de Septoria nodorum Berk. (Leptosphaeria nodorum Müller) agent de la septoriose du blé I. Les ascospores. Ann. Фітопатол. 5:131-141.
- Rasanayagam, M.S., Paul, N.D., Royle, D.J., and Ayres, P.G. 1995. Варіації у відповідях Septoria tritici та S. nodorum на ультрафіолетове опромінення in vitro. Mycol. Res. 99:1371-1377.
- Шиптон, В.А., Бойд, В.Р.Д., Розілле, А.А. та Ширер, Б.Л. 1971. Поширені септоріозні хвороби пшениці. Bot. Rev. 37:231-262.
- Стралей, М. Л. 1979. Патогенез Septoria nodorum (Berk.) Berk. На сортах пшениці, що різняться за стійкістю до септоріозу колоса. Дисертація на здобуття наукового ступеня доктора філософії. Університет штату Монтана. 99 стор.
- Стралей, М.Л., і Шарен, А.Л. 1979. Розвиток Septoria nodorum у стійких та сприйнятливих листках пшениці. Фітопатологія 69:920-921.
- Вебер, Г.Ф. 1922. Септоріозні хвороби злаків. Фітопатологія 12:537-585.
- Babadoost, M. & Herbert, T.T. 1984. Фактори, що впливають на інфікування проростків пшениці Septoria nodorum. Фітопатологія, 74: 592-595.
- Еяль, З.Е. 1981. Інтегрований контроль септоріозних хвороб пшениці. Фітохімія, 65: 763-768.
- Еяль, З., Шарен, А.Л., Прескотт, Д.М. та ван Гінкель, М. 1987. Септоріоз пшениці: концепції та методи управління хворобами. Мексика, DF, CIMMYT.
- Поллі, Р.В. та Томас, М.Р. 1991. Дослідження хвороб пшениці в Англії та Уельсі, 1976-1988. Ann. Appl. Biol., 119: 1-20.
- Henze, Mathias: Entwicklung einer anbauparameter- und witterunsabhängigen Befallsprogngnosis von Septoria tritici, CUVILLER VERLAG, Göttingen 2008
- Б.М. Кунфер: Збудники стагоноспорозу та септоріозу зернових культур: Інфекційний процес при септоріозі та стагоноспоріозі зернових: Збірник глобальних досліджень, М. ван Гінкель, А. Макнаб і Я. Крупинський, редактори, Матеріали п'ятого міжнародного семінару з септоріозу 20-24 вересня 1999 р., CIMMYT, Мексика
Рекомендоване обладнання
Перевірте, який набір датчиків потрібен для моніторингу потенційних хвороб цієї культури.