Подсолнечник модели заболеваний
Пуховая плесень
Грибок, вызывающий пуховую росу на подсолнечнике, известен под названиями Plasmopara halstedii или Plasmopara helianthi. Комплекс грибковых патогенов заражает широкий спектр родов семейства Asteraceae, включая дикорастущие и культивируемые виды Helianthus. Заболевание встречается везде, где выращивают подсолнечник.
Жизненный цикл
Начиная с одной ооспоры, которая прорастает и дает начало зооспорангию, дифференциация и выход зооспор являются последующими этапами развития. В присутствии свободной воды зооспоры вскоре перемещаются в места заражения (корень, гипокотиль), если они доступны. После энцистирования и удлинения зародышевой трубки (последнее обычно заканчивается аппрессорием на клетке хозяина) гриб развивает инфекционную структуру (инфекционный пег) для прямого проникновения. В экспериментальных условиях было показано, что зародышевые трубки обычно не образуют аппрессорий в воде, но они делают это в присутствии клеток хозяина (Gray et al., 1985). После проникновения гриб растет внутриклеточно, а затем межклеточно, и после закрепления в восприимчивом хозяине (совместимом) он начинает системно колонизировать все растение, развиваясь предпочтительно в направлении верхушки побега и, в меньшей степени, в направлении корня. При благоприятных условиях происходит бесполое спорообразование на пораженных листьях и иногда на подземных тканях. Полностью развитые спорангии распространяются ветром, а поскольку они недолговечны и чувствительны к засухе и прямому солнечному свету, их выживание зависит от текущей погодной ситуации. Ооспоры также образуются в зараженных частях растений, в основном в тканях корней и нижней части стебля, тогда как листья и верхние части растений, за исключением семян, свободны от этих покоящихся спор (Sackston, 1981; Virányi, 1988; Onan and Onogur, 1991). Наиболее восприимчивой стадией развития хозяина является период между прорастанием и появлением всходов (Meliala et al. 2000).
Выживаемость и источник инокулята
Что касается первичной инфекции, P. halstedii является почвенным патогеном. Его ооспоры служат первичным инокулятом для подземных тканей молодых проростков подсолнечника. Он также может переноситься ветром, вызывая вторичную инфекцию листьев и/или соцветий. В последнем случае гриб может также передаваться через семена: пораженные семена переносят мицелий и/или ооспоры внутрь. Ооспоры развиваются в основном в тканях корней и нижней части стебля пораженных милдью растений, с видимыми симптомами или без них, и с растительными остатками предшествующей культуры подсолнечника попадают в почву. Ооспоры являются долгожителями и способны сохраняться не менее 6-8 лет (Sackston, 1981; Virányi, 1988). Обычно считается, что ооспоры в основном прорастают во влажных условиях. Однако до настоящего времени было получено лишь несколько результатов о динамике прорастания. Было показано, что низкотемпературный шок, предшествующий увлажнению, и присутствие экссудатов хозяина, выделяемых корнями, усиливают процесс прорастания (Delanoe, 1972). В другом отчете (Spring & Zipper 2000) не наблюдалось такого температурного эффекта, и сообщалось, что свежеразвитые ооспоры прорастают спонтанно в воде в течение 10-30 дней, но с очень непостоянной скоростью (1-17%).
Однако вторичная инфекция считается важным фактором распространения болезни в определенных регионах при благоприятных экологических условиях. Помимо того, что вторичная инфекция соцветий может привести к латентному заражению семян путем P. halstedii (Sackston, 1981), из локальных поражений листьев гриб способен развиваться и прорастать в стебель, вызывая системную инфекцию (Spring 2001).
Эпидемиология
Природа инокулята (ооспоры или зооспоры), погодные условия (относительная влажность, температура), место заражения (возраст ткани), а также реакция сорта являются факторами, которые влияют или определяют инфекционный процесс, заболеваемость и тяжесть болезни. Зооспоры, образующиеся при половом или бесполом спорулировании, требуют свободной воды для сохранения жизнеспособности и способности двигаться к очагам инфекции. Следовательно, осадки или интенсивный полив являются необходимым условием для начала инфекции. В ряде исследований было показано, что если в течение первых двух недель после посева выпадает достаточное количество осадков или соответствующего количества воды, то частота первичной инфекции из почвы увеличивается. Однако период времени, благоприятствующий заражению, относительно короткий, и даже восприимчивый подсолнечник с возрастом становится устойчивым (Sackston, 1981). Tourvieille et al. (2008a) обнаружили, что риск поражения милдью пуховой был наибольшим при выпадении обильных осадков, когда проростки подсолнечника находились в наиболее восприимчивой стадии, тогда как обильные осадки перед посевом или после всходов не влияли на процент заболевших растений. Göre (2009), что низкая температура и обильные весенние дожди привели к приблизительно 85% потере урожая и снижению качества подсолнечника в Мраморном регионе Трасе. Помимо условий окружающей среды, на интенсивность заболевания может также влиять агрессивность популяции патогена. Сакр и др. (2009) смогли дифференцировать два штамма патогена с точки зрения их агрессивности на основе латентного периода популяции и плотности споруляции.
Аспекты переноса семян
P. halstedii был обнаружен в семенах подсолнечника из естественно зараженных растений в виде мицелия или ооспор (Novotel'nova, 1966). Докен (1989) сообщил, что мицелий был обнаружен только в семенниках и во внутреннем слое околоплодника; в зародыше он отсутствовал. После искусственной инокуляции Коэн и Сэкстон (1973) подтвердили, что бутоны подсолнечника, инокулированные P. halstedii заразились системно и произвели инфицированные семена. Ооспоры наблюдались в семенах инокулированных и естественно зараженных растений в полевых условиях. Другие сообщения о заражении семян известны из Ирана (Zad, 1978), Турции (Döken, 1989) и Германии (Spring, 2001). Гриб обычно поражает завязь и околоплодник, но не прорастает в зародыш (Novotel'nova, 1966; Döken, 1989). Инфицирование семян регулярно происходит у системно зараженных растений, если они доживают до стадии цветения. В таких случаях развитие зародыша часто задерживается или подавляется. Кроме того, такие растения карликовые и редко собирают урожай. Они могут увеличить местный запас ооспор на поле, но для распространения патогена на большие расстояния через семена они, по-видимому, менее важны, чем семена от поздно инфицированных бессимптомных растений (Spring, 2001). Последний тип инфекции очень зависит от погодных условий во время цветения. Так, в засушливые годы количество зараженных патогеном семян очень мало и не превышает нескольких на тысячу, но может быть гораздо выше после прохладного и влажного периода в июне/июле. Например, Spring (2001) обнаружил, что почти 10% семян с поля в Германии были заражены, а Döken (1989) при благоприятных экспериментальных условиях наблюдал грибковые структуры в 28% исследованных семян.
Влияние на качество семян
Семена подсолнечника, произведенные на растениях, пораженных мучнистой росой, либо недоразвиты, либо бесцветны, либо, в редких случаях, выглядят здоровыми. Даже в последнем случае такие зараженные семена имеют низкое качество; они дают ненормальные проростки, а процент всхожести низкий (Döken, 1989).
Для получения дополнительной информации загляните на главную страницу сайта CABI.
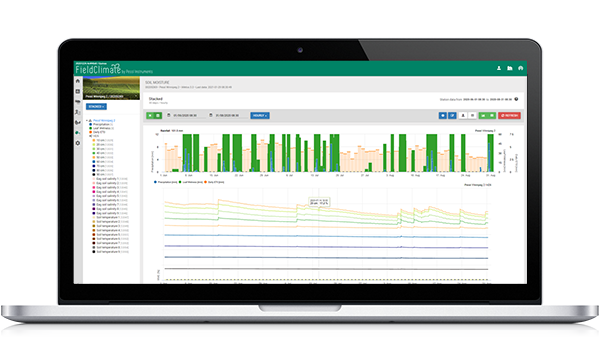
Модель в FieldClimate
Используемые датчики: температура почвы, осадки, влажность листьев, температура воздуха и относительная влажность.
Мы начинаем вычислять развитие инфекции, когда температура находится в диапазоне от 6 до 32°C с оптимумом от 18 до 24°C, а температура почвы выше 10°C. В дальнейшем влажные условия являются благоприятными для развития болезни (дождь, относительная влажность выше 70%).
Макроспорангии образуются при температуре почвы выше 10°C и выпадении осадков (относительная влажность более 70%). Сброс происходит, если относительная влажность падает ниже 50%.
Если Макроспорангии полностью развиты - начинаются расчеты на почвенную или воздушную инфекцию (в графике называемую первичной инфекцией) (в условиях увлажнения листьев).
Спорангии образуются при влажных условиях (более 95% об.ч.), в темноте и температуре выше 12°C. Сброс происходит днем и когда спорангии не полностью развиты.
Если спорангии полностью развиты, то в зависимости от температуры воздуха начинается развитие вторичной инфекции.
На Графике вы видите в конце апреля длительный влажный период, который привел к образованию макроспор и почвенной инфекции (первичная корневая инфекция). Воздушная инфекция (называемая здесь первичной) не была определена первого мая, но условия были благоприятными, поэтому она была определена 2 мая. Если в это время проростки подсолнечника находятся в чувствительной стадии (только что посеяны), необходимо учитывать меры контроля (профилактические системные фунгициды, в основном фосфорные кислоты).
Ссылки:
- Achbani EH, Lamrhari A, Serrhini MN, Douira A, Tourvieille de Labrouche D, 1999. Оценка эффективности обработки семян против Plasmopara halstedii. Бюллетень OEPP, 29(4):443-449; 15 ссылок.
- Achbani EH, Tourvieille D, 1993. Le tournesol au Maroc. Фитома, 448:30-32.
- Agrawal SC, Gupta RK, Prasad KVV, 1991. Случай пуховой росы подсолнечника в штате Мадхья-Прадеш. Журнал исследований масличных культур, 8(1):126
- Albourie JM, Tourvieille J, Labrouhe DTde, 1998. Устойчивость к металаксилу у изолятов патогена подсолнечника Plasmopara halstedii. Европейский журнал патологии растений, 104(3):235-242; 27 ссылок.
- Albourie JM, Tourvieille J, Tourvieille de Labrouhe D, 1998. Устойчивость к металаксилу у французских изолятов мучнистой росы. In: Gulya T, ed. Vear F, ed. Proc. Third Sunflower Downy Mildew Symposium, Fargo, USA: ISA, 235-242.
- Bán R, Kovács A, Körösi K, Perczel M, Turóczi G, 2014. Первое сообщение о появлении нового патотипа, 714, Plasmopara halstedii (пуховая милдью подсолнечника) в Венгрии. Болезни растений, 98(11):1580-1581.
- Bán R, Kovács A, Perczel M, Körösi K, Turóczi G, 2014. Первое сообщение об увеличении распространения патотипа 704 Plasmopara halstedii в Венгрии. Болезни растений, 98(6):844.
- Batinica J, Bes A, Dimic N, Numic R, Radman L, Ristanovic M, Vaclav V, 1973. Вклад в познание вредной фауны и причин болезней подсолнечника в районе его выращивания в республике Босния и Герцеговина. Radovi Poljoprivrednog Fakulteta Univerziteta u Sarajevu, 21/22(24/25):203-210
- Берлезе А.Н., Де-Тони Ж.Б., 1888. Phycomycetteae. In: Sylloge fungorum, VII:242.
- Bohár G, Vajna L, 1996. Появление микроскопических грибов, патогенных для Ambrosia artemisifolia var. elatior (L.) Descourt. в Венгрии. Növényvédelem, 32:527-528.
- Боровков А.Ю., МакКлин П.Е., 1993. Тандемно повторяющаяся последовательность из генома Plasmopara halstedii. Ген, 124(1):127-130
- Borovkova IG, Borovkov AY, McClean PE, Gulya TJ, Vick BA, 1992. Полиморфизмы длины рестрикционных фрагментов и RAPD-маркеры в ДНК Plasmopara halstedii, гриба мучнистой росы подсолнечника. Материалы 13-й Международной конференции по подсолнечнику, том 2, Пиза, Италия, 7-11 сентября 1992 г., 1420-1425; 9 ссылок.
- Bouterige S, Robert R, Bouchara JP, Marot-Leblond A, Molinero V, Senet JM, 2000. Производство и характеристика двух моноклональных антител, специфичных для Plasmopara halstedii. Прикладная и экологическая микробиология, 66(8):3277-3282; 33 ссылки.
- Bouterige S, Robert S, Marot-Leblond A, Senet JM, 2000. Разработка теста ELISA для обнаружения антигенов Plasmopara halstedii в семенах. In: Proc. 15th Int. Sunflower Conference Toulouse, France: ISA (F):44-49.
- CABI/EPPO, 1998. Карты распространения карантинных вредителей для Европы (под редакцией Смита, И. М. и Чарльза, Л. М. Ф.). Уоллингфорд, Великобритания: CAB International, xviii + 768 стр.
- КАБИ/ЭППО, 2014. Plasmopara halstedii. Карта распространения. Карты распространения болезней растений, № октябрь. Уоллингфорд, Великобритания: CABI, карта 286 (издание 6).
- Choi YJ, Park MJ, Shin HD, 2009. Первый корейский отчет о пуховой росе на Coreopsis lanceolata, вызванной Plasmopara halstedii. Патология растений, 58(6):1171.
- CMI, 1988. Карты распространения болезней растений. Карта № 286. Уоллингфорд, Великобритания: CAB International.
- Cohen Y, Sackson WE, 1974. Заражение семян и латентное заражение подсолнечника Plasmopara halstedii. Канадский журнал ботаники, 52:231-238.
- Деланоэ Д, 1972. Biologie et epidemiologie du mildiou du tournesol (Plasmopara helianthi Novot.). CETIOM Informations Techniques, 29:1-49.
- Delen N, Onogur E, Yildiz M, 1985. Уровни чувствительности к металаксилу у шести изолятов Plasmopara helianthi Novot. Журнал турецкой фитопатологии, 14(1):31-36
- Delos M, Penaud A, Lafon S, Walser P, De Guenin MC, Tourvieille J, Molinero V, Tourvieille D, 1997. Le mildiou de tournesol - Une maladie toujours d'actualitT. Phytoma, 495á:15-16.
- Докен МТ, 1989. Plasmopara halstedii (Farl.) Berl. et de Toni в семенах подсолнечника и роль инфицированных семян в производстве растений с системными симптомами. Журнал фитопатологии, 124(1-4):23-26
- Duarte LL, Choi YJ, Barreto RW, 2013. Первое сообщение о пуховой росе, вызванной Plasmopara halstedii на Gerbera jamesonii в Бразилии. Болезни растений, 97(10):1382.
- ЕОКЗР, 2014. База данных PQR. Париж, Франция: Европейская и Средиземноморская организация по карантину и защите растений.
- Европейская и Средиземноморская организация по защите растений, 2008. Plasmopara halstedii. Бюллетень OEPP/ Бюллетень ЕОКЗР, 38(3):343-348.
- Garcia GM, Gulya TJ, 1991. Распространение рас пуховой милдью подсолнечника в Северной Дакоте и Миннесоте. In: Материалы семинара по исследованию подсолнечника 1991 года, Фарго, США: Национальная ассоциация подсолнечника, 3-5.
- Giresse X, Labrouhe DTDe , Richard-Cervera S, 2007. Twelve polymorphic expressed sequence tags-derived markers for Plasmopara halstedii, the causal agent of sunflower downy mildew, 7:1363-1365.
- Göre ME, 2009. Эпидемические вспышки пуховой росы, вызванной Plasmopara halstedii, на подсолнечнике во Фракии, части Мраморного региона Турции. Патология растений, 58(2):396.
- Gray AB, Sackston WE, Thauvette L, 1985. Развитие инфекционных структур Plasmopara halstedii в суспензии клеток подсолнечника. Канадский журнал ботаники, 63(10):1817-1819
- Грей Б, Сэкстон ВЭ, 1983. Исследования культур тканей и клеточных культур подсолнечника, инокулированных Plasmopara halstedii. Канадский журнал патологии растений, 5:206.
- Greathead DJ, Greathead AH, 1992. Биологический контроль насекомых-вредителей с помощью насекомых-паразитоидов и хищников: база данных BIOCAT. Новости и информация по биоконтролю, 13(4):61N-68N.
- Gullino ML, Garibaldi A, 1988. Криптогамные заболевания основных цветочных растений, выращиваемых в горшках. Panorama Floricolo, 13(5):4-8.
- Гуля TJ, 1995. Простой метод оценки реакции корней "устойчивых" к милдью линий подсолнечника. In: Proceedings of the 17th Sunflower Research Workshop, Fargo, USA: National Sunflower Association, 63-66.
- Гуля Т.Я., 1995. Предложение по пересмотренной системе классификации рас пуховой милдью подсолнечника. In: Proceedings of the 17th Sunflower Research Workshop, Fargo, USA: National Sunflower Association, 76-78.
- Гуля Т. Дж., 1996. Болезни подсолнечника на севере Великих равнин. In: Proceedings of the 18th Sunflower Research Workshop, Fargo, USA: National Sunflower Association, 24-27.
- Гуля Т.Дж., 2000. Устойчивость к металаксилу у пуховой росы подсолнечника и контроль с помощью генетики и альтернативных фунгицидов. In: Proc. 15th Int. Sunflower Conference Toulouse, France: ISA (G):16-21.
- Гуля Т.Я., 2007. Распространение рас Plasmopara halstedii из подсолнечника по всему миру, 3:121-134.
- Гуля TJ, Рашид KY, Масиревич SM, 1997. Болезни подсолнечника. In: Schneiter AA, ed. Технология и производство подсолнечника. Номер 35 в серии "Агрономия". Висконсин, США: Амер. Soc. Agronomy, 263-379.
- Гуля TJ, Сэкстон WE, Вираньи F, Масиревич S, Рашид KY, 1991. Новые расы возбудителя пуховой росы подсолнечника (Plasmopara halstedii) в Европе, Северной и Южной Америке. Журнал фитопатологии, 132(4):303-311
- Gulya TJ, Tourvieille de Labrouhe D, Masirevic S, Penaud A, Rashid K, Viranyi F, 1998. Предложение по стандартизированной номенклатуре и идентификации рас Plasmopara halstedii (пуховой милдью подсолнечника). In: Gulya T, ed. Vear F, ed. Third Sunflower Downy Mildew Symposium. Фарго, США: ISA, 130-136.
- Гуля TJ, Вираньи F, Ноуэлл D, Серрини MN, Аруай K, 1996. Новые расы пуховой росы подсолнечника из Европы и Африки. In: Proceedings of the 18th Sunflower Research Workshop, Fargo, USA: National Sunflower Association, 181-184.
- Гуля TJ, Вудс DM, Белл R, Манкл MK, 1991. Болезни подсолнечника в Калифорнии. Болезни растений, 75(6):572-574
- Холл Г, 1989. Необычные или интересные записи о патогенных для растений оомицетах. Патология растений, 38(4):604-611
- Хармон ПФ, Данкл ЛД, Латин Р, 2003. Быстрый метод на основе ПЦР для обнаружения Magnaporthe oryzae из зараженного многолетнего райграса. Болезни растений, 87(9):1072-1076.
- Хеллер А, Рожинек Б, Шпринг О, 1997. Цитологические и физиологические причины латентного типа инфекции у подсолнечника, вызванной Plasmopara halstedii. Журнал фитопатологии, 145(10):441-445; 15 ссылок.
- Хеннинг А.А., Франка Нето Ж.Б., 1985. Физиологическая раса и источники устойчивости к пушистой милдью (Plasmopara halstedii (Farl.) Berlese et de Toni) в Бразилии. In: Материалы 11-й Международной конференции по подсолнечнику, Мар-дель-Плата, Аргентина: Том 2, 407-409.
- Hong CX, 2006. Downy mildew of Rudbeckia fulgida cv. Goldsturm by Plasmopara halstedii in Virginia. Болезни растений, 90(11):1461. HTTP://www.apsnet.org
- Хуа Z, Ма G, 1996. Обзор исследований болезней подсолнечника в Китае. In: Материалы 14-й Международной конференции по подсолнечнику, Пекин, Китай: ISC-LAAS, 754-759.
- Intelmann F, Spring O, 2002. Анализ общей ДНК с помощью минисателлитных праймеров и праймеров, повторяющих простые последовательности, для использования в популяционных исследованиях у Plasmopara halstedii. Канадский журнал микробиологии, 48(6):555-559; 25 ссылок.
- IPPC, 2010. Первая находка Plasmopara halstedii в Великобритании. Официальный отчет МККЗР о вредителях, № GBR-23/1. Рим, Италия: ФАО.
- Jardine DJ, Gulya TJ, 1994. Первое сообщение о пуховой росе на подсолнечнике, вызванной Plasmopara halstedii в Канзасе. Болезни растений, 78(2):208
- Kinga R, Bíró J, Kovács A, Mihalovics M, Nébli L, Piszker Z, Treitz M, Végh B, Csikász T, 2011. Появление новой расы пуховой росы подсолнечника в юго-восточном регионе Венгерской Великой равнины. (Újabb napraforgó-peronoszpóra rassz megjelenése Magyarországon, a Dél-kelet Alföldi régióban.). Növényvédelem, 47(7):279-286.
- Кола К, 1980. Сравнительное изучение сортов подсолнечника для оценки их устойчивости к грибковым заболеваниям в районе Задрима. Buletini i Shkencave Bujqesore, 19:87-94.
- Komjáti H, Walcz I, Virányi F, Zipper R, Thines M, Spring O, 2007. Характеристики изолята Plasmopara angustiterminalis из Xanthium strumarium. Европейский журнал патологии растений, 119(4):421-428.
- Kucmierz J, 1976. Plasmopara helianthi Novot., новый вид гриба для Польши. Fragmenta Floristica et Geobotanica, 22(3):373-375
- Labrouhe DDe , Walser P, Serre F, Roche S, Vear F, 2008. Связь между весенними осадками и заражением подсолнечника Plasmopara halstedii (пушистая милдью). Кордова, Испания, 8-12 июня 2008 года. In: Материалы 17-й Международной конференции по подсолнечнику под ред. Савиль, Испания: Совет по сельскому хозяйству и рыболовству, 97-102.
- Lafon S, Penaud A, Walser P, De Guenin M-Ch, Molinero V, Mestres R, Tourvieille D, 1996. Le mildiou du tournesol toujour sou surveillance. Фитома, 484:35-36.
- Leite RMVBde C, Henning AA, Rodrigues SR, Oliveira MFde, 2007. Обнаружение и изменчивость Plasmopara halstedii в Бразилии и устойчивость генотипов подсолнечника к мучнистой росе. (Detecção e variabilidade de Plasmopara halstedii no Brasil e avaliação da resistência de genótipos de girassol ao míldio.) Summa Phytopathologica, 33(4):335-340.
- Леппик Е.Е., 1966. Происхождение и специализация комплекса Plasmopara halstedii в Compositae. Бюллетень ФАО по защите растений, 14:72-76.
- Liese AR, Gotlieb AR, Sackston WE, 1982. Использование иммуноферментного анализа (ELISA) для обнаружения пуховой росы (Plasmopara halstedii) на подсолнечнике. In: Proceedings of the 10th International Sunflower Conference, Surfers Paradise, Australia, 173-175.
- Любич А, Гуля Т.Я., 1988. Ограниченная котиледонами системная инфекция пуховой росы. In: Proceedings of the 1988 Sunflower Research Workshop, Bismarck, USA: National Sunflower Association, 9.
- Масиревич С, 1992. Расы пушистой росы (Plasmopara halstedii) на подсолнечнике, существующие в нашем регионе и в мире. Zbornik Radova, 20:405-408.
- Mayee CD, Patil MA, 1987. Downy mildew of sunflower in India. Tropical Pest Management, 33(1):81-82
- Melero-Vara JM, Garcia-Baudin C, Lopez-Herrera CJ, Jimenez-Diaz RM, 1982. Контроль пуховой росы подсолнечника с помощью металаксила. Болезни растений, 66(2):132-135
- Melero-Vara JM, Molinero Luiz L, Merino A, Dominguez J, 1996. Razas de Plasmopara halstedii presentes en Espana y evaluacion de susceptibilidad en hibridos comerciales. In: Материалы симпозиума ISA I, Устойчивость к болезням у подсолнечника, Пекин, Китай: Международная ассоциация подсолнечника, 7-13.
- Meliala C, Vear F, Labrouhe DTde, 2000. Связь между датой заражения подсолнечника пуховой милдью (Plasmopara halstedii) и развитием симптомов. Helia, 23(32):35-44.
- Molinero-Ruiz ML, Domfnguez J, Melero-Vara JM, 2002. Расы изолятов Plasmopara halstedii из Испании и исследования их вирулентности. Болезни растений, 86(7):736-740; 28 ссылок.
- Мозес Г.Дж., 1989. Новое появление пуховой росы подсолнечника в Андхра-Прадеш. Журнал исследований APAU, 17(1):73
- Nandeeshkumar P, Ramachandra K, Prakash HS, Niranjana SR, Shetty H, 2008. Индукция устойчивости против пуховой росы на подсолнечнике с помощью ризобактерий, 3(4):255-262.
- Nandeeshkumar P, Sarosh BR, Kini KR, Prakash HS, Shetty HS, 2009. Элицитация устойчивости и связанных с защитой белков бета-аминомасляной кислотой в подсолнечнике против патогена пушистой плесени Plasmopara halstedii. Архивы фитопатологии и защиты растений, 42(11):1020-1032.
- Nandeeshkumar P, Sudisha J, Ramachandra KK, Prakash HS, Niranjana SR, Shekar SH, 2008. Индуцированная хитозаном устойчивость к пушистой росе подсолнечника, вызванной Plasmopara halstedii. PMPP Physiological and Molecular Plant Pathology, 72(4/6):188-194.
- Николов Г, 1981. Апрон 35 СД, эффективный препарат в борьбе с пуховой росой подсолнечника. Растительная Защита, 29(3):40-41
- Нисимура М, 1922. Исследования в Plasmopara halstedii. J. Coll. Agric, 3(XI):185-210.
- Новотельнова Н.С., 1966. Дауни-милдью подсолнечника. Москва, СССР: Наука.
- Онан Э, Оногур Э, 1989. Ветряная роса подсолнечника (Plasmopara helianthi Novot.). Ege Universitesi Ziraat Fakultesi Dergisi, 26(1):271-286
- Onan E, Onogur E, 1991. Исследования связи между хозяином и патогеном пушистой росы подсолнечника (Plasmopara helianthi Novot.). Журнал турецкой фитопатологии, 20(1):1-10
- Oros G, Viranyi F, 1987. Оценка фунгицидов в теплице для борьбы с пуховой росой подсолнечника (Plasmopara halstedii). Анналы прикладной биологии, 110(1):53-63
- Патил М.А., Майе К.Д., 1988. Исследования опушенной милдью подсолнечника в Индии. In: Материалы 12-й Международной конференции по подсолнечнику, Нови Сад, Югославия: 2:42.
- Patil MA, Phad HB, Ramtirthkar MS, 1993. Появление и распространение недавно появившейся пуховой росы подсолнечника в Махараштре. Журнал сельскохозяйственных университетов Махараштры, 18(1):129-130
- Rahmani Y, Madjidieh-Ghassemi S, 1975. Исследование относительной устойчивости различных сортов и инбредных линий подсолнечника к пушистой плесени Plasmopara helianthi Novt. в теплице и в экспериментальном полевом испытании, 1973. Иранский журнал патологии растений, 11(3/4):96-104; 42-45
- Рашид К.Ю., 1991. Листовая милдью подсолнечника в Манитобе. In: Материалы семинара по исследованию подсолнечника, Фарго, США: Национальная ассоциация подсолнечника, 12.
- Рашид К.Ю., 1993. Заболеваемость и вирулентность Plasmopara halstedii на подсолнечнике в западной Канаде в 1988-1991 годах. Канадский журнал патологии растений, 15(3):206-210
- Rivera Y, Rane K, Crouch JA, 2014. Первое сообщение о пушистой плесени, вызванной Plasmopara halstedii на черноглазой Сьюзен (Rudbeckia fulgida cv. 'Goldsturm') в Мэриленде. Plant Disease, 98(7):1005-1006.
- Roeckel-Drevet P, Coelho V, Tourvieille J, Nicolas P, Labrouhe DTde, 1997. Отсутствие генетической изменчивости во французских идентифицированных расах Plasmopara halstedii, вызывающих пуховую росу подсолнечника Helianthus annuus. Канадский журнал микробиологии, 43(3):260-263; 23 ссылки.
- Roeckel-Drevet P, Tourvieille J, Drevet JR, Says-Lesage V, Nicolas P, Labrouhe DTde, 1999. Разработка диагностического теста полимеразной цепной реакции для выявления биотрофного патогена Plasmopara halstedii в подсолнечнике. Канадский журнал микробиологии, 45(9):797-803; 27 ссылок.
- Rozynek B, Spring O, 2000. Патотипы пуховой росы подсолнечника в южных районах Германии. Helia, 23(32):27-34; 18 ссылок.
- Рожинек Б, Спринг О, 2001. Инокуляция листового диска, быстрый и точный тест для скрининга толерантности к металаксилу в пуховой росе подсолнечника. Журнал фитопатологии, 149(6):309-312; 17 ссылок.
- Ruiz MLM, Dominguez J, Vara JMM, Gulya TJ, 2000. Толерантность к металаксилу у испанских изолятов Plasmopara halstedii. In: Proc. 15th Int. Sunflower Conference Toulouse, France: ISA, (G):11-15.
- Sackston WE, 1981. Downy mildew of sunflower. In: Spencer DE, ed. The Downy Mildews. Лондон, Великобритания: Академическая пресса, 545-575.
- Sackston WE, 1992. На беговой дорожке: селекция подсолнечника на устойчивость к болезням. Annual Review of Phytopathology, 30:529-551; 123 ссылки.
- Sackston WE, Anas O, Paulitz T, 1992. Биологический контроль пуховой росы подсолнечника. In: Abstracts of the American Phytopathological Society North-East Division Meeting, Portland, USA: 33.
- Sakr N, Ducher M, Tourvieille J, Walser P, Vear F, Labrouhe DTde, 2009. Метод измерения агрессивности Plasmopara halstedii (пуховая роса подсолнечника). Журнал фитопатологии, 157(2):133-136.
- Says-Lesage V, Meliala C, Nicolas P, Roeckel-Drevet P, Tourvieille de Labrouhe D, Archambault D, Billaud F, 2001. Молекулярный тест для выявления наличия милдью (Plasmopara halstedii) в семенах подсолнечника. OCL - Ole^acute~agineux, Corps Gras, Lipides, 8(3):258-260; 5 ссылок.
- Schuck E, Jobim CIP, 1988. Болезни подсолнечника (Helianthus annuus L.) в Виамао и Санто-Августо, Рио-Гранде-ду-Сул. Agronomia Sulriograndense, 24(2):221-232; 12 ссылок.
- Симай Е.И., 1993. Встречаемость редких микрогрибов, наблюдаемых в районах Будатетень и Чинкота в Будапеште. Mikologiai Kozlemenyek, 32(1-2):81-89
- Скорич Д, 1994. Селекция подсолнечника на устойчивость к доминирующим болезням. In: Труды секции масличных и белковых культур EUCARPIA, симпозиум по селекции масличных и белковых культур, Албена, Болгария, 30-48.
- Спринг О, 2000. Гомоталлическое половое размножение у Plasmopara halstedii, пушистой милдью подсолнечника. Helia, 23(32):19-26; 13 ссылок.
- Spring O, 2001. Несистемные инфекции подсолнечника Plasmopara halstedii и их предполагаемая роль в распространении патогена. Журнал болезней и защиты растений, 108:329-336.
- Spring O, Benz A, Faust V, 1991. Влияние инфекции пуховой росы (Plasmopara halstedii) на развитие и метаболизм подсолнечника. Zeitschrift fur Pflanzenkrankheiten und Pflanzenschutz, 98(6):597-604
- Spring O, Haas K, 2002. Состав жирных кислот Plasmopara halstedii и его таксономическое значение. Европейский журнал патологии растений, 108(3):263-267; 20 ссылок.
- Spring O, Miltner F, Gulya TJ, 1994. Новые расы пуховой росы подсолнечника (Plasmopara halstedii) в Германии. Журнал фитопатологии, 142(3-4):241-244
- Spring O, Rozynek B, Zipper R, 1998. Заражение одиночными спорами пуховой росы подсолнечника. Journal of Phytopathology, 146(11/12):577-579; 7 ссылка.
- Спринг О, Зиппер Р, 2000. Изоляция ооспор пушистой плесени подсолнечника, Plasmopara halstedii, и микроскопические исследования прорастания ооспор. Журнал фитопатологии, 148(4):227-231; 15 ссылок.
- Спринг О, Зиппер Р, 2006. Доказательства бесполой генетической рекомбинации в пуховой росе подсолнечника, Plasmopara halstedii. Микологические исследования, 110(6):657-663.
- Sudisha J, Niranjana SR, Sukanya SL, Girijamba R, Devi NL, Shetty HS, 2010. Относительная эффективность стробилуриновых препаратов в борьбе с пуховой росой подсолнечника. Journal of Pest Science, 83(4):461-470.
- Thanassoulopoulos CC, Mappas CB, 1992. Первое сообщение о пуховой росе подсолнечника в Греции. Болезни растений, 76(5):539
- Tourvieille J, Roeckel-Drevet P, Nicolas P, Tourvieille de Labrouhe D, 1996. Характеристика рас пуховой росы подсолнечника (Plasmopara halstedii) с помощью RAPD. In: Труды 14-й Международной конференции по подсолнечнику, Пекин, 781-785.
- Вида Р, 1966. Downy mildew of sunflower: a significant return. Növényvédelem, 32:533-535.
- Вираньи Ф, 1984. Последние исследования по пушистой росе подсолнечника в Венгрии. Helia, 7:35-38.
- Virányi F, 1988. Факторы, влияющие на образование ооспор у Plasmopara halstedii. In: Материалы 12-й Международной конференции по подсолнечнику, Нови Сад, Югославия, том 2:32.
- Viranyi F, Gulya TJ, 1995. Межизоляционная вариация вирулентности у Plasmopara halstedii (пуховая роса подсолнечника) из Венгрии. Патология растений, 44(4):619-624
- Virányi F, Gulya TJ, 1995a. Патогенная изменчивость Plasmopara halstedii. In: Тезисы докладов 1-го Международного симпозиума по грибкам пуховой росы, Гват, Швейцария: Федерация европейских микробиологических обществ, Ciba-Geigy.
- Virányi F, Gulya TJ, 1996. Выражение устойчивости в патосистеме Plasmopara halstedii - подсолнечник. In: Материалы симпозиума ISA I, Толерантность к болезням у подсолнечника, Пекин, Китай: Международная ассоциация подсолнечника, 14-21.
- Viranyi F, Sziraki I, 1986. Создание двойных культур Plasmopara halstedii и подсолнечника. Transactions of the British Mycological Society, 87(2):323-325
- Viranyi F, Walcz I, 2000. Популяционные исследования Plasmopara halstedii: специфичность хозяина и устойчивость к грибкам. In: Материалы 15-й Международной конференции по подсолнечнику в Тулузе, Франция: ISA, (I):55-60.
- Walcz I, Bogßr K, Virßnyi F, 2000. Исследование изолята амброзии Plasmopara halstedii. Helia, 23(33):19-24; 8 ссылок.
- Ян СМ, Вэй СЭ, 1988. Болезни культивируемого подсолнечника в провинции Ляонин, Китайская Народная Республика. Болезни растений, 72(6):546
- Yorinori FT, Henning AA, Ferreira LP, Homechin M, 1985. Болезни подсолнечника в Бразилии. In: Материалы 11-й Международной конференции по подсолнечнику, Мар-дель-Плата, Бразилия, 459.
- Zad J, 1978. Передача пуховой росы подсолнечника через семена. Иранский журнал патологии растений, 14(1/4):1-2; 1-7
- Zazzerini A, 1978. Распространение Plasmopara helianthi Novot в зависимости от наклона. Phytopathologia Mediterranea, 17(3):153-156
- Zazzerini A, 1983. Болезнь пероноспоры (Plasmopara helianthi Novot.) подсолнечника: физиологические расы паразита и методы идентификации зараженного материала. Informatore Fitopatologico, 33(2):117-119
- Zimmer DE, 1974. Физиологическая специализация между расами Plasmopara halstedii в Америке и Европе. Phytopathology, 64(11):1465-1467
Склеротиниевая гниль
Карпогенное прорастание склероциев стимулируется периодами непрерывного увлажнения почвы. На поверхности почвы образуются апотеции, из которых аскоспоры выходят в воздух. Инфицирование большинства видов сельскохозяйственных культур в основном связано с аскоспорами, но прямого заражения здоровых, неповрежденных тканей растений от прорастающих аскоспор обычно не происходит. Вместо этого заражение тканей листьев и стеблей здоровых растений происходит только тогда, когда прорастающие аскоспоры колонизируют мертвые или стареющие ткани, обычно части цветка, такие как отпавшие лепестки, до образования инфекционных структур и проникновения инфекции. Мицелиогенное прорастание склероциев на поверхности почвы также может привести к колонизации мертвого органического вещества с последующим заражением соседних живых растений. Однако на некоторых культурах, например, на подсолнечнике, мицелиогенное прорастание склероциев может непосредственно инициировать инфекционный процесс в корнях и базальном стебле, что приводит к увяданию. Стимул для мицелиального прорастания и инфекции у подсолнечника неизвестен, но, вероятно, зависит от питательных сигналов в ризосфере, поступающих от растений-хозяев.
Инфекционный процесс
Инфицирование здоровых тканей зависит от формирования аппрессория, который может иметь простую или сложную структуру в зависимости от поверхности хозяина. В большинстве случаев проникновение происходит непосредственно через кутикулу, а не через стоматы. Аппрессории развиваются из терминального дихотомического ветвления гиф, растущих на поверхности хозяина, и состоят из площадки широких, многосептальных, коротких гиф, ориентированных перпендикулярно поверхности хозяина, к которой они прикреплены муцилажем. Сложные аппрессории часто называют инфекционными подушками. Хотя ранние исследователи считали проникновение в кутикулу чисто механическим процессом, ультраструктурные исследования убедительно доказывают, что ферментативное переваривание кутикулы также играет роль в процессе проникновения. Мало что известно о S. sclerotiorum кутиназы, однако геном кодирует по крайней мере четыре кутиназоподобных фермента (Hegedus, неопубликованное). Большая везикула, сформированная на кончике аппрессория до проникновения, по-видимому, высвобождается в кутикулу хозяина во время проникновения. После проникновения в кутикулу образуется субкутикулярная везикула, из которой веером расходятся крупные гифы, разрастаясь и растворяя субкутикулярную стенку эпидермиса.
Заражение путем ферментативной деградации эпидемических клеток: Щелочная кислота взаимодействует с ферментами, разрушающими клеточную стенку, такими как полигалактуроназа (ПГ), и приводит к разрушению тканей хозяина, создавая среду, благоприятную для атаки ПГ на пектин в средней ламели. Это, в свою очередь, приводит к высвобождению низкомолекулярных производных, которые вызывают экспрессию дополнительных генов PG. Действительно, общая активность PG индуцируется пектином или производными пектина моносахаридами, такими как галактуроновая кислота, и подавляется в присутствии глюкозы. Изучение паттернов экспрессии отдельных генов Sspg показало, что взаимодействие между ПГ и хозяином на различных стадиях инфекции тщательно скоординировано. (Дуэйн Д. Хегедус *, С. Роджер Риммер: Sclerotinia sclerotiorum: Когда "быть или не быть" патогеном? FEMS Microbiology Letters 251 (2005) 177-184)
Поиск климатических условий для заражения S. sclerotiorum необходимо учитывать образование апотециев, споруляцию, прямое заражение апотецием (даже если это происходит не очень часто) и заражение от установленных мицелиев путем энциматической деградации эпидемических клеток. Образование апотециев и споруляция происходит, если за дождем более 8 мм следует период высокой относительной влажности, длящийся более 20 часов при оптимальной температуре от 21°C до 26°C.
Прямое заражение апотециями можно ожидать после периода увлажнения листьев, за которым следует 16 часов относительной влажности выше, чем 90% при оптимальных условиях от 21°C до 26°C ("заражение аппрессориями"). В то время как сапрофитный рост с последующей энциматической деструкцией клеток эпидермиса ("гидролитическая инфекция") можно ожидать при несколько более низкой относительной влажности 80% в течение 24 часов при оптимальных условиях от 21°C до 26°C.
Литература:
- Lumsden, R.D. (1976) Пектолитические ферменты Sclerotinia sclerotiorum и их локализация на инфицированных бобах. Can. J. Bot. 54,2630-2641.
- Тарик, В.Н. и Джеффрис, П. (1984) Образование аппрессориев склеротинией Sclerotinia sclerotiorum: сканирующая электронная микроскопия. Trans. Brit. Mycol. Soc. 82, 645-651.
- Бойл, К. (1921) Исследования по физиологии паразитизма. VI. Заражение склеротинией Либертиана. Ann. Bot. 35, 337-347.
- Abawi, G.S., Polach, F.J. and Molin, W.T. (1975) Заражение бобов аскоспорами Whetzelinia sclerotiorum. Фитопатология 65, 673-678.
- Tariq, V.N. and Jeffries, P. (1986) Ультраструктура проникновения Sclerotinia sclerotiorum в Phaseolus spp. Can. J. Bot. 64, 2909- 2915.
- Marciano, P., Di Lenna, P. and Magro, P. (1983) Оксалевая кислота, ферменты, разрушающие клеточную стенку, и pH в патогенезе и их значение в вирулентности двух изолятов Sclerotinia sclerotiorum на подсолнечнике. Физиол. Plant Pathol. 22, 339-345.
- Fraissinet-Tachet, L. and Fevre, M. (1996) Регулирование галактуроновой кислотой производства ппектинолитического фермента склеротинией Sclerotinia sclerotiorum. Curr. Microbiol. 33, 49-53.
Практическое использование модели склеротинии
Модель заражения белой ножкой показывает периоды, когда ожидается образование апотециев. Если эти периоды совпадают с периодом цветения семян рапса или канолы, мы должны ожидать, что S. sclerotiorum инфекции в течение влажного периода. Споры, образовавшиеся в апотециях, могут быть доступны от одного до нескольких дней. О возможности заражения свидетельствует расчет хода инфекции для прямого или косвенного заражения через апотеции или ферментативную деградацию клеточной стенки. Если линия развития инфекции достигает 100%, следует предположить наличие инфекции. Эти инфекции следует лечить профилактически или фунгицидом с лечебным действием против S. sclerotiorum должен быть использован.
Серая плесень
Серая плесень (Botrytis cinerea) является разрушительным заболеванием с высоким экономическим эффектом в производстве. B. cinerea Заражает цветы и плоды, близкие к созреванию.
Этот грибковый патоген имеет очень широкий круг хозяев, заражая более 200 различных хозяев. Грибковый рост существует сапрофитно и паразитарно.
Симптомы
На подсолнечнике патоген вызывает серую плесень на головке и стебле. В это время листья начинают засыхать. Эти симптомы появляются во время созревания зерен на головке. На тыльной стороне видны коричневые пятна. Эти пятна покрыты мицелием гриба и спорами, что придает им вид мучнистого налета. Споры способны распространяться во время влажной погоды.
Черные склероции, лишенные медуллы, появляются на растительных остатках после уборки урожая или непосредственно на растениях, если они убраны слишком поздно.
Гриб зимует зимой на поверхности почвы или в почве в виде мицелия или склероций. Весной перезимовавшая форма начинает прорастать и производить конидии. Эти конидии распространяются ветром и дождем и заражают новые ткани растений.
Проращивание возможно при относительной влажности воздуха более 85%. Оптимальная температура для прорастания - 18°C. Грибковый патоген может размножаться многократно.
Варианты управления: Контроль семян может защитить растения от вымокания. Химический контроль затруднен из-за устойчивости патогена. Поэтому предпринимаются попытки естественных стратегий контроля с помощью Trichoderma harzianum.
Условия для моделирования инфекции
B. cinerea инфекции связаны со свободной влагой. Поэтому в открытом грунте определяют влажность листьев, которая является хорошим индикатором.
Bulger et al. (1987) изучали корреляцию периодов увлажнения листьев во время цветения и появления серой плесени на плодах. Они обнаружили, что для более высокого риска заражения при температуре 20°C необходим период увлажнения листьев продолжительностью более 32 часов. При более низких температурах для заражения болезнью периоды увлажнения листьев должны быть более продолжительными.
FieldClimate указывает на риск Botrytis cinerea на основании периодов влажности листьев и температуры в эти периоды.
На графике ниже показана продолжительность влажных листьев в зависимости от фактической температуры, необходимой для Botrytis инфекция. Если риск выше 0, то каждый период увлажнения листьев дольше 4 часов увеличивает риск на такое же отношение.
День с периодом увлажнения листьев короче 4 часов принимается за сухой день и снижает риск на 20% от фактического значения.
Практическое использование модели серой формы: Модель показывает периоды с риском Botrytis инфекция. Этот период риска во время цветения земляники приведет к появлению инфицированных плодов. Чем дольше длится период риска и чем выше риск, тем выше вероятность и количество зараженных плодов. Риск, который можно принять во внимание, зависит от рынка. Производители, которые продают свои фрукты в супермаркет, не будут рисковать, зная, что они не смогут продать зараженные фрукты. В то время как производители, которые продают свои фрукты непосредственно населению, могут пойти на больший риск.
Литература:
- Bulger M.A., Ellis M. A., Madden L. V. (1987): Влияние температуры и влажности на заражение цветков земляники Botrytis cinerea и заболеваемость плодов, происходящих из зараженных цветков. Экология и эпидемиология; том 77 (8): 1225-1230.
- Sosa-Alvarez M., Madden L.V., Ellis M.A. (1995): Влияние температуры и продолжительности увлажнения на споруляцию Botrytis cinerea на остатках листьев земляники. Болезни растений 79, 609-615.
TomCast
TOMCAST (TOMato disease foreCASTing) - это компьютерная модель, основанная на полевых данных, которая пытается предсказать развитие грибковых заболеваний, а именно ранней пятнистости, септориозной листовой пятнистости и антракноза на томатах. Полевые регистраторы данных записывают ежечасные данные о влажности листьев и температуре. Эти данные анализируются в течение 24 часов и могут привести к формированию Значение тяжести заболевания (DSV); по сути, это приращение развития болезни. По мере накопления DSV давление болезни на культуру продолжает нарастать. Когда количество накопленных DSV превышает интервал опрыскивания, рекомендуется применение фунгицида для ослабления давления болезни.
TOMCAST является производной от оригинальной модели F.A.S.T. (Прогнозирование Alternaria solani на томатах), разработанной докторами Мадденом, Пеннипакером и Макнабом в Университете штата Пенсильвания (PSU). Модель PSU F.A.S.T. была модифицирована доктором Питбладо в Риджтаунском колледже в Онтарио в модель TOMCAST, используемую в Университете штата Огайо. DSV - это: Значение тяжести заболевания (DSV) - это единица измерения, присвоенная определенному приросту развития болезни (раннего поражения). Другими словами, DSV - это числовое представление того, насколько быстро или медленно болезнь (раннее поражение) развивается на томатном поле. DSV определяется двумя факторами: влажностью листьев и температурой в часы "влажности листьев". По мере увеличения количества часов влажности листьев и температуры DSV накапливается быстрее. См. таблицу оценки тяжести заболевания ниже.
И наоборот, когда влажных часов для листьев меньше, а температура ниже, DSV накапливаются медленно, если вообще накапливаются. Когда общее количество накопленных DSV превышает установленный предел, называемый интервалом опрыскивания или порогом, рекомендуется опрыскивание фунгицидом для защиты листвы и плодов от развития болезни.
Интервал опрыскивания (определяющий время опрыскивания) может варьироваться в пределах 15-20 DSV. Точное количество DSV, которое должен использовать садовод, обычно предоставляется переработчиком и зависит от качества плодов. Интервал опрыскивания 15 DSV - это консервативное использование системы TOMCAST, то есть вы будете опрыскивать чаще, чем садовод, который использует интервал опрыскивания 19 DSV с системой TOMCAST. Компромисс заключается в количестве опрыскиваний, применяемых в течение сезона, и потенциальной разнице в качестве плодов.
В Мичиганском государственном университете начались исследования по тестированию системы прогнозирования болезней TomCast для использования в борьбе с листовой пятнистостью моркови. TomCast используется в коммерческих целях при выращивании томатов, а недавно была адаптирована для использования в борьбе с болезнями спаржи. Морковь сорта 'Early Gold' была посажена с помощью точной вакуумной сеялки на ферме MSU Muck Soils Research Farm в три ряда на расстоянии 18 дюймов друг от друга на приподнятой грядке длиной 50 футов. Расстояние между грядками моркови составляло 64 дюйма, а расстояние между семенами в ряду - 1 дюйм. Каждая из четырех репликаций эксперимента была расположена в отдельных блоках моркови, состоящих из 36 грядок. Семнадцать грядок для обработки длиной 20 футов были случайным образом расположены в шахматном порядке в каждой повторности. Обработки проводились с помощью ранцевого опрыскивателя CO2, который был откалиброван для подачи 50 галлонов на акр раствора с использованием плоских веерных форсунок 8002. Обработка состояла из необработанного участка и различных графиков применения Bravo Ultrex 82.5WDG (22,4 унции/кг) в сочетании с Quadris 2.08SC (6,2 унции/кг). Химикаты применялись по 10-дневной календарной программе, а также по прогнозам синоптиков TomCast. Три различных порога прогнозирования 15, 20 и 25 DSV были использованы для определения времени применения фунгицидов. Когда суммарные ежедневные значения DSV достигали установленного порога, проводилось опрыскивание. Каждый режим обработки начинался при четырех различных уровнях давления болезни (0%, след, 5% и 10% листовая гниль). Первые обработки были проведены 2 июля, а последняя обработка была проведена 21 сентября. Десять футов каждого центрального ряда опрыскиваемых блоков были помечены перед первым применением и использовались для еженедельной оценки болезней (см. графики ниже). Урожайность была получена с того же десятифутового участка ряда путем ручного сбора моркови, ботвы и взвешивания.
Это указывает на то, что первая обработка моркови должна быть проведена, как только мы сможем обнаружить первые проявления болезни на поле. С этого момента модель TomCast с порогом в 20 DSV, накопленных с момента последнего опрыскивания, работает нормально.
Fieldclimate определяет тяжесть инфекции Alternaria в двух различных моделях:
Источник: Джим Ясински, координатор TOMCAST в штатах Огайо, Индиана и Мичиган
TomCast Alternaria Model
В зависимости от климатических условий часов увлажнения листьев и температуры воздуха определяются значения тяжести инфекции (от 0 - 4, см. таблицу выше).
Рекомендуемое оборудование
Проверьте, какой набор датчиков необходим для мониторинга возможных заболеваний этой культуры.