Girassol modelos de doenças
O míldio
O fungo que causa o míldio nos girassóis é conhecido pelos nomes Plasmopara halstedii ou Plasmopara helianthi. O complexo de agentes patogénicos fúngicos infecta uma vasta gama de géneros da família Asteraceae, incluindo espécies selvagens e cultivadas de Helianthus. A doença está presente em todos os locais onde se cultivam girassóis.
Ciclo de vida
A partir de um único oósporo que germina e dá origem a um zoosporângio, a diferenciação e libertação dos zoósporos são as etapas subsequentes do desenvolvimento. Na presença de água livre, os zoósporos deslocam-se rapidamente para os locais de infecção (raiz, hipocótilo), se disponíveis. Após a encistamento e o alongamento do tubo germinativo (este último termina geralmente num apressório contra uma célula hospedeira), o fungo desenvolve uma estrutura de infecção (estaca de infecção) para penetração directa. Em condições experimentais, foi demonstrado que os tubos germinativos não formam normalmente apressórios na água, mas fazem-no na presença de células hospedeiras (Gray et al., 1985). Após a penetração, o fungo cresce intracelularmente e depois intercelularmente e, uma vez estabelecido num hospedeiro susceptível (compatível), começa a colonizar toda a planta sistemicamente, crescendo de preferência em direcção ao ápice do rebento e, em menor grau, na direcção da raiz. Quando as condições são favoráveis, a esporulação assexuada tem lugar nas folhas afectadas e, ocasionalmente, nos tecidos subterrâneos. Os esporângios completamente desenvolvidos disseminam-se pelo vento e, uma vez que são de curta duração e sensíveis à seca e à exposição directa ao sol, a sua sobrevivência depende da situação climática actual. Os oósporos também são produzidos em partes das plantas infectadas, principalmente nos tecidos da raiz e da parte inferior do caule, enquanto as folhas e as partes superiores das plantas, com excepção das sementes, não têm estes esporos em repouso (Sackston, 1981; Virányi, 1988; Onan e Onogur, 1991). A fase mais susceptível do desenvolvimento do hospedeiro é entre a germinação e a emergência (Meliala et al. 2000).
Sobrevivência e fonte de inóculo
No que respeita à infecção primária, P. halstedii é um agente patogénico transmitido pelo solo. Os seus oósporos servem de inóculo primário para os tecidos subterrâneos de plântulas jovens de girassol. Também pode ser transmitido pelo vento, causando uma infecção secundária das folhas e/ou da inflorescência. Se for este o caso, o fungo pode também ser transmitido pelas sementes: as sementes afectadas transportam micélio e/ou oósporos internamente. Os oósporos desenvolvem-se principalmente nos tecidos da raiz e do caule inferior das plantas com míldio, com ou sem sintomas visíveis e, com os resíduos vegetais da cultura de girassol anterior, chegam ao solo. Os oósporos têm uma vida longa e são capazes de sobreviver durante pelo menos 6-8 anos (Sackston, 1981; Virányi, 1988). Pensa-se geralmente que os oósporos germinam principalmente em condições de humidade. No entanto, até à data, apenas se encontram disponíveis alguns resultados sobre a dinâmica da germinação. Foi demonstrado que um choque de baixa temperatura antes da humidade e a presença de exsudados do hospedeiro libertados pelas raízes melhoram o processo de germinação (Delanoe, 1972). Noutro relatório (Spring & Zipper 2000), não se observaram tais efeitos da temperatura e os oósporos recentemente desenvolvidos germinaram espontaneamente em água num período de 10-30 dias, mas a uma taxa altamente variável (1-17%).
No entanto, a infecção secundária é considerada como um factor importante na propagação da doença em certas regiões sob condições ambientais favoráveis. Para além do facto de a infecção secundária da inflorescência poder dar origem a uma infecção latente das sementes por P. halstedii (Sackston, 1981), a partir de lesões foliares locais, o fungo é capaz de avançar e crescer até ao caule, causando uma infecção sistémica (Spring 2001).
Epidemiologia
A natureza do inóculo (oósporo ou zoósporo), as variáveis meteorológicas (humidade relativa, temperatura), o local de infecção (idade do tecido), bem como a reacção da cultivar são factores que influenciam ou determinam o processo de infecção, a incidência e a gravidade da doença. Os zoósporos, provenientes da esporulação sexual ou assexual, necessitam de água livre para manter a viabilidade e a capacidade de se deslocarem para os locais de infecção. Consequentemente, a precipitação ou a irrigação intensiva será um pré-requisito para o início da infecção. Vários estudos demonstraram que, se houvesse chuva suficiente ou um abastecimento de água correspondente durante as primeiras duas semanas após a sementeira, a incidência de infecção primária a partir do solo aumentava. No entanto, o período de tempo que favorece a infecção é relativamente curto e mesmo os girassóis susceptíveis tornam-se resistentes com a idade (Sackston, 1981). Tourvieille et al. (2008a) constataram que o risco de ataque de míldio parecia maior se houvesse chuvas fortes quando as plântulas de girassol estavam na sua fase mais susceptível, ao passo que chuvas fortes antes da sementeira ou após a emergência não tinham efeito na percentagem de plantas doentes. Göre (2009) verificou que as baixas temperaturas e as chuvas intensas da Primavera provocaram uma perda de rendimento de cerca de 85% e uma diminuição da qualidade da produção de girassol na região de Mármara, no Trace. Para além das condições ambientais, a intensidade da doença pode também ser influenciada pela agressividade da população de agentes patogénicos. Sakr et al. (2009) conseguiram diferenciar as duas estirpes do agente patogénico em termos da sua agressividade com base no período latente da população e na densidade de esporulação.
Aspectos relativos às sementes
P. halstedii foi encontrado em sementes de girassol de plantas naturalmente infectadas, quer como micélio quer como oósporos (Novotel'nova, 1966). Doken (1989) relatou que o micélio só foi encontrado na testa e na camada interna do pericarpo; estava ausente do embrião. Após inoculação artificial, Cohen e Sackston (1973) confirmaram que os gomos de girassol inoculados com P. halstedii ficaram infectadas sistemicamente e produziram sementes infectadas. Foram observados oósporos em sementes de plantas inoculadas e naturalmente infectadas no campo. São conhecidos outros registos de infecção de sementes no Irão (Zad, 1978), Turquia (Döken, 1989) e Alemanha (Spring, 2001). O fungo invade geralmente o ovário e o pericarpo, mas não consegue penetrar no embrião (Novotel'nova, 1966; Döken, 1989). A infecção das sementes ocorre regularmente em plantas infectadas sistemicamente, se estas sobreviverem até à fase de floração. Nestes casos, o desenvolvimento do embrião é frequentemente retardado ou inibido. Além disso, essas plantas são anãs e raramente são colhidas. Podem aumentar a reserva local de oósporos num campo, mas, para a dispersão a longa distância do agente patogénico a partir de sementes, parecem ser menos importantes do que as sementes de plantas sem sintomas infectadas tardiamente (Spring, 2001). Este último tipo de infecção está muito dependente das condições climatéricas durante o processo de floração. Assim, em anos secos, o número de sementes contaminadas pelo agente patogénico é muito baixo e pode não exceder várias em mil, mas pode ser muito maior após um período fresco e húmido em Junho/Julho. Por exemplo, Spring (2001) verificou que cerca de 10% de sementes de um campo na Alemanha estavam contaminadas e Döken (1989), em condições experimentais favoráveis, observou estruturas fúngicas em 28% das sementes examinadas.
Efeito na qualidade das sementes
As sementes de girassol produzidas em plantas afectadas pelo míldio são subdesenvolvidas, incolores ou, raramente, têm um aspecto saudável. Mesmo neste último caso, estas sementes infectadas são de má qualidade; produzem plântulas anormais e a taxa de germinação é baixa (Döken, 1989).
Para mais informações, consulte a página inicial de CABI.
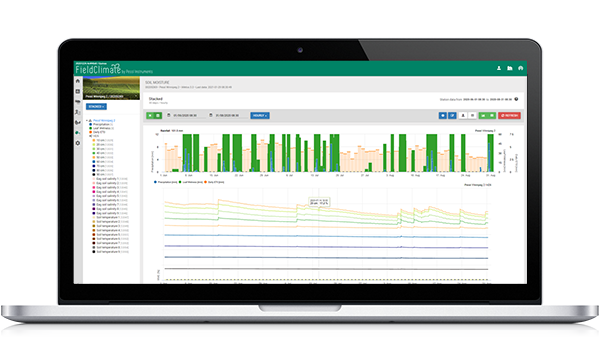
Modelo em FieldClimate
Sensores utilizados: temperatura do solo, precipitação, humidade das folhas, temperatura do ar e humidade relativa.
Começamos a calcular o progresso da infecção quando a temperatura se situa entre 6 e 32°C, com uma temperatura óptima de 18 a 24°C e a temperatura do solo é superior a 10°C. Mais tarde, as condições húmidas são favoráveis à doença (ocorrência de chuva, humidade relativa superior a 70%).
Os makrosporângios formam-se a temperaturas do solo superiores a 10°C e com precipitação (humidade relativa superior a 70%). O reinício ocorre quando a humidade relativa desce abaixo de 50%.
Se os Makrosporangia estiverem completamente desenvolvidos - começam os cálculos para uma infecção do solo ou uma infecção do ar (no gráfico chamado infecção primária) (sob condições de humidade das folhas).
Os esporângios formam-se em condições de humidade (mais de 95% r.h.), na escuridão e a temperaturas superiores a 12°C. O restabelecimento ocorre durante o dia e quando os esporângios não estão completamente desenvolvidos.
Se os esporângios estiverem completamente desenvolvidos, o cálculo da infecção secundária começa em função da temperatura do ar.
No gráfico vê-se no final de Abril um período húmido de longa duração, que levou à formação de macrósporos e a uma infecção do solo (infecção primária da raiz). A infecção do ar (aqui designada por infecção primária) não foi determinada no dia 1 de Maio, mas as condições foram favoráveis, pelo que foi determinada no dia 2 de Maio. Se as plântulas de girassol se encontrarem numa fase sensível nessa altura (acabadas de semear), devem ser tidas em conta medidas de controlo (fungicidas sistémicos profiláticos, principalmente ácidos fosfóricos).
Referências:
- Achbani EH, Lamrhari A, Serrhini MN, Douira A, Tourvieille de Labrouche D, 1999. Avaliação da eficácia dos tratamentos de sementes contra Plasmopara halstedii. Boletim OEPP, 29(4):443-449; 15 ref.
- Achbani EH, Tourvieille D, 1993. Le tournesol au Maroc. Phytoma, 448:30-32.
- Agrawal SC, Gupta RK, Prasad KVV, 1991. Um caso de míldio do girassol em Madhya Pradesh. Journal of Oilseeds Research, 8(1):126
- Albourie JM, Tourvieille J, Labrouhe DTde, 1998. Resistência ao metalaxil em isolados do agente patogénico do girassol Plasmopara halstedii. European Journal of Plant Pathology, 104(3):235-242; 27 ref.
- Albourie JM, Tourvieille J, Tourvieille de Labrouhe D, 1998. Resistência ao metalaxil em isolados franceses de míldio. In: Gulya T, ed. Vear F, ed. Proc. Third Sunflower Downy Mildew Symposium, Fargo, EUA: ISA, 235-242.
- Bán R, Kovács A, Körösi K, Perczel M, Turóczi G, 2014. Primeiro relatório sobre a ocorrência de um novo patótipo, 714, de Plasmopara halstedii (míldio do girassol) na Hungria. Plant Disease, 98(11):1580-1581.
- Bán R, Kovács A, Perczel M, Körösi K, Turóczi G, 2014. Primeiro relatório sobre o aumento da distribuição do patótipo 704 de Plasmopara halstedii na Hungria. Plant Disease, 98(6):844.
- Batinica J, Bes A, Dimic N, Numic R, Radman L, Ristanovic M, Vaclav V, 1973. Contribuição para o conhecimento da fauna nociva e das causas das doenças do girassol na sua área de cultivo na República da Bósnia-Herzegovina. Radovi Poljoprivrednog Fakulteta Univerziteta u Sarajevu, 21/22(24/25):203-210
- Berlese AN, De-Toni JB, 1888. Phycomycetteae. In: Sylloge fungorum, VII:242.
- Bohár G, Vajna L, 1996. Ocorrência de fungos microscópicos patogénicos para Ambrosia artemisifolia var. elatior (L.) Descourt. na Hungria. Növényvédelem, 32:527-528.
- Borovkov AY, McClean PE, 1993. Uma sequência repetida em tandem do genoma de Plasmopara halstedii. Gene, 124(1):127-130
- Borovkova IG, Borovkov AY, McClean PE, Gulya TJ, Vick BA, 1992. Polimorfismos de comprimento de fragmentos de restrição e marcadores RAPD no ADN de Plasmopara halstedii, o fungo do míldio do girassol. Actas da 13ª Conferência Internacional do Girassol, Volume 2, Pisa, Itália, 7-11 de Setembro de 1992, 1420-1425; 9 ref.
- Bouterige S, Robert R, Bouchara JP, Marot-Leblond A, Molinero V, Senet JM, 2000. Produção e caracterização de dois anticorpos monoclonais específicos para Plasmopara halstedii. Applied and Environmental Microbiology, 66(8):3277-3282; 33 ref.
- Bouterige S, Robert S, Marot-Leblond A, Senet JM, 2000. Desenvolvimento de um teste ELISA para detectar antigénios de Plasmopara halstedii em sementes. In: Proc. 15th Int. Conferência sobre o Girassol, Toulouse, França: ISA (F):44-49.
- CABI/EPPO, 1998. Distribution maps of quarantine pests for Europe (editado por Smith, I. M. e Charles, L. M. F.). Wallingford, Reino Unido: CAB International, xviii + 768 pp.
- CABI/EPPO, 2014. Plasmopara halstedii. Mapa de distribuição. Mapas de distribuição de doenças das plantas, n.º de outubro. Wallingford, Reino Unido: CABI, Mapa 286 (Edição 6).
- Choi YJ, Park MJ, Shin HD, 2009. Primeiro relatório coreano de míldio em Coreopsis lanceolata causado por Plasmopara halstedii. Plant Pathology, 58(6):1171.
- CMI, 1988. Mapas de distribuição de doenças de plantas. Mapa n.º 286. Wallingford, Reino Unido: CAB International.
- Cohen Y, Sackson WE, 1974. Infecção de sementes e infecção latente de girassóis por Plasmopara halstedii. Canadian Journal of Botany, 52:231-238.
- Delanoe D, 1972. Biologie et epidemiologie du mildiou du tournesol (Plasmopara helianthi Novot.). CETIOM Informations Techniques, 29:1-49.
- Delen N, Onogur E, Yildiz M, 1985. Níveis de sensibilidade ao metalaxil em seis isolados de Plasmopara helianthi Novot. Journal of Turkish Phytopathology, 14(1):31-36
- Delos M, Penaud A, Lafon S, Walser P, De Guenin MC, Tourvieille J, Molinero V, Tourvieille D, 1997. Le mildiou de tournesol - Une maladie toujours d'actualitT. Phytoma, 495á:15-16.
- Doken MT, 1989. Plasmopara halstedii (Farl.) Berl. et de Toni em sementes de girassol e o papel das sementes infectadas na produção de plantas com sintomas sistémicos. Journal of Phytopathology, 124(1-4):23-26
- Duarte LL, Choi YJ, Barreto RW, 2013. Primeiro relato de míldio causado por Plasmopara halstedii em Gerbera jamesonii no Brasil. Doenças de Plantas, 97(10):1382.
- EPPO, 2014. Base de dados PQR. Paris, França: Organização Europeia e Mediterrânica de Protecção das Plantas.
- Organização Europeia e Mediterrânica de Protecção das Plantas, 2008. Plasmopara halstedii. Boletim OEPP/EPPO, 38(3):343-348.
- Garcia GM, Gulya TJ, 1991. Distribuição das raças de míldio do girassol no Dakota do Norte e no Minnesota. In: Actas do Seminário de Investigação do Girassol de 1991, Fargo, EUA: Associação Nacional do Girassol, 3-5.
- Giresse X, Labrouhe DTDe , Richard-Cervera S, 2007. Twelve polymorphic expressed sequence tags-derived markers for Plasmopara halstedii, the causal agent of sunflower downy mildew, 7:1363-1365.
- Göre ME, 2009. Surtos epidémicos de míldio causados por Plasmopara halstedii em girassol na Trácia, parte da região de Mármara, na Turquia. Patologia Vegetal, 58(2):396.
- Gray AB, Sackston WE, Thauvette L, 1985. O desenvolvimento de estruturas de infecção de Plasmopara halstedii em suspensões de células de girassol. Canadian Journal of Botany, 63(10):1817-1819
- Gray B, Sackston WE, 1983. Estudos de culturas de tecidos e culturas de células de girassol inoculadas com Plasmopara halstedii. Canadian Journal of Plant Pathology, 5:206.
- Greathead DJ, Greathead AH, 1992. Biological control of insect pests by insect parasitoids and predators: the BIOCAT database. Biocontrol News and Information, 13(4):61N-68N.
- Gullino ML, Garibaldi A, 1988. Doenças criptogâmicas das principais plantas de flores cultivadas em vaso. Panorama Floricolo, 13(5):4-8.
- Gulya TJ, 1995. Um método simples para avaliar a resposta radicular de linhas de girassol "resistentes" ao míldio. In: Actas do 17º Seminário de Investigação sobre o Girassol, Fargo, EUA: Associação Nacional do Girassol, 63-66.
- Gulya TJ, 1995. Proposta de um sistema revisto de classificação das raças do míldio do girassol. In: Actas do 17º Seminário de Investigação sobre o Girassol, Fargo, EUA: Associação Nacional do Girassol, 76-78.
- Gulya TJ, 1996. Doenças do girassol nas Grandes Planícies do Norte. In: Actas do 18º Seminário de Investigação sobre o Girassol, Fargo, EUA: Associação Nacional do Girassol, 24-27.
- Gulya TJ, 2000. Resistência ao metalaxil no míldio do girassol e controlo através da genética e de fungicidas alternativos. In: Proc. 15th Int. Conferência sobre o Girassol, Toulouse, França: ISA (G):16-21.
- Gulya TJ, 2007. Distribution of Plasmopara halstedii races from sunflower around the world, 3:121-134.
- Gulya TJ, Rashid KY, Masirevic SM, 1997. Doenças do girassol. In: Schneiter AA, ed. Sunflower Technology and Production. Número 35 da série Agronomia. Wisconsin, EUA: Amer. Soc. Agronomy, 263-379.
- Gulya TJ, Sackston WE, Viranyi F, Masirevic S, Rashid KY, 1991. Novas raças do agente patogénico do míldio do girassol (Plasmopara halstedii) na Europa e na América do Norte e do Sul. Journal of Phytopathology, 132(4):303-311
- Gulya TJ, Tourvieille de Labrouhe D, Masirevic S, Penaud A, Rashid K, Viranyi F, 1998. Proposta de nomenclatura padronizada e identificação de raças de Plasmopara halstedii (míldio do girassol). In: Gulya T, ed. Vear F, ed. Third Sunflower Downy Mildew Symposium (Terceiro Simpósio sobre o míldio do girassol). Fargo, EUA: ISA, 130-136.
- Gulya TJ, Virányi F, Nowell D, Serrhini MN, Arouay K, 1996. Novas raças de míldio do girassol da Europa e de África. In: Actas do 18º Seminário de Investigação sobre o Girassol, Fargo, EUA: Associação Nacional do Girassol, 181-184.
- Gulya TJ, Woods DM, Bell R, Mancl MK, 1991. Doenças do girassol na Califórnia. Plant Disease, 75(6):572-574
- Hall G, 1989. Unusual or interesting records of plant pathogenic Oomycetes. Patologia Vegetal, 38(4):604-611
- Harmon PF, Dunkle LD, Latin R, 2003. Um método rápido baseado em PCR para a detecção de Magnaporthe oryzae em azevém perene infectado. Plant Disease, 87(9):1072-1076.
- Heller A, Rozynek B, Spring O, 1997. Razões citológicas e fisiológicas para o tipo de infecção latente em girassol causada por Plasmopara halstedii. Journal of Phytopathology, 145(10):441-445; 15 ref.
- Henning AA, Franca Neto JB, 1985. Raça fisiológica e fontes de resistência ao míldio (Plasmopara halstedii (Farl.) Berlese et de Toni) no Brasil. In: Anais da 11ª Conferência Internacional do Girassol, Mar del Plata, Argentina: Volume 2, 407-409.
- Hong CX, 2006. Míldio de Rudbeckia fulgida cv. Goldsturm por Plasmopara halstedii na Virgínia. Plant Disease, 90(11):1461. HTTP://www.apsnet.org
- Hua Z, Ma G, 1996. Uma revisão da investigação sobre doenças do girassol na China. In: Actas da 14ª Conferência Internacional sobre o Girassol, Pequim, China: ISC-LAAS, 754-759.
- Intelmann F, Spring O, 2002. Análise do ADN total por minissatélites e primers de repetição de sequência simples para utilização em estudos populacionais em Plasmopara halstedii. Canadian Journal of Microbiology, 48(6):555-559; 25 ref.
- IPPC, 2010. Primeira descoberta no Reino Unido de Plasmopara halstedii. Relatório Oficial sobre Pragas da IPPC, n.º GBR-23/1. Roma, Itália: FAO.
- Jardine DJ, Gulya TJ, 1994. Primeiro relato de míldio em girassóis causado por Plasmopara halstedii no Kansas. Plant Disease, 78(2):208
- Kinga R, Bíró J, Kovács A, Mihalovics M, Nébli L, Piszker Z, Treitz M, Végh B, Csikász T, 2011. Aparecimento de uma nova raça de míldio do girassol na região sudeste da Grande Planície Húngara. (Újabb napraforgó-peronoszpóra rassz megjelenése Magyarországon, a Dél-kelet Alföldi régióban.) Növényvédelem, 47(7):279-286.
- Kola K, 1980. Estudo comparativo de variedades de girassol para avaliar a sua resistência a doenças fúngicas na zona de Zadrima. Buletini i Shkencave Bujqesore, 19:87-94.
- Komjáti H, Walcz I, Virányi F, Zipper R, Thines M, Spring O, 2007. Características de um isolado de Plasmopara angustiterminalis de Xanthium strumarium. European Journal of Plant Pathology, 119(4):421-428.
- Kucmierz J, 1976. Plasmopara helianthi Novot., uma nova espécie de fungo para a Polónia. Fragmenta Floristica et Geobotanica, 22(3):373-375
- Labrouhe DDe , Walser P, Serre F, Roche S, Vear F, 2008. Relações entre a precipitação da Primavera e a infecção do girassol por Plasmopara halstedii (míldio). Córdova, Espanha, 8-12 de Junho de 2008. In: Actas da 17ª Conferência Internacional do Girassol Vol ed. por Velasco, L.. Saville, Espanha: Conselho de Agricultura e Pescas, 97-102.
- Lafon S, Penaud A, Walser P, De Guenin M-Ch, Molinero V, Mestres R, Tourvieille D, 1996. Le mildiou du tournesol toujour sou surveillance. Phytoma, 484:35-36.
- Leite RMVBde C, Henning AA, Rodrigues SR, Oliveira MFde, 2007. Detecção e variabilidade de Plasmopara halstedii no Brasil e avaliação da resistência de genótipos de girassol ao míldio. Summa Phytopathologica, 33(4):335-340.
- Leppik EE, 1966. Origem e especialização do complexo Plasmopara halstedii nas Compositae. Boletim de Protecção das Plantas da FAO, 14:72-76.
- Liese AR, Gotlieb AR, Sackston WE, 1982. Utilização do ensaio de imunoabsorção enzimática (ELISA) para a detecção do míldio (Plasmopara halstedii) no girassol. In: Actas da 10ª Conferência Internacional sobre o Girassol, Surfers Paradise, Austrália, 173-175.
- Ljubich A, Gulya TJ, 1988. Infecção sistémica do míldio limitada ao cotilédone. In: Actas do Workshop de Investigação do Girassol de 1988, Bismarck, EUA: Associação Nacional do Girassol, 9.
- Masirevic S, 1992. Raças de míldio (Plasmopara halstedii) do girassol presentes na nossa região e no mundo. Zbornik Radova, 20:405-408.
- Mayee CD, Patil MA, 1987. O míldio do girassol na Índia. Tropical Pest Management, 33(1):81-82
- Melero-Vara JM, Garcia-Baudin C, Lopez-Herrera CJ, Jimenez-Diaz RM, 1982. Controlo do míldio do girassol com metalaxil. Doenças das Plantas, 66(2):132-135
- Melero-Vara JM, Molinero Luiz L, Merino A, Dominguez J, 1996. Razas de Plasmopara halstedii presentes en Espana y evaluacion de susceptibilidad en hibridos comerciales. In: Actas do ISA Symposium I, Disease Tolerance in Sunflower, Beijing, China: Associação Internacional do Girassol, 7-13.
- Meliala C, Vear F, Labrouhe DTde, 2000. Relação entre a data de infecção do míldio do girassol (Plasmopara halstedii) e o desenvolvimento dos sintomas. Helia, 23(32):35-44.
- Molinero-Ruiz ML, Domfnguez J, Melero-Vara JM, 2002. Raças de isolados de Plasmopara halstedii de Espanha e estudos sobre a sua virulência. Plant Disease, 86(7):736-740; 28 ref.
- Moses GJ, 1989. Nova ocorrência de míldio do girassol em Andhra Pradesh. Jornal de Investigação da APAU, 17(1):73
- Nandeeshkumar P, Ramachandra K, Prakash HS, Niranjana SR, Shetty H, 2008. Indução de resistência contra o míldio no girassol por rizobactérias, 3(4):255-262.
- Nandeeshkumar P, Sarosh BR, Kini KR, Prakash HS, Shetty HS, 2009. Elicitação de proteínas relacionadas com a resistência e a defesa pelo ácido beta-amino-butírico no girassol contra o agente patogénico do míldio Plasmopara halstedii. Archives of Phytopathology and Plant Protection, 42(11):1020-1032.
- Nandeeshkumar P, Sudisha J, Ramachandra KK, Prakash HS, Niranjana SR, Shekar SH, 2008. Resistência induzida por quitosano ao míldio do girassol causado por Plasmopara halstedii. PMPP Physiological and Molecular Plant Pathology, 72(4/6):188-194.
- Nikolov G, 1981. Apron 35 SD, uma preparação eficaz no controlo do míldio do girassol. Rastitelna Zashchita, 29(3):40-41
- Nishimura M, 1922. Estudos sobre Plasmopara halstedii. J. Coll. Agric, 3(XI):185-210.
- Novotel'nova NS, 1966. Míldio do girassol. Moscovo, URSS: Nauka.
- Onan E, Onogur E, 1989. O míldio do girassol (Plasmopara helianthi Novot.). Ege Universitesi Ziraat Fakultesi Dergisi, 26(1):271-286
- Onan E, Onogur E, 1991. Estudos sobre a relação entre o hospedeiro e o agente patogénico do míldio do girassol (Plasmopara helianthi Novot.). Journal of Turkish Phytopathology, 20(1):1-10
- Oros G, Viranyi F, 1987. Avaliação em estufa de fungicidas para o controlo do míldio do girassol (Plasmopara halstedii). Anais de Biologia Aplicada, 110(1):53-63
- Patil MA, Mayee CD, 1988. Investigações sobre o míldio do girassol na Índia. In: Actas da 12ª Conferência Internacional sobre o Girassol, Novi Sad, Jugoslávia: 2:42.
- Patil MA, Phad HB, Ramtirthkar MS, 1993. Ocorrência e distribuição do míldio do girassol recentemente introduzido em Maharashtra. Jornal das Universidades Agrícolas de Maharashtra, 18(1):129-130
- Rahmani Y, Madjidieh-Ghassemi S, 1975. Investigação sobre a resistência relativa de diferentes variedades e linhas consanguíneas de girassol ao míldio Plasmopara helianthi Novt. em estufa e no ensaio experimental de campo, 1973. Iranian Journal of Plant Pathology, 11(3/4):96-104; 42-45
- Rashid KY, 1991. O míldio do girassol em Manitoba. In: Actas do Seminário de Investigação sobre o Girassol, Fargo, EUA: Associação Nacional do Girassol, 12.
- Rashid KY, 1993. Incidência e virulência de Plasmopara halstedii em girassol no oeste do Canadá durante 1988-1991. Canadian Journal of Plant Pathology, 15(3):206-210
- Rivera Y, Rane K, Crouch JA, 2014. Primeiro relatório de downy mildw causado por Plasmopara halstedii em Susan de olhos pretos (Rudbeckia fulgida cv. 'Goldsturm') em Maryland. Plant Disease, 98(7):1005-1006.
- Roeckel-Drevet P, Coelho V, Tourvieille J, Nicolas P, Labrouhe DTde, 1997. Falta de variabilidade genética em raças francesas identificadas de Plasmopara halstedii, a causa do míldio no girassol Helianthus annuus. Canadian Journal of Microbiology, 43(3):260-263; 23 ref.
- Roeckel-Drevet P, Tourvieille J, Drevet JR, Says-Lesage V, Nicolas P, Labrouhe DTde, 1999. Desenvolvimento de um teste de diagnóstico de reacção em cadeia da polimerase para a detecção do agente patogénico biotrófico Plasmopara halstedii no girassol. Canadian Journal of Microbiology, 45(9):797-803; 27 ref.
- Rozynek B, Spring O, 2000. Patótipos do míldio do girassol nas regiões do sul da Alemanha. Helia, 23(32):27-34; 18 ref.
- Rozynek B, Spring O, 2001. Inoculação de discos de folhas, um teste rápido e preciso para o rastreio da tolerância ao metalaxil no míldio do girassol. Journal of Phytopathology, 149(6):309-312; 17 ref.
- Ruiz MLM, Dominguez J, Vara JMM, Gulya TJ, 2000. Tolerância ao metalaxil em isolados espanhóis de Plasmopara halstedii. In: Proc. 15th Int. Conferência sobre o Girassol, Toulouse, França: ISA, (G):11-15.
- Sackston WE, 1981. O míldio do girassol. In: Spencer DE, ed. The Downy Mildews. Londres, Reino Unido: Academic Press, 545-575.
- Sackston WE, 1992. On a treadmill: breeding sunflowers for resistance to disease. Annual Review of Phytopathology, 30:529-551; 123 ref.
- Sackston WE, Anas O, Paulitz T, 1992. Controlo biológico do míldio do girassol. In: Abstracts of the American Phytopathological Society North-East Division Meeting, Portland, EUA: 33.
- Sakr N, Ducher M, Tourvieille J, Walser P, Vear F, Labrouhe DTde, 2009. Um método para medir a agressividade de Plasmopara halstedii (míldio do girassol). Journal of Phytopathology, 157(2):133-136.
- Says-Lesage V, Meliala C, Nicolas P, Roeckel-Drevet P, Tourvieille de Labrouhe D, Archambault D, Billaud F, 2001. Teste molecular para detectar a presença de míldio (Plasmopara halstedii) em sementes de girassol. OCL - Ole^acute~agineux, Corps Gras, Lipides, 8(3):258-260; 5 ref.
- Schuck E, Jobim CIP, 1988. Doenças do girassol (Helianthus annuus L.) em Viamão e Santo Augusto, Rio Grande do Sul. Agronomia Sulriograndense, 24(2):221-232; 12 ref.
- Simay EI, 1993. Incidência de microfungos raros observados nas zonas de Budateteny e Cinkota em Budapeste. Mikologiai Kozlemenyek, 32(1-2):81-89
- Skoric D, 1994. Melhoramento do girassol para resistência a doenças dominantes. In: Actas da Secção de Culturas Oleaginosas e Proteaginosas da EUCARPIA, Simpósio sobre Melhoramento de Culturas Oleaginosas e Proteaginosas, Albena, Bulgária, 30-48.
- Spring O, 2000. Reprodução sexual homotálica em Plasmopara halstedii, o míldio do girassol. Helia, 23(32):19-26; 13 ref.
- Spring O, 2001. Infecções não sistémicas do girassol com Plasmopara halstedii e o seu papel putativo na distribuição do agente patogénico. Journal of Plant Diseases and Protection, 108:329-336.
- Spring O, Benz A, Faust V, 1991. Impacto da infecção pelo míldio (Plasmopara halstedii) no desenvolvimento e metabolismo do girassol. Zeitschrift fur Pflanzenkrankheiten und Pflanzenschutz, 98(6):597-604
- Spring O, Haas K, 2002. A composição em ácidos gordos de Plasmopara halstedii e o seu significado taxonómico. European Journal of Plant Pathology, 108(3):263-267; 20 ref.
- Spring O, Miltner F, Gulya TJ, 1994. Novas raças de míldio do girassol (Plasmopara halstedii) na Alemanha. Journal of Phytopathology, 142(3-4):241-244
- Spring O, Rozynek B, Zipper R, 1998. Infecções de esporos únicos com míldio do girassol. Journal of Phytopathology, 146(11/12):577-579; 7 ref.
- Spring O, Zipper R, 2000. Isolamento de oósporos do míldio do girassol, Plasmopara halstedii, e estudos microscópicos sobre a germinação de oósporos. Journal of Phytopathology, 148(4):227-231; 15 ref.
- Spring O, Zipper R, 2006. Evidência de recombinação genética assexuada no míldio do girassol, Plasmopara halstedii. Mycological Research, 110(6):657-663.
- Sudisha J, Niranjana SR, Sukanya SL, Girijamba R, Devi NL, Shetty HS, 2010. Eficácia relativa das formulações de estrobilurina no controlo do míldio do girassol. Journal of Pest Science, 83(4):461-470.
- Thanassoulopoulos CC, Mappas CB, 1992. Primeira notificação de míldio do girassol na Grécia. Doenças das Plantas, 76(5):539
- Tourvieille J, Roeckel-Drevet P, Nicolas P, Tourvieille de Labrouhe D, 1996. Caracterização das raças de míldio do girassol (Plasmopara halstedii) por RAPD. In: Actas da 14ª Conferência Internacional do Girassol, Pequim, 781-785.
- Vida R, 1966. O míldio do girassol: um regresso significativo. Növényvédelem, 32:533-535.
- Virányi F, 1984. Investigação recente sobre o míldio do girassol na Hungria. Helia, 7:35-38.
- Virányi F, 1988. Factores que afectam a formação de oósporos em Plasmopara halstedii. In: Actas da 12ª Conferência Internacional do Girassol, Novi Sad, Jugoslávia, Vol, 2:32.
- Viranyi F, Gulya TJ, 1995. Variação inter-isolada para virulência em Plasmopara halstedii (míldio do girassol) da Hungria. Patologia Vegetal, 44(4):619-624
- Virányi F, Gulya TJ, 1995a. Variação patogénica em Plasmopara halstedii. In: Resumos de trabalhos do 1º Simpósio Internacional sobre Fungos do míldio, Gwatt, Suíça: Federação das Sociedades Europeias de Microbiologia, Ciba-Geigy.
- Virányi F, Gulya TJ, 1996. Expressão da resistência no patossistema Plasmopara halstedii - girassol. In: Actas do ISA Symposium I, Disease Tolerance in Sunflower, Beijing, China: Associação Internacional do Girassol, 14-21.
- Viranyi F, Sziraki I, 1986. Estabelecimento de culturas duplas de Plasmopara halstedii e girassol. Transactions of the British Mycological Society, 87(2):323-325
- Viranyi F, Walcz I, 2000. Estudos populacionais sobre Plasmopara halstedii: especificidade do hospedeiro e tolerância aos fungos. In: Actas da 15ª Conferência Internacional do Girassol, Toulouse, França: ISA, (I):55-60.
- Walcz I, Bogßr K, Virßnyi F, 2000. Estudo sobre um isolado de Ambrosia de Plasmopara halstedii. Helia, 23(33):19-24; 8 ref.
- Yang SM, Wei SE, 1988. Doenças do girassol cultivado na província de Liaoning, República Popular da China. Doenças das Plantas, 72(6):546
- Yorinori FT, Henning AA, Ferreira LP, Homechin M, 1985. Doenças do girassol no Brasil. In: Anais da 11ª Conferência Internacional do Girassol, Mar del Plata, Brasil, 459.
- Zad J, 1978. Transmissão do míldio do girassol através da semente. Iranian Journal of Plant Pathology, 14(1/4):1-2; 1-7
- Zazzerini A, 1978. A propagação de Plasmopara helianthi Novot em relação à inclinação. Phytopathologia Mediterranea, 17(3):153-156
- Zazzerini A, 1983. Doença de Peronospora (Plasmopara helianthi Novot.) do girassol: raças fisiológicas do parasita e métodos de identificação do material infectado. Informatore Fitopatologico, 33(2):117-119
- Zimmer DE, 1974. Especialização fisiológica entre raças de Plasmopara halstedii na América e na Europa. Phytopathology, 64(11):1465-1467
Apodrecimento da Esclerotínia
A germinação carpogénica da esclerótia é estimulada por períodos de humidade contínua do solo. Formam-se apotecias na superfície do solo a partir das quais os ascósporos são libertados para o ar. A infecção da maioria das espécies de culturas está principalmente associada aos ascósporos, mas a infecção directa de tecido vegetal saudável e intacto dos ascósporos germinativos não ocorre normalmente. Em vez disso, a infecção do tecido foliar e do caule de plantas saudáveis resulta apenas quando os ascósporos em germinação colonizam tecidos mortos ou senescentes, geralmente partes florais como pétalas abscisas, antes da formação de estruturas infecciosas e da penetração. A germinação miceliogénica de esclerócios na superfície do solo também pode resultar na colonização de matéria orgânica morta com subsequente infecção de plantas vivas adjacentes. No entanto, em algumas culturas, por exemplo, a germinação miceliogénica de esclerócio do girassol pode iniciar directamente o processo de infecção das raízes e do caule basal, resultando em murchidão. O estímulo para a germinação e infecção miceliogénica do girassol não é conhecido mas depende provavelmente de sinais nutricionais na rizosfera derivados de plantas hospedeiras.
O processo de infecção
A infecção de tecido saudável depende da formação de um appressorium, que pode ser simples ou complexo em estrutura, dependendo da superfície do hospedeiro. Na maioria dos casos, a penetração é directamente através da cutícula e não através do estômago. Os appressórios desenvolvem-se a partir de ramificações dicotómicas terminais de hifas que crescem na superfície do hospedeiro e consistem numa almofada de hifas largas, multi-sepatas e curtas que são orientadas perpendicularmente à superfície do hospedeiro à qual estão ligadas por mucilagem. As appressorias complexas são frequentemente referidas como almofadas de infecção. Embora os trabalhadores anteriores considerassem a penetração da cutícula como um processo puramente mecânico, há fortes indícios de estudos ultra-estruturais de que a digestão enzimática da cutícula também desempenha um papel no processo de penetração. Pouco se sabe sobre S. sclerotiorum cutinases, no entanto, o genoma codifica pelo menos quatro enzimas cutinase-like (Hegedus inédito). Uma grande vesícula, formada na ponta do appressorium antes da penetração, parece ser libertada para a cutícula hospedeira durante a penetração. Após a penetração da cutícula, forma-se uma vesícula subcuticulosa a partir da qual as grandes hifas saem em leque e dissolvem a parede subcuticulosa da epiderme.
Infecção por degradação enzimática das células epidémicas: O ácido oxálico actua em conjunto com enzimas de degradação da parede celular, como a poligalacturonase (PG), para provocar a destruição do tecido hospedeiro, criando um ambiente propício ao ataque da PG à pectina na lamela média. Este, por sua vez, liberta derivados de baixo peso molecular que induzem a expressão de genes PG adicionais. De facto, a actividade global dos PG é induzida pela pectina ou por monossacáridos derivados da pectina, como o ácido galacturónico, e é reprimida pela presença de glucose. A análise dos padrões de expressão dos genes Sspg individuais revelou que a interacção entre as PGs e com o hospedeiro durante as várias fases da infecção é finamente coordenada. (Dwayne D. Hegedus *, S. Roger Rimmer: Sclerotinia sclerotiorum: Quando "ser ou não ser" um agente patogénico? FEMS Microbiology Letters 251 (2005) 177-184)
Procura de Condições Climáticas para Infecção de S. sclerotiorum deve ter em consideração a formação de apotécios, a esporulação, a infecção directa por apotécios (mesmo que não seja muito frequente) e a infecção a partir de micélios estabelecidos por degradação encismática das células epidémicas. Formação e esporulação de apotecia ocorre se uma chuva de mais de 8 mm for seguida por um período de elevada humidade relativa com duração superior a 20 horas à temperatura óptima de 21°C a 26°C.
Infecção directa por Apothecia pode ser esperada após um período de humidade foliar seguido de 16 horas de humidade relativa superior à do 90% sob condições óptimas de 21°C a 26°C ("infecção por apressórios"). Enquanto que crescimento saprofítico seguido de degradação encimática das células epidérmicas ("infecção hidrolítica") pode ser esperada sob uma humidade relativa ligeiramente mais baixa de 80% durante um período de 24 horas em condições óptimas de 21°C a 26°C.
Literatura:
- Lumsden, R.D. (1976) Enzimas pectolíticas de Sclerotinia sclerotiorum e a sua localização em feijão infectado. Pode. J. Bot. 54,2630–2641.
- Tariq, V.N. e Jeffries, P. (1984) Appressorium formation by Sclerotinia sclerotiorum: scanning electron microscopy. Trans. Brit. Mycol. Soc. 82, 645-651.
- Boyle, C. (1921) Estudos sobre a fisiologia do parasitismo. VI. Infecção por Sclerotinia libertiana. Ann. Bot. 35, 337–347.
- Abawi, G.S., Polach, F.J. e Molin, W.T. (1975) Infecção de feijão por ascósporos de Whetzelinia sclerotiorum. Fitopatologia 65, 673-678.
- Tariq, V.N. e Jeffries, P. (1986) Ultrastrutura de penetração de Phaseolus spp. por Sclerotinia sclerotiorum. Can. J. Bot. 64, 2909– 2915.
- Marciano, P., Di Lenna, P. e Magro, P. (1983) Ácido oxálico, enzimas degradantes da parede celular e pH na patogénese e o seu significado na virulência de dois isolados de Sclerotinia sclerotiorum no girassol. Fisiol. Plant Pathol. 22, 339–345.
- Fraissinet-Tachet, L. e Fevre, M. (1996) Regulation by galacturonic acid of ppectinolytic enzyme production by Sclerotinia sclerotiorum. Moeda. Microbiol. 33, 49–53.
Utilização prática do modelo Sclerotinia
O Modelo de Infecção da Perna Branca mostra os períodos em que a formação de apotecia é esperada. Se estes períodos são coinitentes com o período de floração da semente de colza ou canola, temos de esperar S. sclerotiorum infecções durante um período húmido. Os esporos formados na apotecia podem estar disponíveis durante um a vários dias. A oportunidade das infecções é indicada pelo cálculo do progresso da infecção por infecções directas ou indirectas por appressoria ou por degradação da parede celular encímica. Se a linha de progressão da infecção atingir 100%, é necessário assumir uma infecção. Estas infecções devem ser cobertas preventivas ou fungicidas com uma acção curativa contra S. sclerotiorum tem de ser utilizado.
Bolor cinzento
Molde Cinzento (Botrytis cinerea) é uma doença devastadora com elevado impacto económico na produção. B. cinerea infecta as flores e os frutos perto da maturidade.
O patogéneo fúngico tem uma gama de hospedeiros muito ampla, infectando mais de 200 hospedeiros diferentes. O crescimento fúngico existe de forma saprófita e parasitária.
Sintomas
Nos girassóis, o patogénico causa um bolor cinzento na cabeça e no caule. Enquanto isso, as folhas começam a secar. Estes sintomas ocorrem durante o amadurecimento dos grãos na cabeça. Observam-se manchas castanhas na parte de trás. Estas manchas são cobertas pelo micélio fúngico e esporos, dando a aparência de um pó. Os esporos podem ser espalhados durante condições de tempo húmido.
Os esclerócios negros privados de medula aparecem nos detritos da cultura após a colheita ou directamente sobre as plantas, se forem colhidos demasiado tarde.
O fungo sobrepõe-se durante o Inverno na superfície do solo ou no solo como micélio ou esclerócio. Na Primavera, a forma de sobre-internação começa a germinar e a produzir conídios. Estas conidias são espalhadas pelo vento e pela chuva e infectam novos tecidos vegetais.
A germinação é possível com humidade relativa superior a 85%. A temperatura de germinação óptima é de 18°C. O agente patogénico fúngico pode reproduzir-se vezes sem conta.
Opções de controlo: O controlo de sementes pode proteger as plantas da humidificação. O controlo químico é difícil devido à resistência do agente patogénico. Por conseguinte, são feitas tentativas de estratégias naturais de controlo com Trichoderma harzianum.
Condições para a infecção por modelagem
B. cinerea As infecções estão relacionadas com a humidade livre. Por conseguinte, na produção em campo aberto, determina-se a humidade das folhas, que é um bom indicador.
Bulger et al. (1987) estudaram a correlação dos períodos de humidade das folhas durante a floração e a ocorrência de bolor cinzento nos frutos. Verificaram que para um risco mais elevado de infecção a 20°C é necessário um período de tempo superior a 32 horas de molhamento das folhas. A temperaturas mais baixas, os períodos de humidade das folhas têm de ser mais longos para a infecção da doença.
FieldClimate indica o risco de Botrytis cinerea com base nos períodos de humidade das folhas e na temperatura durante esses períodos.
O gráfico abaixo mostra a duração das folhas molhadas em dependência da temperatura real necessária para um Botrytis infecção. Se o risco for superior a 0 cada período de molhamento das folhas superior a 4 horas aumentará o risco pela mesma relação.
Assume-se que um dia com um período de humidade das folhas inferior a 4 horas é um dia seco e reduzirá o risco até 20% do valor real.
Utilização prática do Modelo do Molde Cinzento: O modelo indica períodos com um risco de Botrytis infecção. Este período de risco durante a floração do morango levará a frutos infectados. Quanto maior for a duração do período de risco e quanto maior for o risco maior será a probabilidade e o número de frutos infectados. O risco, que pode ser tomado em consideração, depende do mercado. Os produtores, que estão a vender os seus frutos ao supermercado, não correrão qualquer risco, sabendo que não são capazes de vender frutos infectados. Enquanto os cultivadores, que vendem os seus frutos directamente às pessoas, são capazes de assumir um risco mais elevado.
Literatura:
- Bulger M.A., Ellis M. A., Madden L. V. (1987): Influence of temperature and wetness duration on infection of strawberry flowers by Botrytis cinerea and disease incidence of fruit originating from infected flowers. Ecologia e Epidemiologia; Vol 77 (8): 1225-1230.
- Sosa-Alvarez M., Madden L.V., Ellis M.A. (1995): Efeitos da temperatura e da duração da humidade na esporulação de Botrytis cinerea nos resíduos de folhas de morango. Doença das plantas 79, 609-615.
TomCast
O TOMCAST (TOMato disease foreCASTing) é um modelo informático baseado em dados de campo que tenta prever o desenvolvimento de doenças fúngicas, nomeadamente o míldio, a septoriose e a antracnose do tomateiro. Os registadores de dados colocados no campo registam de hora a hora a humidade e a temperatura das folhas. Estes dados foram analisados durante um período de 24 horas e podem resultar na formação de um Valor de gravidade da doença (DSV)O DSV é essencialmente um incremento do desenvolvimento da doença. À medida que os DSV se acumulam, a pressão da doença continua a aumentar na cultura. Quando o número de DSV acumulados excede o intervalo de pulverização, recomenda-se uma aplicação de fungicida para aliviar a pressão da doença.
O TOMCAST é derivado do modelo original F.A.S.T. (Forecasting Alternaria solani on Tomatoes) desenvolvido pelos Drs. Madden, Pennypacker e MacNab? na Pennsylvania State University (PSU). O modelo F.A.S.T. da PSU foi posteriormente modificado pelo Dr. Pitblado no Ridgetown College, em Ontário, para o que agora reconhecemos como o modelo TOMCAST utilizado pela Ohio State University Extension. DSV são: Um valor de gravidade da doença (DSV) é a unidade de medida dada a um incremento específico do desenvolvimento da doença (míldio). Por outras palavras, um DSV é uma representação numérica da rapidez ou lentidão com que a doença (míldio) se está a acumular num campo de tomate. O VDS é determinado por dois factores: a humidade das folhas e a temperatura durante as horas de "humidade das folhas". À medida que o número de horas de humidade das folhas e a temperatura aumentam, o DSV acumula-se a um ritmo mais rápido. Ver o gráfico do valor de gravidade da doença abaixo.
Inversamente, quando há menos horas húmidas de folhas e a temperatura é mais baixa, o DSV acumula-se lentamente, se é que se acumula. Quando o número total de DSV acumulados excede um limite predefinido, chamado intervalo ou limiar de pulverização, recomenda-se um spray fungicida para proteger a folhagem e a fruta do desenvolvimento de doenças.
O intervalo de pulverização (que determina quando se deve pulverizar) pode variar entre 15-20 DSV. O DSV exacto que um produtor deve utilizar é normalmente fornecido pelo processador e depende da qualidade da fruta e da utilização final dos tomates. Seguindo um intervalo de 15 DSV spray é uma utilização conservadora do sistema TOMCAST, o que significa que pulverizará mais frequentemente do que um cultivador que utiliza um intervalo de 19 DSV spray com o sistema TOMCAST. A troca está no número de pulverizações aplicadas durante a estação e no potencial de diferença na qualidade da fruta.
Foram iniciados estudos na Michigan Staate University para testar o sistema de previsão de doenças, TomCast, para utilização na gestão do míldio foliar da cenoura. O TomCast tem sido utilizado comercialmente na produção de tomate e foi recentemente adaptado para utilização na gestão de doenças dos espargos. As cenouras de processamento 'Early Gold' foram plantadas com uma semeadora de precisão a vácuo na MSU Muck Soils Research Farm em três fileiras com 18 polegadas de distância em um canteiro elevado de 50 pés de comprimento. Os canteiros de cenoura foram espaçados em centros de 64 polegadas e o espaçamento entre sementes na linha foi de 1 polegada. Cada uma das quatro repetições da experiência estava localizada em blocos separados de cenouras que consistiam em 36 canteiros. Dezassete camas de tratamento com 6 metros de comprimento foram colocadas aleatoriamente num padrão de tabuleiro de xadrez em cada replicação. Os tratamentos foram aplicados com um pulverizador de mochila de CO2 que foi calibrado para fornecer 50 galões por acre de solução de pulverização usando bicos de leque plano 8002. Os tratamentos consistiram de uma aplicação sem tratamento e de diferentes aplicações de Bravo Ultrex 82.5WDG (22.4 oz/A) alternadas com Quadris 2.08SC (6.2 fl oz/A). O programa químico foi aplicado num programa de calendário de 10 dias, bem como quando previsto pelo TomCast. Foram utilizados três limiares de previsão diferentes de 15, 20 e 25 VDS para calendarizar as aplicações de fungicidas. Quando os valores diários acumulados de VSD atingiam o limite determinado, era efectuada uma pulverização. Cada regime de tratamento foi iniciado em quatro níveis diferentes de pressão da doença (0%, traço, 5% e 10%). Os primeiros tratamentos foram aplicados a 2 de Julho e a última aplicação de qualquer tratamento foi feita a 21 de Setembro. Dez pés de cada linha central dos blocos de pulverização foram marcados antes da primeira aplicação e foram usados para avaliações semanais de doenças (ver gráficos, abaixo). Os rendimentos foram obtidos na mesma secção de três metros de linha, colhendo manualmente as cenouras e as copas e pesando-as.
Isto indica que o primeiro tratamento da cenoura deve ser efectuado logo que se detecte a primeira incidência da doença no campo. A partir de agora, o modelo TomCast funcionou bem com um limiar de 20 DSV acumulados desde a última pulverização.
FieldClimate determina a gravidade de uma Infecção Alternaria em dois modelos diferentes:
Fonte: Jim Jasinski, Coordenador de TOMCAST PARA OHIO, INDIANA, & MICHIGAN
Modelo TomCast Alternaria
Em função das condições climáticas de horas de humidade das folhas e da temperatura do ar, são determinados os valores de gravidade de uma infecção (de 0 a 4, ver quadro acima).
Equipamento recomendado
Verificar que conjunto de sensores é necessário para monitorizar as potenciais doenças desta cultura.