Azeitona modelos de doenças
A azeitona (Olea europaea L.), cultivada em mais de 8 milhões de hectares, é a segunda cultura mais importante de árvores oleaginosas a nível mundial depois da palma e o seu cultivo está tradicionalmente concentrado na zona mediterrânica. A produção total de azeite para a época 2006-2007 foi de 2.859.500 toneladas (dados do Conselho Oleícola Internacional (COI)). Os países do Sul da Europa representam cerca de 74,9% da produção mundial, sendo a Espanha o principal produtor (38,7%), seguida da Itália (21%) e da Grécia (12,9%). Outros importantes produtores de azeite são a Turquia, Tunísia e Síria (17.1%), assim como a Jordânia, Marrocos e Argélia.
A mancha do pavão é também conhecida como sarna e mancha foliar da oliveira e está disseminada em todas as principais regiões oleícolas do mundo (Obanor et al. 2005). Os sintomas têm sido encontrados principalmente nas folhas e aparecem como manchas verdes escuras a negras rodeadas por uma auréola amarela semelhante à mancha ocular nas penas do pavão; daí o nome mancha de pavão (Graniti 1993; Shabi et al. 1994). A mancha de pavão é considerada a doença mais importante do olival em Espanha (Trapero e Blanco, 2008). As perdas de colheitas resultam principalmente da desfoliação das árvores infectadas, do fraco crescimento e dieback dos ramos desfolhados e da redução da produção de frutos (Graniti 1993; Viruega et al. 1997). Foi relatado que a desfoliação pesada causou um atraso na maturação e uma diminuição da produção de petróleo em Itália (Graniti 1993) e na Nova Zelândia (MacDonald et al. 2000).
Sarna de Oliveira
Sarna da azeitona ou mancha foliar, causada pelo fungo Spilocaea oleagina, está difundido na região mediterrânica. As perdas surgem principalmente devido à desfoliação de árvores gravemente infectadas, com consequente redução do rendimento.
Sintomas
Os sintomas estão principalmente confinados às folhas e aparecem como manchas castanhas escuras, circulares, zonadas rodeadas de auréolas amarelas ("olho de pavão"). S. oleagina mostra um crescimento subcuticular típico, formando colónias planas dentro da camada cutinizada da parede espessa da célula epidérmica. Este hábito tem sido associado a uma reacção de defesa do hospedeiro envolvendo mobilização e decomposição da oleuropina fenólica glucosídica e inibição das enzimas pectolíticas produzidas pelo agente patogénico. A doença é particularmente grave em olivais densamente plantados de cultivares susceptíveis e em viveiros. As infecções podem ocorrer durante todo o ano, excepto durante os verões quentes e secos, quando ocorrem temperaturas favoráveis (opt. 16-21°C) e chuva. As conidias, formadas no ápice de conidióforos ampulliformes curtos, são geralmente transportadas por gotículas de chuva, mas dados recentes mostram que correntes de ar húmido e insectos também contribuem para uma disseminação aérea limitada. Normalmente, o período de incubação é de cerca de 2 semanas; contudo, se a infecção for seguida de uma estação quente, pode durar várias semanas. Os pontos já formados na Primavera podem parar de crescer no Verão e retomar o seu crescimento e esporulação no Outono. Os programas de controlo químico incluem tratamentos fungicidas (especialmente cobre) durante as principais estações de infecção (Primavera e Outono).
Ciclo de Vida da Doença
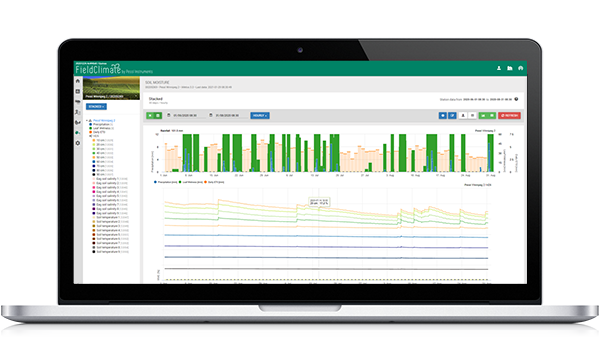
As folhas e frutos fortemente infectados no solo, bem como os que permaneceram na árvore, são um fonte de inóculo para a época actual ou permitir o excesso de Inverno do fungo. Sabe-se geralmente que o patogénio sobrevive a condições desfavoráveis, por exemplo, tempo seco e quente, em folhas caídas, bem como em folhas infectadas na árvore. As conidias formadas nas folhas da árvore podem sobreviver durante vários meses; embora uma vez separadas dos conidióforos, percam a sua capacidade germinativa em menos de uma semana (Viruega e Trapero 1999). Após um período de tempo quente e húmido novos lotes de conidia são prontamente produzidos nas manchas foliares. As conídias viáveis são também produzidas em folhas caídas. No entanto, o seu papel como inóculo para produzir novas infecções é considerado insignificante (Trapero e Blanco 2008). Este estudo demonstrou que a doença é geralmente favorecido pelo clima frescoNo entanto, o clima quente e húmido durante o Verão de 2009 também foi observado para encorajar a ocorrência de doenças. Estas observações apoiam as de Viruega e Trapero (1999), que descobriram que em Espanha as infecções foliares podem permanecer latentes durante o Verão sem causar qualquer queda das folhas e são a principal fonte de inóculo para a infecção do Outono-Inverno. As observações também indicaram que folhas jovens eram muito susceptíveis à infecção na Primavera, e essa folhagem nas partes mais baixas das árvores era mais frequentemente infectada. Isto é consistente com a exigência do agente patogénico de elevada humidade para se desenvolver. A germinação requer 98% de humidade, com temperaturas na gama de 0-27°C (Trapero Cassas 1994). Na Austrália, a doença pode estar inactiva durante os verões quentes e secos. A germinação dos esporos é restringida a temperaturas superiores a 30°C. O percentagem de conídios germinativos diminui linearmente em proporção à idade da folha, sendo 58% com 2 semanas e 35% com 10 semanas. A temperatura afecta significativamente as frequências de germinação do conídio em folhas húmidas de 5°C a 25°C. O por cento a germinação aumenta de 16.1, 23.9, 38.8 para 47.8 e diminui novamente para 35.5% após 24 h. A formação de appressoria ocorreu 6 h após os primeiros sinais de germinação. A percentagem de germes com appressoria aumenta com o aumento da temperatura até um máximo de 43% a 15°C. Não se formam appressorias a 25°C após 48 h de incubação. Aumentando duração da humidade provoca a germinação de um número crescente de conídios a todas as temperaturas testadas (5-25°C). Os períodos mínimos de humidade das folhas necessários para germinação a 5, 10, 15, 20 e 25°C foram de 24, 12, 9, 9 e 12 h, respectivamente. A 20°C, um período de humidade mais curto (6 h) é suficiente se as conidias germinativas fossem então colocadas em 100% RH, mas não a 80 ou 60%. No entanto, nenhuma conidia germina sem água livre mesmo após 48 h de incubação a 20°C e 100% RH. A apresentação gráfica do modelo do ponto Peacock mostra o humidade das folhas, humidade relativa e temperatura do ar juntamente com os resultados para infecção progresso e gravidade da infecção. O gráfico abaixo indica uma infecção que começa a 17 de Dezembro às 19:00 e termina a 100% a 18 de Dezembro às 11:00. A gravidade da infecção é calculada após um período de humidade mais longo e aumenta em etapas até 4o que significa o maior severidade calculada para este período de infecção.
Literatura:
- Graniti A (1993) Olive scab: uma revisão. Boletim OEPP/EPPO 23, 377-384.
- MacDonald AJ, Walter M, Trought M, Frampton CM, Burnip G (2000) Survey of Olive leaf spot in New Zealand. New Zealand Plant Protection 53, 126-132.
- Obanor EO, Walter M, Jones EE, Jaspers MV (2005) In vitro effects of fungicides on conidium germination of Spilocaea oleagina, the cause of olive leaf spot. New Zealand Plant Pathology 58, 278-282.
- Schubert K, Ritschel A, Braun U (2003) Uma monografia de Fusicladium s.lat. (Hyphomycetes). Schlechtendalia 9, 71-132.
- Shabi E, Birger R, Lavee S, Klein I (1994) Leaf spot (Spilocaea oleaginea) sobre a oliveira em Israel e o seu controlo. Acta Horticulturae 356, 390-394.
- Trapero Cassas A (1994) El repilo del olivo. Agricultura 746, 788-790.
- Trapero A, Blanco MA (2008) Enfermedades. pp. 557-614. In 'El cultivo de olivo. 6ª edição'. (Eds D Barranco, R Fernández-Escobar, L Rallo) 846 pp. (Coedición Junta de Andalucía/Mundi-Prensa: Madrid, Espanha)
- Viruega JR, Lique F, Trapero A (1997) Caída de aceituhas debida a infectciones del pedunculo por Spilocaea oleagina, agente del Repilo del olivo. Fruticultura Profesional 88, 48-54.
- Viruega JR, Trapero A (1999) Epidemiologia da mancha foliar de oliveira causada pela Spilocaea oleagina no sul de Espanha. Acta Horticulturae 474, 531-534.
Equipamento recomendado
Verificar que conjunto de sensores é necessário para monitorizar as potenciais doenças desta cultura.