Banan modele choroby
Banan jest jednym z najważniejszych owoców na świecie. W słodkiej formie jako Dollar Banana oraz w niesłodkiej formie kulinarnej jest głównym składnikiem diety ludzi żyjących w krajach tropikalnych. Od późnych lat XIX wieku banan zaczyna być najważniejszym owocem w handlu światowym. Banany produkowane w Ameryce Środkowej i na Karaibach zaczęły być eksportowane do USA i Europy. Obecnie banany stanowią ważną część bazy owocowej krajów przemysłowych. Wraz z rosnącymi dochodami w Chinach i Europie Wschodniej nowe rynki tworzą nowe zapotrzebowanie na banany.
Istnieją dwa ważne choroby związane z plamami na liściach w bananach: Żółta Sigatoka i Czarna Sigatoka. Żółta Sigatoka wywołana przez grzyb Mycosphaerella musicola rozprzestrzeniła się na wszystkich obszarach uprawy bananów, natomiast Czarna Sigatoka wywołana przez grzyb M. fijiensis var. difformis została znaleziona na Fidżi. Czarna Sigatoka wykazuje znacznie większą zjadliwość niż Żółta Sigatoka i z tego powodu stała się najważniejszą chorobą bananów w większości krajów uprawiających banany.
Choroba Black Sigatoka
Praca powstała na podstawie dwóch następujących artykułów:
- Black Leaf Streak Disease; Pests and Diseases of American Samoa Number 10, American Samoa Community College Community & Natural Resources Cooperative Research & Extension. 2004
- Black Sigatoka An Increasing Thread to Banana Cultivation; Douglas H. Marín, Del Monte Fresh Produce; Ronald A. Romero, Chiquita Brands; Mauricio Guzmán, National Banana Corporation of Costa Rica; Turner B. Sutton, North Carolina State University, Raleigh
Czarna smuga liści (BLS), lub "Black Sigatoka", jest najbardziej szkodliwą chorobą liści bananów na całym świecie. Choroba dotyka większość obszarów tropikalnych i subtropikalnych, a odnotowane straty wynoszą 30-50%. Pierwsze doniesienie o BLS na Pacyfiku miało miejsce 40 lat temu w dolinie Sigatoka na Fidżi. Większość fungicydów stosowanych w produkcji bananów ma na celu zwalczanie BLS. Banan typu Cavendish 'Williams', uprawiany przez większość producentów komercyjnych, jest bardzo podatny na chorobę grzybową. Zainfekowane rośliny mają mniej liści, co prowadzi do mniejszej liczby i mniejszych owoców, opóźnionego zbioru, przedwczesnego dojrzewania i gorszej jakości owoców.
Potencjalny wpływ
Black sigatoka powoduje zniszczenie tkanki liści bananowca, co wpływa na zdolności fotosyntetyczne rośliny i może zmniejszyć plony nawet o 50%. Black sigatoka jest jednym z głównych czynników odpowiedzialnych za upadek przemysłu eksportowego bananów w krajach Południowego Pacyfiku. Plantacje komercyjne produkujące banany na eksport muszą utrzymywać kosztowny program oprysków fungicydami w celu zwalczania Black sigatoka, co było krytykowane ze względu na ochronę środowiska i zdrowia ludzi. Jednakże, jeśli nie jest to kontrolowane, owoce wyprodukowane z chorych roślin mogą przedwcześnie dojrzewać podczas transportu i powodować dalsze straty. W kolejnych latach spustoszenie poczynione przez chorobę udało się opanować za pomocą oprysków chemicznych (15-17 aplikacji fungicydów), ale to znacznie zwiększyło koszty produkcji.
Rośliny, których to dotyczy
Zdecydowane objawy Black sigatoka odnotowano tylko na Musa (Banany), Musa paradisiaca (Plantains), Musa acuminata (Dziki banan) i Musa acuminata (subsp. bantesii i subsp. zebrina). Odmiany różnią się reakcją na patogen. Odporność nie jest znana i możliwe jest, że inne dzikie gatunki i podgatunki Musa są zakażone, ale choroba nie rozwija się znacząco. Mycosphaerella fijiensis może również atakować stadium siewek dzikich bananów.
Sezon występowania
Zarodniki sigatoki czarnej łatwo tworzą się podczas tropikalnego i subtropikalnego lata lub w warunkach wysoka wilgotność i opady deszczu, zwłaszcza gdy na liściach znajduje się warstwa wolnej wody. Zasadniczym sposobem rozprzestrzeniania się jest zmywanie przez deszcz lub rozpryskiwanie zarodników, ale w późniejszym okresie rozwoju choroby zarodniki są również przymusowo wyrzucane do prądów powietrznych. Do infekcji dochodzi na najmłodszych liściach rośliny w trakcie i bezpośrednio po rozwinięciu, ale starsze liście bardziej sprzyjają rozwojowi choroby. Oczywiste objawy wizualne pojawiają się około 15-20 dni po pierwszej infekcji.
Symptomy
Pierwszymi widocznymi objawami porażenia liści są krótkie, czerwonobrązowe linie o długości około 2 mm. Linie te przechodzą w brązowe smugi o długości 20-30 mm, które rozszerzają się w eliptyczne plamy, brązowe na spodniej stronie liścia, czarne na górnej. Plamy są lekko zapadnięte i otoczone żółtawym halo. Następnie środek dużej plamy staje się szary, obramowany czarną linią i żółtym halo. W końcu plamy łączą się, zabijając liść.
Epidemiologia
Zarówno konidia, jak i askospory odgrywają rolę w rozprzestrzenianiu się choroby. Konidia tworzą się w warunkach o wysokiej wilgotności, zwłaszcza gdy na liściach znajduje się film wolnej wody. Powstają w trakcie rozwoju pierwszych stadiów choroby (szczególnie w stadium 2 kreski, stadium 3 smugi i stadium 4 plamki). Główną drogą rozprzestrzeniania się jest zmywanie i rozpryskiwanie przez deszcz; konidia nie są roznoszone przez wiatr. Konidia są związane głównie z lokalnym rozprzestrzenianiem się choroby i mają duże znaczenie w okresach wysokiej wilgotności powietrza, częstych silnych rosy i przerywanych deszczów.
Ponieważ M. fijiensis wytwarza stosunkowo niewiele konidiów, ascospory są uważane za ważniejsze w rozprzestrzenianiu się czarnej Sigatoki (4,20). Jednakże Jacome et al. (10) stwierdził, że konidia są w stanie wywołać znaczne ilości choroby, a objawy chorobowe są identyczne jak w przypadku infekcji ascosporami. Wskazał, że konidia nabierają większego znaczenia w okresach suchych, kiedy rozwój choroby jest opóźniony ze względu na obecność mniej sprzyjających warunków klimatycznych (10). Askospory są podstawowym sposobem rozproszenie na większe odległości w obrębie plantacji i na nowych obszarach, i są zwykłymi sposobami rozprzestrzeniania się podczas dłuższych okresów wilgotnej pogody (3,4,6,10, 11,15).
Askospory są produkowane w pseudotecjach w dojrzałych zmianach, które są powszechne na starszych liściach rośliny lub w martwych liściach leżących na ziemi. Meredith i Lawrence (14) podali, że pseudotecja są produkowane po obu stronach powierzchni liścia, ale większa liczba występuje na powierzchni adaksjalnej. Odwrotnie, Gauhl i wsp. (6) stwierdzili, że więcej pseudotecjów i askospor było produkowanych na abaksjalnej powierzchni liścia. Chociaż Burt i wsp. (2) stwierdzili, że około 4,5 askospor jest uwalnianych z jednego pseudotecjum, liczba ta wydaje się bardzo niska, biorąc pod uwagę wysokie stężenie inokulum, które jest obecne w powietrzu po deszczu (4).
Uwalnianie askospor
Wymaga obecności warstwa wody z deszczu lub rosy która wchłania pseudotecję i powoduje przymusowy wyrzut askospor przez warstwę graniczną liścia, gdzie są one rozpraszane przez prądy powietrzne (15,20). Dojrzewanie pseudotecji wymaga nasycenia martwych tkanek liści przez około 48 h (3,4,7,10,11,15). W warunkach hawajskich stężenie askospor wzrastało w nocy, było najwyższe około godziny 0600, a w ciągu dnia znacznie spadało. W dni deszczowe szczytowe stężenia występowały krótko po rozpoczęciu deszczu. Sezonowe wzrosty średnich dziennych stężeń askospor związane są ze zwiększonymi opadami i wilgotnością względną (15). Gauhl (4), pracując z bananowcami, podał podobne wyniki w warunkach kostarykańskich. Podczas gdy Meredith i wsp. (15) nie znaleźli dowodów na to, że na produkcję lub uwalnianie askospor wpływały minimalne temperatury, Gauhl (4) ustalił, że w karaibskiej strefie Kostaryki występuje zmniejszenie produkcji inokulum w suchszych (lub mniej deszczowych) miesiącach roku, co jest jednocześnie sezonem o najniższych temperaturach. Askospory są rozpraszane przez wiatr; jednak dyspersja na duże odległości jest ograniczona do kilkuset kilometrów ze względu na ich podatność na promieniowanie ultrafioletowe (17). Nie wykazano spójnego związku pomiędzy wyrzutem askospor a rozwojem choroby, co ogranicza przydatność odłowu zarodników do prognozowania chorób (5,11). Askospory osadzają się głównie na dolnej powierzchni liścia podczas rozwijania nowego liścia, powodując pasmowy wzór infekcji na stronie, która jest odsłonięta jako pierwsza, co jest odzwierciedleniem zwiększonego osadzania zarodników na cylindrycznym liściu candela podczas jego rozwijania, w przeciwieństwie do całej otwartej blaszki liścia. W konsekwencji większość infekcji występuje na abaksjalnej powierzchni liści (3,7).
Infekcja
Rurki zarodkowe potrzebują około 48 do 72 godzin, aby przeniknąć przez aparaty szparkowe (1,20), chociaż grzyb może rosnąć epifitycznie na powierzchni liścia do 6 dni przed faktycznym wniknięciem do liści (1). Skuteczne zakażenie jest promowany przez rozszerzony okresy wysokiej wilgotności i obecności wolnej wody na liściach (3,7,13). Maksymalna zdolność kiełkowania występuje przy obecności wolnej wody. Konidia kiełkują w szerszym zakresie wilgotności względnej (92 do 100%) niż askospory (98 do 100%). Wpływ temperatura na kiełkowanie może być scharakteryzowana przez kwadratową funkcję odpowiedzi, z szacowanym optimum 26,5°C (10). Stover (21) zaobserwował maksymalny wzrost kiełków askosporowych w temp. 26 do 28°C po 24 h inkubacji. Jacome i Schuh (8,9) podali, że starsze liście są bardziej podatne; jednak E. Bureau (komunikacja osobista) i Romero (18) zaobserwowali, że młodsze liście są bardziej podatne (od pierwszego do trzeciego) niż starsze.
Okres inkubacji
Czas pomiędzy infekcją a pojawieniem się objawów jest różny w zależności od warunków pogodowych i podatności rośliny (68). U bananów szacuje się, że czas infekcji liści zbiega się z pojawieniem się nowego liścia z wierzchołka pseudostemów (20). W bardzo korzystnych warunkach panujących w Kostaryce i przy podatnym gospodarzu okres inkubacji może wynosić od 13 do 14 dni, natomiast w okresach niesprzyjającej pogody okres inkubacji może wydłużyć się do 35 dni. Podobne doniesienia pochodzą z Nigerii na plantanach (16). W porze deszczowej okres inkubacji wynosił 14 dni, natomiast w porze suchej 24 dni. Długość okresu inkubacji zmienia się również w zależności od podatności odmiany na M. fijiensis. Okres inkubacji wynosił odpowiednio 26,2 i 25,1 dnia w przypadku odmian FHIA 1 i FHIA 2, dwóch tetraploidalnych mieszańców syntetycznych opracowanych przez FHIA, w porównaniu z 22,4 dniami w przypadku podatnej odmiany Grande Naine (19).
Po wniknięciu do liścia, w jego wnętrzu rozwijają się strzępki <M. fijiensis kolonizują sąsiednie komórki przez około 7 dni, nie wykazując przy tym żadnych oznak przerwania ciągłości komórek. Wegetatywne strzępki mogą wyłaniać się ze szparek i rosnąć na powierzchni liścia oraz penetrować sąsiednie szparki lub wytwarzać konidiofory i konidia. Ten epifityczny wzrost umożliwia grzybowi kolonizację przyległych tkanek liścia, co powoduje szybki rozwój objawów (4,20). M. fijiensis ma większą zdolność do przenikania przez kilka stomatów niż M. musicola, co powoduje większą plamistość niż w przypadku tego pierwszego patogenu (20).
Okres utajony
Chociaż konidia mogą być wytwarzane w zmianach wykazujących wczesne objawy M. fijiensis i przyczynić się do wybuchu epidemii, okres utajony określa się na podstawie czasu, w którym grzyb zaczyna wytwarzać zmiany z dojrzałymi pseudotecjami i askosporami, które są głównym źródłem inokulum. Podobnie jak okres inkubacji, okres utajony również zmienia się w zależności od warunków pogodowych, podatności gospodarza i intensywności infekcji. W Guapiles na Kostaryce okres utajenia wynosił od 25 dni w porze deszczowej (od czerwca do grudnia) do 70 dni w porze suchej. Gdy pogoda sprzyja wydzielaniu askospor i infekcji, wiele infekcji pojawia się na liściach. Gdy infekcje są gęste, szybko koalescendują się w bardzo wczesnym stadium rozwoju, przyspieszając pojawienie się dojrzałych plam, które charakteryzują się obecnością pseudotecjów i askospor (22). W tych warunkach liście ulegają szybkim i poważnym uszkodzeniom. Okres utajenia jest również zróżnicowany w zależności od poziomu odporności. Na przykład czas od pojawienia się liścia do wystąpienia pierwszego dojrzałego objawu plamistości w tych samych warunkach naturalnych dla odmiany Curraré, banana kuchennego należącego do podgrupy Plantain, wynosił 44 dni w porównaniu z 34 dniami dla odmiany Valery, banana należącego do podgrupy Cavendish (4). Termin "czas rozwoju choroby" jest powszechnie stosowany w literaturze dotyczącej bananów w tropikach w odniesieniu do okresu utajonego i jest definiowany jako czas pomiędzy zakażeniem a powstaniem dojrzałych plam. Innym często stosowanym terminem w literaturze dotyczącej bananów jest "czas ewolucji objawów" lub "okres przejściowy", który jest czasem od wystąpienia pierwszych objawów do pojawienia się dojrzałych plam (6). Czas ewolucji objawów daje dobre wskazanie, jak szybko choroba postępuje na liściach.
Literatura:
- Beveraggi, A. 1992. Etude des interactions hôte-parasite chez des bananiers sensibles et résistants inoculés par Cercospora fijiensis responsible de la maladie des raies noires. Thèse de 3ème cycle. Université de Montpellier, Montpellier, Francja.
- Burt, J. P. A., Rosenberg, L. J., Rutter, J., Ramírez, F., and González, O. H. 1999. Forecasting the airborne spread of Mycosphaerella fijiensis, cause of black Sigatoka disease on banana: Estimations of numbers of perithecia and ascospores. Ann. Appl. Biol. 135:369-377.
- Fullerton, R. A. 1994. Sigatoka Leaf Diseases.Pages 12-14 in: Compendium of Tropical Fruit Diseases. R. C. Ploetz, G. A. Zentmyer, W. T. Nishijinia, K. G. Rohrbach, and H. D. Ohr, eds. American Phytopathological Society, St. Paul, MN.
- Gauhl, F. 1994. Epidemiology and Ecology of black Sigatoka (Mycosphaerella fijiensis Morelet) on Plantain and Banana (Musa spp.) in Costa Rica, Central America. INIBAP, Montpellier, Francja.
- Gauhl, F. 2002. Czy pułapki zarodnikowe są użytecznym narzędziem do przewidywania rozwoju choroby Sigatoka na komercyjnych plantacjach bananów. Strona 22 w: Int. Workshop Mycosphaerella Leaf Spot Dis. Bananas, 2nd - Programme and Abstracts. (Abstr.)
- Gauhl, F., Pasberg-Gauhl, C., and Jones, D. R. 2000. Cykl chorobowy i epidemiologia. Pages 56-62 in: Diseases of Banana, Abacá and Enset. D. R. Jones, ed. CAB International, Wallingford, UK.
- González, M. 1987. Enfermedades del cultivo del banano. Oficina de Publicaciones de la Universidad de Costa Rica, San José.
- Jacome, L. H., and Schuh, W. 1992. Effects of leaf wetness duration and temperature on development of black Sigatoka disease on banana infected by Mycosphaerella fijiensis var. difformis. Phytopathology 82:515-520.
- Jacome, L. H., and Schuh, W. 1993. Effect of temperature on growth and conidial production in vitro, and comparison of infection and aggressiveness in vivo among isolates of Mycosphaerella fijiensis var. difformis. Trop. Agric. 70:51-59.
- Jacome, L. H., Schuh, W., and Stevenson, R. E. 1991. Effect of temperature and relative humidity on germination and germ tube development of Mycosphaerella fijiensis var. difformis. Phytopathology 81:1480-1485.
- Jeger, M. J., Eden-Green, S., Thresh, J. M., Johanson, J. M., Waller, J. M., and Brown, A. E. 1995. Banana diseases. Pages 317-381 in: Banany i Plantany. S. Gowen, red. Chapman & Hall, London.
- Marín, D. H., and Romero, R. A. 1992. El combate de la Sigatoka negra. Boletín No. 4, Departamento de Investigaciones, Corporación Bananera Nacional, Costa Rica.
- Mayorga, M. H. 1990. La Raya negra (Mycosphaerella fijiensis Morelet) del plátano y del banano. I. Ciclo de vida del patógeno bajo las condiciones del Urabá. Revista ICA 25:69-77.
- Meredith, D. S., and Lawrence, J. S. 1969. Black leaf streak disease of bananas (Mycosphaerella fijiensis): Symptomy choroby na Hawajach oraz uwagi na temat stanu konidialnego grzyba sprawczego. Trans. Br. Mycol. Soc. 52:459-476.
- Meredith, D. S., Lawrence, J. S., and Firman,I. D. 1973. Ascospore release and dispersal on black leaf streak disease of bananas (Mycosphaerella fijiensis). Trans. Br. Mycol. Soc. 60:547-554.
- Mobambo, K. N., Gauhl, F., Pasberg-Gauhl, C., and Zuofa, K. 1996. Season and plant age effect evaluation of plantain for response to black Sigatoka disease. Crop Prot. 15:609- 614.
- Parnell, M., Burt, P. J. A., and Wilson, K. 1998. The influence of exposure to ultraviolet radiation in simulated sunlight on ascospores causing black Sigatoka disease of banana and plantain. Int. J. Biometeorol. 42:22-27.
- Romero, R. A. 1995. Dynamics of fungicide resistant populations of Mycosphaerella fijiensis and epidemiology of black Sigatoka of bananas. Ph.D. diss. North Carolina State, Raleigh.
- Romero, R. A., and Sutton, T. B. 1997. Reakcja czterech genotypów Musa w trzech temperaturach na izolaty Mycosphaerella fijiensis z różnych regionów. Plant Dis. 81:1139-1142.
- Stover, R. H. 1980. Sigatoka leaf spot of bananas and plantains. Plant Dis. 64:750-756.
- Stover, R. H. 1983. The effect of temperature on ascospore germ tube growth of Mycosphaerella musicola and Mycosphaerela fijiensis var. difformis. Fruits 38:625-628.
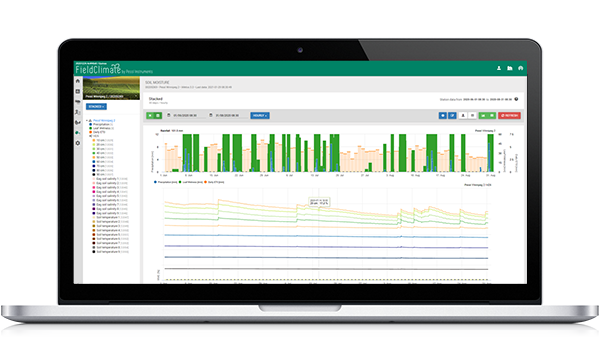
Model zakażenia Sigatoka Czarnego
Model infekcji Sigatoka na FieldClimate.com składa się z Modelu dla:
- Formowanie askospor
- Wydzielanie askospor
- Zakażenie askosporami
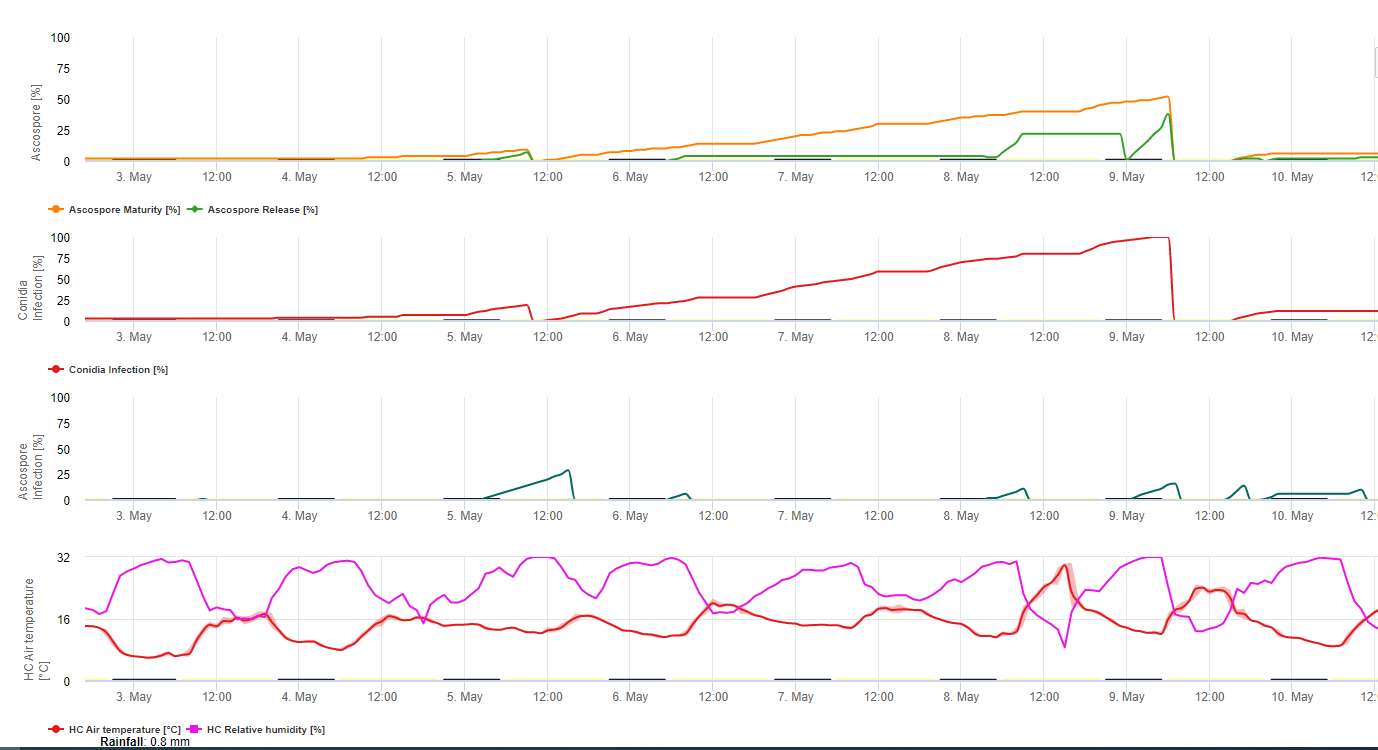
Model formowania konidiów wykorzystuje wilgotność względną i temperaturę powietrza. Tworzenie konidiów następuje, gdy wilgotność względna jest równa lub wyższa niż 70%. Szybkość tworzenia się konidiów zależy od temperatury. Optymalna temperatura dla tworzenia konidiów to 27°C do 30°C. W tej temperaturze maksymalnej konidia powstaną, jeśli przez ponad 24 godziny będziemy mieli wilgotność względną 70%. Jeśli jest chłodniej lub cieplej maksymalne formowanie konidiów potrwa 32 godziny.
Model formowania askospor wykorzystuje również temperaturę i wilgotność względną. Ascospore formation ma miejsce, jeśli wilgotność względna jest równa lub wyższa niż 70%. Optymalna temperatura to znów 27 °C do 30 °C. W tej temperaturze maksimum ascospor osiąga się po 48 godzinach. W niższych temperaturach do utworzenia maksymalnej ilości askospor potrzeba 2 dni.
Wydzielanie askospor odbywa się podczas deszczu. Główna ilość askospor uwalniana jest na początku deszczu. Dlatego zarodniki będą uwalniane na początku infekcji. Ilość uwolnionych askospor jest ograniczona do liczby uformowanych askospor.
Infekcja następuje w okresach wilgotności liści lub wilgotności względnej wyższej niż 90%. W optymalnej temperaturze infekcja zostanie zakończona po 12 godzinach wilgotnych warunków. Jeśli temperatura nie jest tak wysoka będzie potrzebna od 15 do 24 godzin.
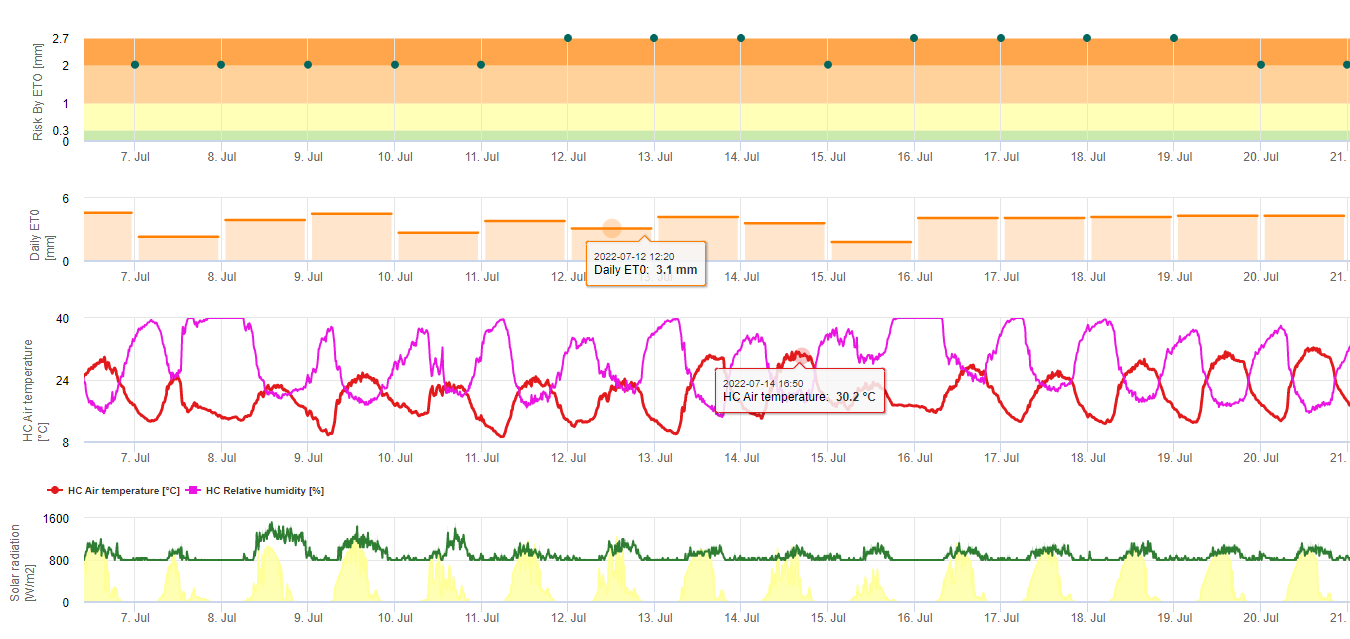
Black Sigatoka Model ryzyka
Dwa modele ryzyka Black Sigatoka
Jeden z modeli (ryzyko Sigatoka przez ET) opiera się na a) Określeniu ewapotranspiracja (potrzebne czujniki: temperatura, rel. humidtiy, prędkość wiatru i promieniowanie globarne). Model ten oparty jest na pracy Ganry, J. & Meyer,J.P. (1972): La lutte contrôlée contre le Cercospora aux Antilles. Bases climatiques de l'avertissement. Fruits 27(11):767-774. W tym badaniu ETpiche zostało użyte do oceny klimatycznej przychylności dla sigatoka. Field.Climate używa równania "Penman Montheith" (jest to najbardziej ogólne i szeroko stosowane równanie do obliczania ET referencyjnego) zamiast ETpiche. Jeśli skumulowana ewapotranspiracja z ostatnich 7 dni wynosi:
> 40 mm Brak ryzyka
> 30 mm Niskie ryzyko
> 22 mm Średnie ryzyko
< 22 mm Wysokie ryzyko
b) Drugi model (Sigatoka Risk by Infection) wykorzystuje wyniki modelu infekcji, aby udowodnić dla infekcji i zakresu opady podczas tego zakażenia, aby ocenić znaczenie tego zdarzenia zakażenia. Ilość deszczu podczas infekcji jest odpowiedzialny za dystrybucja zarodników. Im więcej zarodników zostanie rozmieszczonych na podatnej tkance, tym więcej tkanek zostanie zainfekowanych i tym większe będzie rozprzestrzenianie się choroby. Infekcja bez deszczu ma wartość nasilenia choroby 1. Infekcja przy mniej niż 2, 5 i 10 mm deszczu ma wartość nasilenia 2, 3 lub 4. Jeśli było więcej niż 10mm deszczu wartość nasilenia wynosi 5. Wskazanie ryzyka odbywa się poprzez kumulację tych wartości nasilenia dla ostatnich 4 dni. Jeśli skumulujemy 0 to nie ma ryzyka. Jeśli skumulujemy mniej niż 4 jest niskie ryzyko Sigatoka. Jeśli zgromadzimy między 4 a 12 jest umiarkowane ryzyko i jeśli zgromadzić więcej niż 12 w ciągu ostatnich 4 dni ryzyko jest określone jako wysokie.
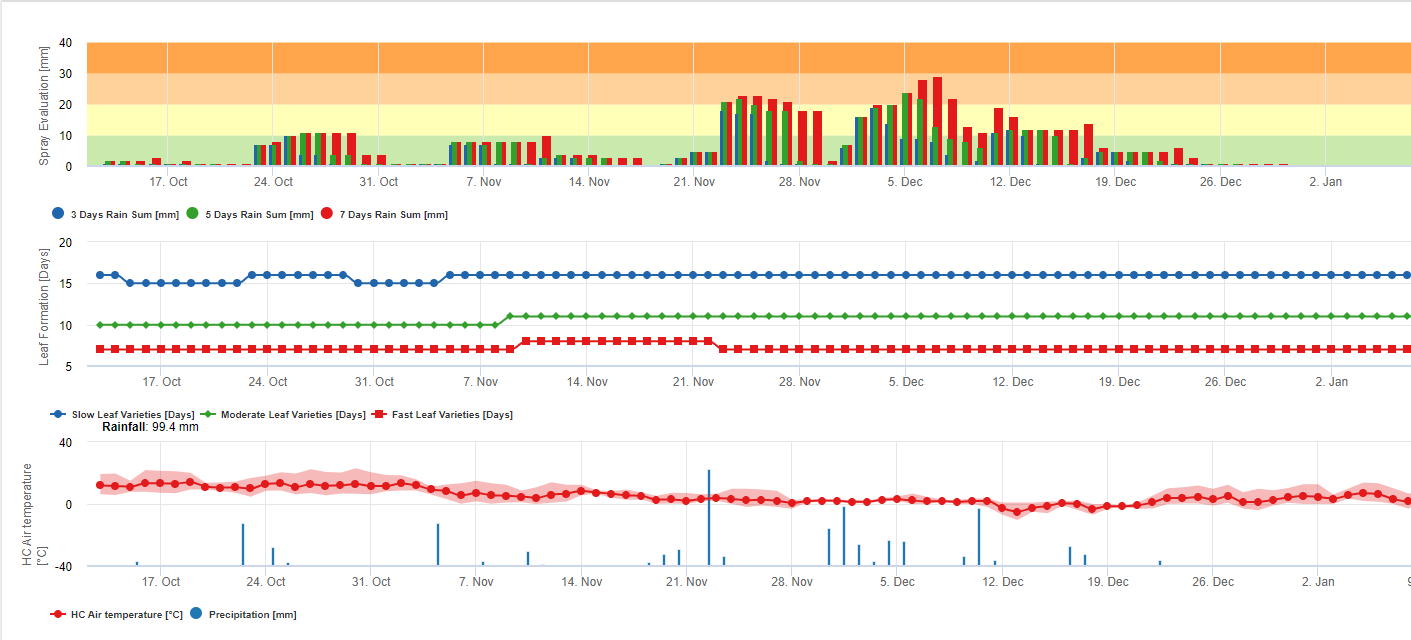
Informacja dla Black Sigatoka Spray Ocena
Akumulacja deszczu do oceny pozostałości na FieldClimate:
Jeśli deszcz jest >= 3mm to jest liczony i akumulowany dla:
- 3 dni
- 5 dni
- 7 dni
Skumulowana suma deszczu powoduje, że w odniesieniu do progu 10, 20 i 30 mm powstaje Graf.
Formowanie liści do oceny pozostałości na FieldClimate:
Jeśli temperatury powietrza w dzień i w nocy wynoszą:
12-14°C i 12-13°C trwa 23, 16, lub 21 dni 15-17°C i 14-15°C trwa 20, 14, lub 10 dni 18-20°C i 16-22°C trwa <15, <12, lub <8 dni 21-27°C i 16-22°C trwa <13, <11, lub <6 dni 28-30°C i 23-24°C trwa <14, <12, lub <8 dni 31-40°C i 25-40°C trwa 20, 14, lub 10 dni do uformowania wszystkich liści na odmianach o średnim, szybkim i bardzo szybkim formowaniu liści.
Informacja ta powinna pomóc w ocenie niechronionych tkanek. Powodem może być zatem duża ilość deszczu od ostatniego zastosowania środków ochrony roślin (pozostałości są już zmyte lub powstają nowe liście.
Zalecane wyposażenie
Sprawdź, jaki zestaw czujników jest potrzebny do monitorowania potencjalnych chorób tej uprawy.