Búza betegségmodellek
Búza (Triticum spp.) a második legfontosabb sorozatos termés. A búzát nagyon széles éghajlati skálán termesztik, a szubtrópusi téli termesztéstől a skót 11 hónapig termesztett, hűvös éghajlatú, hatalmas termőképességű búzáig. Mint minden növénybetegségnek, ennek is vannak olyan vonatkozásai, amelyek inkább történeti eredetűek, és vannak olyanok, amelyek főként az éghajlati viszonyoktól függenek.
Az éghajlati eredetű betegségek a következők: A rozsdabetegségek, amelyek a melegebb éghajlati övezetekben nagyobb jelentőséggel bírnak, főként az éghajlat által okozott betegségek. Fusarium head blight és toxinképző képességét befolyásolja a termőhely története és az éghajlati viszonyok is; nem fordul elő, ha az éghajlat nem kedvező a virágzás alatti fertőzéshez. Továbbá Septoria tritici a fröccsenő esőktől és a hosszan tartó levélnedvességtől függ, hogy megfertőzze a kánikulát és tovább a kukoricát.
Betegségek történelmi vonatkozásokkal: Lisztharmat Blumeria graminis, amely széles éghajlati tartományban fordul elő, elsősorban egy terület története befolyásolja. Pseudocercosporella herpotrichoides (Szemfolt betegség), Gaeumannomyces graminis (Take- all, Schwarzbeinigkeit) és Rhizoctonia cerealis (sárga tétel) többnyire a helyszín történetétől függ, és nem befolyásolja őket nagymértékben az éghajlat.
A betegség Pyricularia grisea részletesen le van írva a Rice Diseases című könyvben, és itt Magnaporthe grisea néven szerepel.
Barna rozsda
A kórokozó Puccinia triticina ugyanolyan környezeti feltételeket igényel, mint a búzalevél. A gomba legfeljebb három órás harmatperióduson belül, 20 °C körüli hőmérsékleten képes megfertőzni a növényi szövetet; hosszabb harmatperiódus esetén azonban több fertőzés fordul elő. Hűvösebb hőmérsékleten hosszabb harmatperiódusra van szükség, például 10°C-on 12 órás harmatperiódus szükséges. Kevés vagy egyáltalán nem fordul elő fertőzés, ha a harmatperiódus hőmérséklete 32°C felett (Stubbs et al., 1986) vagy 2°C alatt van.
A legtöbb súlyos járvány akkor fordul elő, amikor az uredinia és/vagy a látens fertőzések a telet valamilyen küszöbértékig túlélik a búzában, vagy amikor a tavaszi vetésű búza korai időpontban, általában a fejtés előtt exogén inokulumot kap. Súlyos járványok és veszteségek akkor fordulhatnak elő, ha a zászlóslevél az antézis előtt fertőződik (Chester, 1946). Puccinia triticina elsősorban a búza, annak közvetlen elődei és az ember által termesztett tritikálé kórokozója.
Alternatív házigazdák
A gomba az ivaros ivarsejtjeit (pükniospórákat és receptív hifákat) a váltógazdán termeli. A legtöbb rozsdakutató feltételezi, hogy Thalictrum speciosissimum (a Ranunculaceae családban) az elsődleges alternatív gazdanövény a P. recondita f. sp. tritici Európában. A váltógazda akkor fertőződik, amikor a teliospórák szabad nedvesség jelenlétében kicsíráznak. Bazidiospórák (1n) keletkeznek, amelyek rövid távolságra (néhány méterre) képesek elszállni, hogy megfertőzzék a váltógazdákat. Körülbelül hét-tíz nappal a fertőzést követően megjelennek a pükniospórákat és a fogékony hifákat tartalmazó püknioszpórák. Ezek szolgálnak ivarsejtként, és a megtermékenyítés akkor következik be, amikor a pükniospórákat tartalmazó nektárt rovarok, fröccsenő eső vagy kohézió révén a másik párosodási típus receptív hifáihoz viszik. Az aeciospórák hét-tíz nappal később jelennek meg a levél alsó felszínén, és a széllel terjedő aeciospórákat termelnek, amelyek a búzalevelek sztómáin áthatolva fertőzést okoznak. Az ekeospórák által megtett távolságok viszonylag rövidnek tűnnek.
Életciklus (barna rozsda)
A mellékelt ábra az életciklust mutatja a P. triticina és P. triticiduri és a búza levélrozsdájának betegségciklusa. Az egyes események időpontja és egyes események (ivaros ciklus, búza vetési időszak és zöldhíd) gyakorisága a világ különböző területein és régióiban eltérő lehet.
Az alternatív gazdanövény jelenleg kevés közvetlen inokulumot biztosít a P. triticina búzának, de a fajok és talán a populációk közötti genetikai csere mechanizmusa lehet. A kórokozó sok területen az önkéntes (önvetett) búza zöldhídján vészeli át a búzatermesztés közötti időszakot (lásd a "Járványtan" című szakaszt). Az urediniospórák formájában lévő inokulumot a szél egyik régióból a másikba fújhatja. Az ivaros ciklus alapvető fontosságú a P. triticiduri. A teliospórák röviddel a kifejlődés után kicsírázhatnak, és a bazidiospóra-fertőzés a búza egész tenyészideje alatt előfordulhat.
Az uredinospórák a szabad vízzel való érintkezés után 30 perccel, 15° és 25°C közötti hőmérsékleten kezdenek csírázni. A csíracső a levél felszíne mentén növekszik, amíg el nem éri a sztómát; ekkor kialakul egy appresszórium, amelyet azonnal követ egy penetrációs csap és egy szubsztómális vezikulum fejlődése, amelyből elsődleges hifák fejlődnek. A mezofillsejt ellenében egy haustorialis anyasejt fejlődik, és közvetlen behatolás következik be. A haustórium az élő gazdasejt belsejében alakul ki egy kompatibilis gazdatest-patogén kölcsönhatásban. Másodlagos hifák fejlődnek, amelyek további haustoriális anyasejteket és haustóriumokat eredményeznek. Inkompatibilis gazdatest-patogén kölcsönhatás esetén a haustóriumok nem vagy lassabban fejlődnek. Amikor a gazdasejt elpusztul, a gomba haustóriuma is elpusztul. Attól függően, hogy mikor vagy hány sejt érintett, a gazdapatogén kölcsönhatás látható rezisztencia-választ eredményez (Rowell, 1981, 1982).
A spórák csírázása optimális és állandó hőmérsékleten hét-tíz napon belül a sporulációig tarthat. Alacsony hőmérsékleten (10-15 °C) vagy napi ingadozás esetén hosszabb időre van szükség. A gomba egy hónapig vagy tovább is fennmaradhat inszipid micéliumként, ha a hőmérséklet fagypont közelében vagy az alatt van. A maximális sporuláció körülbelül négy nappal a kezdeti sporuláció után (kb. 20°C-on) érhető el. Bár a spórák száma nagymértékben változhat, urediniumonként naponta körülbelül 3 000 spóra termelődik. Ez a termelési szint három hétig vagy még tovább is folytatódhat, ha a búzalevél ennyi ideig életben marad (Chester, 1946; Stubbs és mtsai., 1986). Az urediniumok (pustulák) vörösek, ovális alakúak és elszórtan helyezkednek el, és áttörik az epidermiszt (12. tábla). Az Urediniospórák narancsvöröstől a sötétvörösig terjedő színűek, echinulárisak, gömb alakúak és általában 20-28 µm átmérőjűek (13. lemez). A teliospórák (14. lemez) sötétbarnák, kétsejtűek, vastag falúak, csúcsukon lekerekítettek vagy lapítottak (15. lemez). A Puccinia triticiduri abban különbözik a P. triticinától, hogy az urediniospórák megjelenéséhez 10-12 napra van szükség, és a kezdeti teliospórák termelődése gyakran a kezdeti fertőzést követő 14 napon belül történik. Az urediniumok sárgásbarnák, és urediniumonként sokkal kevesebb urediniospórát termelnek, és néhány napon belül az elváltozás elsősorban teliospórákat termel. Szintén P. triticiduri a fertőzések valószínűleg a levelek alsó felületén vannak.
A teliospórák a P. triticina kedvezőtlen körülmények vagy szeneszcencia esetén az epidermisz alatt képződnek, és a levelekkel együtt maradnak. A levélszövetek szétszóródhatnak, illetve a szél, az állatok vagy az ember által jelentős távolságokra is eljuthatnak. A bazidiospórák nedves körülmények között képződnek és szabadulnak fel, ami korlátozza a terjedésüket. A bazidiospórák emellett hialinok és fényérzékenyek, ami tovább korlátozza a terjedést, valószínűleg több tíz méterre. Az urediniospórákhoz jobban hasonlítanak az aeciospórák, mivel képesek a széláramlatok által szállítani, de nagy távolságra történő szállítást valamiért nem észleltek. Puccinia triticiduri a kezdeti fertőzést követő heteken belül bőséges teliospórákat termel, és minden egyes fertőzési hely körül sötét gyűrűs teliát hoz létre.
Forrás: A búza rozsdásodik: R.P. Singh, J. Huerta-Espino, A.P. Roelfs
Puccinia tritici fertőzési modell
Puccinia tritici fertőzések zajlanak után:
- Néhány órás levélnedvesség optimális hőmérsékleti körülmények között. A gomba széles hőmérséklet-tartományban képes fertőzni.
- A modell feltételezi, hogy a fertőzéshez 90°C-os felhalmozott óránkénti léghőmérsékletre van szükség a levélnedvességhez, 5°C és 30°C közötti léghőmérséklet-tartományban.
A levelek nedvességtartalma a 90°C-os felhalmozott óránkénti átlaghőmérsékletek esetében
- (ha T <= 22,5°C akkor ∑(Th) egyébként ∑ (22,5-(Th-22,5))
- 5°C < Temp. < 30°C
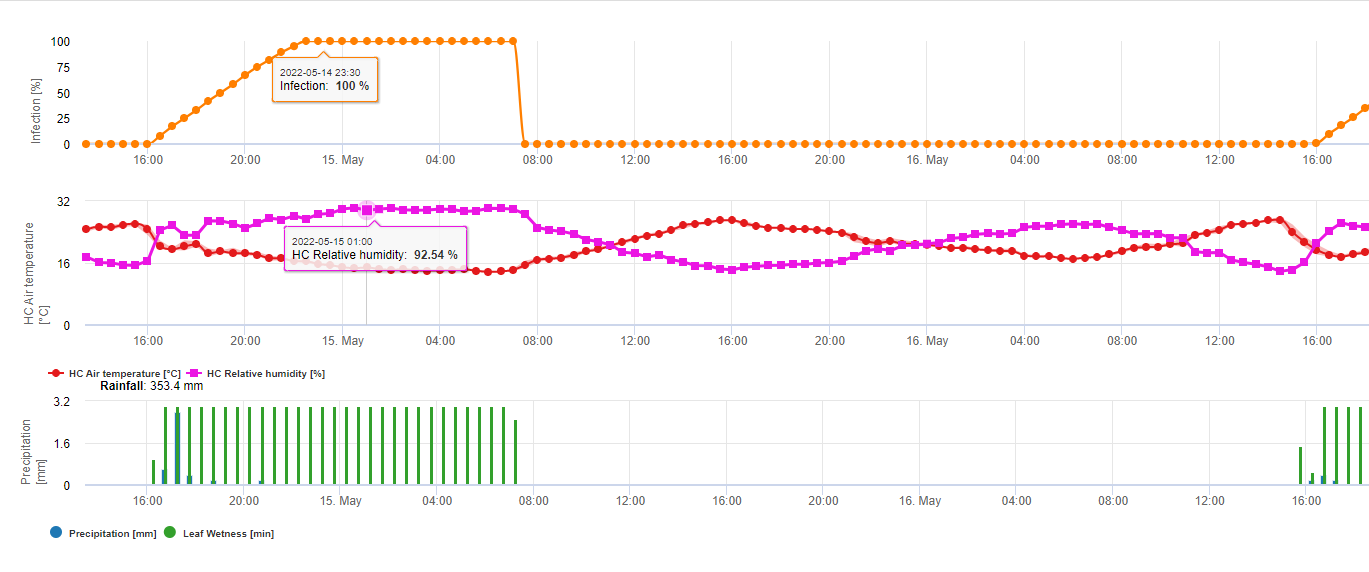
Az FieldClimate-ben a Puccinia tritici a fertőzést a sárga vonal mutatja (lásd fent). A feltételek hasonlóak a következőkhöz P. graminis, de alacsonyabb, 5°C-os hőmérsékleti küszöbértékkel. Az 100% fertőzés kimutatása esetén gyógyító növényvédelmi mérést kell figyelembe venni (szisztémás kijuttatás). Ha a kockázat 80%-nél van, és az időjárás-előrejelzés több levélnedves időszakot jósol, akkor védekező leveles alkalmazásokat lehet végezni.
Fekete rozsda
A búza szár- vagy fekete rozsdáját a következők okozzák P. graminis f. sp. tritici. Egykor a világ legtöbb búzarégiójában rettegett betegség volt. A szárrozsdától való félelem érthető volt, mivel egy látszólag egészségesnek tűnő termés három héttel a betakarítás előtt a betakarításig letört szárak és fonnyadt szemek fekete csomójává válhatott. Európában és Észak-Amerikában az alternatív gazdaszervezet eltávolítása csökkentette a virulencia-kombinációk számát és a helyben termelt inokulum (aeciospórák) mennyiségét. Ezenkívül egyes területeken korai érésű fajtákat vezettek be, hogy lehetővé tegyék a második termést, vagy hogy elkerüljék a virágzást és a szemek kitöltését a meleg időjárás alatt. A korai érésű fajták a szárrozsda által okozott károk nagy részét megússzák azáltal, hogy elkerülik a gomba növekedési időszakát. A rezisztens fajták világszerte széles körben elterjedt használata csökkentette a betegség jelentős termelési tényezőjét. Bár a kórokozó virulenciájában bekövetkezett változások néhány rezisztenciát hatástalanná tettek, a rezisztens fajtákat általában a kórokozót megelőzve fejlesztették ki. Az 1940-es években az Eurekán (Sr6 Ausztráliában), valamint az 1950-es évek közepén az Egyesült Államokban a Lee (Sr9g, Sr11, Sr16), Langdon (Sr9e, +) és Yuma (Sr9e, +) fajtákon kialakult látványos járványok a múltban valóban kivételek voltak. A világ más részein hasonlóak a tapasztalatok (Luig és Watson, 1972; Roelfs, 1986; Saari és Prescott, 1985). Napjainkban a szárrozsda világszerte nagyrészt ellenőrzés alatt áll.
Epidemiológia
A járványtan a P. graminis hasonló a P. triticina. A minimális, optimális és maximális hőmérséklet a spórák csírázásához 2°, 15°-24° és 30°C (Hogg et al., 1969), a sporulációhoz pedig 5°, 30° és 40°C, ami minden kategóriában körülbelül 5,5°C-kal magasabb, mint a spórák esetében. P. triticina. A szárrozsda a tenyészidőszak végén, a későn vetett és érő búzafajtákon, valamint az alacsonyabb tengerszint feletti magasságokban jelentősebb. A tavaszi vetésű búza különösen veszélyeztetett a magasabb szélességi fokokon, ha az inokulumforrások a széllel szemben találhatók. Észak-Amerika déli síkságain nagy területeken fordul elő őszi vetésű búza, amely inokulumot biztosít az északi tavaszi vetésű búzának. A meleg, nedves éghajlaton a szárrozsda különösen súlyos lehet, mivel a betegség kialakulásához kedvező feltételek hosszú ideig fennállnak, ha helyi inokulumforrás áll rendelkezésre.
A szárrozsda abban különbözik a levélrozsdától, hogy hosszabb harmatperiódust igényel (hat-nyolc óra szükséges). Ezenkívül sok penetrációs csap nem fejlődik ki az appresszoriumból, hacsak nem stimulálják legalább 10 000 lux fénysugárral három órán keresztül, miközben a növény a harmatperiódus után lassan kiszárad. A maximális fertőzés 18 °C-on 8-12 órán át tartó harmattal érhető el, amelyet 10 000+ lux fény követ, miközben a harmat lassan megszárad és a hőmérséklet 30 °C-ra emelkedik (Rowell, 1984). A fény ritkán korlátozó tényező a szántóföldön, mivel a harmat gyakran reggel jelentkezik. Kevés fertőzést eredményez azonban, ha az esti harmatot és/vagy esőt szél követi, amely napfelkelte előtt kiszáradást okoz. Az üvegházban gyakran a csökkent fényviszonyok az okai a gyenge fertőzési aránynak. A fény hatása valószínűleg inkább a növényre, mint a gombarendszerre van hatással, mivel a levél fonákjába injektált urediniospórák sikeres gombás behatolást eredményeznek anélkül, hogy a fény a gombát érné. A szárrozsda urediniumai mind a levél-, mind a szárfelszíneken, valamint a levélhüvelyeken, a tüskéken, a bibéken, a levélnyélen és még a szemeken is előfordulnak.
Egy szárrozsdapusztulat (uredinium) naponta 10 000 urediniospórát képes termelni (Katsuya és Green, 1967; Mont, 1970). Ez több, mint a levélrozsdáé, de a fertőzőképesség alacsonyabb, mivel tízből csak körülbelül egy csíracsíra eredményez sikeres fertőzést. A szárrozsda urediniumai, mivel főként a szár és a levélhüvely szövetén vannak, gyakran tovább maradnak életben, mint a levélrozsda urediniumai, amelyek gyakrabban a levélkékre korlátozódnak. A betegség növekedési üteme a két betegség esetében nagyon hasonló.
A szárrozsda urediniospórák meglehetősen ellenállóak a légköri viszonyokkal szemben, ha nedvességtartalmuk mérsékelt (20-30 százalék). A nagy távolságra történő szállítás évente (800 km) az észak-amerikai síkságokon keresztül (Roelfs, 1985a), majdnem évente (2000 km) Ausztráliából Új-Zélandra (Luig, 1985) és az elmúlt 75 évben legalább háromszor (8 000 km) Kelet-Afrikából Ausztráliába (Watson és de Sousa, 1983) történik.
Az eciospórák a búza szárrozsdájának inokulumforrása is lehetnek. Történelmileg ez Észak-Amerikában, valamint Észak- és Kelet-Európában volt fontos. Ezt az inokulumforrást általában megszüntették vagy nagymértékben csökkentették a közönséges vagy európai borbolya eltávolításával (Berberis vulgaris) a búzamezők közelségéből. Az aeciospórák az urediniospórákhoz hasonlóan fertőzik a búzát.
Házigazdák
A búza, az árpa, a tritikálé és néhány rokon faj az elsődleges gazdanövénye a következőknek: búzafélék, árpa, tritikálé és néhány rokon faj. P. graminis f. sp. tritici. A közeli rokon kórokozó azonban, P. graminis f. sp. secalis, a legtöbb árpán és néhány búzán (pl. E vonal) virulens. Puccinia graminis f. sp. secalis képes megtámadni az Sr6 és Sr11 vonalú E gazdaháttérben (Luig, 1985). A természetben az elsődleges alternatív gazdaszervezet B. vulgaris L., egy Európában őshonos faj, bár üvegházi vizsgálatok során más fajok is fogékonyak voltak rá. Az alternatív gazdanövények általában fogékonyak a következő fajok összes vagy egyik formae speciales-ére sem P. graminis.
Alternatív házigazdák
A fő alternatív gazdatest a P. graminis a B. vulgaris, amelyet az ember terjesztett el az északi félteke északi szélességein. Felálló, bokros, sok éles tüskével ellátott növekedése miatt kiváló sövényt alkotott a szántóföldek határai mentén. Fája hasznos volt szerszámnyelek készítéséhez, a kéregből festékanyagot, gyümölcséből pedig lekvárt készítettek. Az Európából Észak-Amerikába érkező telepesek magukkal hozták a borbolyát. A borbolya az emberekkel együtt nyugat felé is elterjedt, és Pennsylvaniától a keleti Dakotán át dél felé, Kansas északkeleti részéig honosodott meg. A Berberis, Mahonia és Mahoberberis számos faja érzékeny a következőkre P. graminis (Roelfs, 1985b). A kanadai vagy alleghenyi borbolya, B. canadensis, fel kell venni erre a listára.
Az alternatív gazdaszervezet volt a kórokozó virulencia és agresszivitás új génkombinációinak fő forrása (Groth és Roelfs, 1982). A kórokozó variációjának mennyisége megnehezítette, ha nem lehetetlenné tette a rezisztencia nemesítését. Az egyik évben jelenlévő virulencia-kombinációk közül sokan a következő évben nem ismétlődtek meg, de sok új kombináció jelent meg (Roelfs, 1982). A szezon elején a borbolya volt az inokulum (aeciospórák) forrása. A fertőzött bokrok általában közel voltak az előző szezon gabonaföldjeihez, így az inokulum rövid távolságokat tett meg anélkül, hogy a hosszú távú szállítással járó számbeli és életképességi veszteséget szenvedett volna el. Egyetlen nagy borbolyabokor néhány hét alatt 64 x 109 eciospórát képes termelni (Stakman, 1923). Ez napi 20 millió uredinia termelésének felel meg egy 400 m2 -es területen.
A berkenye a szárrozsda inokulum fő forrása volt Dániában (Hermansen, 1968) és Észak-Amerikában (Roelfs, 1982). A szárrozsdajárványok Észak-Európában és Észak-Amerikában a búzaföldek mellől eltávolított árpádsáv eltávolítását követő sikeres visszaszorítása valószínűleg ahhoz vezetett, hogy túlhangsúlyozták ennek az alternatív gazdának a szerepét az éves járványok kialakulásában máshol.
Ellenállás a P. graminis a oldalon. Berberis a jelentések szerint abból ered, hogy a kórokozó nem képes közvetlenül áthatolni a kemény kutikulán (Melander és Craigie, 1927). A Berberis vulgaris körülbelül 14 nappal a levelek kibontása után válik ellenállóvá a fertőzéssel szemben. A fertőzések azonban a bogyókon, a töveken és a szárakon is előfordulnak, ami arra utal, hogy a kutikula keménysége nem olyan fontos, mint eredetileg gondolták. Az alternatív gazdanövényekkel végzett legújabb vizsgálatok során különösen a következő fajtáknál figyeltek meg túlérzékeny reakciót Berberis spp. (Mahonia).
Életciklus
A világ legtöbb területén a fák életciklusa P. graminis f. sp. tritici folyamatos uredinális generációkból áll. A gomba a levegőben terjedő urediniospórákkal terjed egyik búzanövényről a másikra és szántóföldről szántóföldre. Az elsődleges inokulum származhat helyileg (endemikus) önkéntes növényekből, vagy a szél által nagy távolságra szállított (exodémiás) és eső által lerakott inokulum. Észak-Amerikában a P. graminis évente legfeljebb 90 nap alatt 2 000 km-t tesz meg a déli téli búzaféléktől a legészakibb tavaszi búzafélékig, és az uredinális ciklusban a telet a tengerszinten legalább az ÉSZ 35°-ig képes túlélni. A hó fedezéket nyújthat, amely alkalmanként lehetővé teszi P. graminis az őszi búzán még az ÉSZ 45°-on tapasztalt súlyos fagypont alatti hőmérsékleten is képes fertőzésként túlélni (Roelfs és Long, 1987). Az ivaros ciklus ritkán fordul elő, kivéve az Egyesült Államok csendes-óceáni északnyugati részén (Roelfs és Groth, 1980) és Európa helyi területein (Spehar, 1975; Zadoks és Bouwman, 1985). Bár az ivaros ciklus nagy genetikai változatosságot eredményez (Roelfs és Groth, 1980), a gyakori recesszív virulencia-gének (Roelfs és Groth, 1988) és az agresszivitás génjeinek átrendeződése miatt nagyszámú olyan egyedet is létrehoz, amelyek kevésbé alkalmasak. Puccinia graminis sikeresen kifejlesztett egy aszexuális szaporodási stratégiát, amely nyilvánvalóan lehetővé teszi a gomba számára, hogy a szükséges géneket olyan blokkokban tartsa fenn, amelyeket időnként mutáció és szelekció módosít.
Az Urediniospórák csírázása optimális hőmérsékleten (13.2. táblázat) szabad víz jelenlétében egy-három órán belül megkezdődik. A nedvességnek vagy harmatidőszaknak kedvező hőmérsékleten hat-nyolc órán át kell tartania ahhoz, hogy a spórák kicsírázzanak és csíracsövet és appresszóriumot hozzanak létre. A látható fejlődés az appressorium-stádiumban leáll, amíg legalább 10 000 lux (optimális esetben 16 000 lux) fény nem áll rendelkezésre. A fény serkenti a penetrációs csíra kialakulását, amely a zárt sztómába hatol. Ha a csíranövény a csírázási időszak alatt kiszárad, a folyamat visszafordíthatatlanul leáll. A behatolási folyamat körülbelül három órán át tart, ahogy a hőmérséklet 18 °C-ról 30 °C-ra emelkedik (Rowell, 1984). A fertőzés fényigénye miatt a P. graminis sokkal nehezebben kezelhető az üvegházban, mint a P. recondita. Valószínűleg a fénynek ritkán van hatása a szántóföldön, kivéve, ha a harmatperiódusok hajnal előtt eloszlanak.
Az urediniospórák pustulákban (uredinia) fejlődnek, amelyek felszakítják az epidermiszt, és vörösesbarna spórák tömegét hozzák felszínre. Az urediniospórák nagyobbak, mint a levélrozsdáé, ovális vagy hosszúkás alakúak, a szélükön laza vagy szakadt epidermiszszövettel (16. tábla). Az urediniospórák vörösesbarna, elliptikus vagy tojás alakú, 24-32 µm x 18-22 µm méretű echinuláris struktúrák (17. lemez).
Ahogy a gazdaszervezet érik, a telia (18. lemez) közvetlenül az urediniospóra fertőzésekből keletkezik, vagy a teliospórák egy érett uredinialis pustulában termelődhetnek. A teliospórák sötétbarna kétsejtűek és kissé ék alakúak. Vastag falúak, és 40-60 µm x 18-26 µm méretűek. Az apikális sejt lekerekített vagy enyhén hegyes (19. lemez). A teliospórák dikarióta (n + n), és tavaszig a szalmával együtt maradnak. Ez idő alatt bekövetkezik a kariogámia, és a teliospórák diploiddá (2n) válnak. A tavaszi esők és a kedvező hőmérséklet hatására a teliospóra kicsírázik, a meiózis lezajlik, és négysejtű bazídiumot hoz létre. Minden egyes sejtből egy stigma keletkezik egyetlen haploid bazidiospórával (1n). A hialin bazidiospórát a szél rövid távolságokra (méterekre) szállítja az árpádsávos bokorba. A bazidiospórák csíráznak és közvetlenül behatolnak. A maximális fertőzéshez a borbolya levélszövetének két hétnél fiatalabbnak kell lennie. A bazidiospórával való fertőzés a pícium (1n) képződését eredményezi. A pycnium befogadó hifákat és egyetlen párosodási típusba tartozó (+ vagy -) pycniospórákat termel, amelyek a gomba női és hímivarsejtjeiként szolgálnak. Az egyik párosodási típus pükniospóráit át kell helyezni az ellenkező párosodási típus receptív hifáira az aeciospórák fejlődésének elindításához. A pükniospórák átvitelét gyakran rovarok végzik, amelyeket a püknium által termelt, szivárgó pükniális nektár vonz. A + és - típusok párosodását elősegítheti a fröccsenő eső, a levelek ecsetelése, a nagyobb állatok és a szomszédos fertőzések összeolvadása is. Az aeciospórák dikariotikusak (n + n), és a megtermékenyülést követő hét-tíz nap elteltével általában a borbolyalevelek alsó felületén lévő aeciákban termelődnek. Az aeciospórák genetikai rekombináció termékei, és virulenciájuk és agresszivitásuk különbözhet egymástól. A variáció mértéke a szülői izolátumok közötti különbségektől függ. A Puccinia graminis f. sp. tritici-t keresztezték más formae specialisokkal, és a P. graminis f. sp. secalis-szal való keresztezések viszonylag termékenyek voltak (Johnson, 1949). Ausztráliában bizonyítékok utalnak a búza szárrozsda és a szikarozsda rekombinációjára (P. graminis f. sp. secalis) (Burdon et al., 1981; Luig és Watson, 1972).).
Az aeciospórák hidroszkópikusan szabadulnak ki az aeciákból, és a levegőben méteres, de akár néhány kilométeres távolságokra is eljutnak a búzához. Az aeciospóráknak az urediniospórákhoz hasonló körülményekre van szükségük a fertőzéshez. Az aeciospórákkal való fertőzés dikarióta (n + n) urediniumok keletkezését eredményezi urediniospórákkal. Az ismétlődő aszexuális ciklusban aztán az urediniospórák optimális körülmények között körülbelül 14 napos ciklusban urediniákat termelnek. Szabadföldi körülmények között, ahol a hőmérséklet nagymértékben változik, a ciklus meghosszabbodhat vagy lerövidülhet. Általában az alacsonyabb hőmérséklet a szántóföldön, legalábbis a termesztési ciklus korai szakaszában, általában meghosszabbítja a látens időszakot. Észak-Indiában 31 napos látens időszakot jegyeztek fel a szárrozsdára (Joshi és Palmer, 1973).
Forrás: A búza rozsdásodik: R.P. Singh, J. Huerta-Espino, A.P. Roelfs
Puccinia gramnis fertőzési modell
Puccinia graminis fertőzések zajlanak után:
- Néhány órás levélnedvesség optimális hőmérsékleti körülmények között. A gomba széles hőmérséklet-tartományban képes fertőzni.
- A modell feltételezi, hogy a fertőzéshez 80°C-os felhalmozott óránkénti léghőmérsékletre van szükség a levélnedvességhez a 10°C és 35°C közötti léghőmérséklet-tartományban. Valamivel magasabb hőmérsékletet kedvel, mint P. tritici és a fertőzést napfénynek kell követnie.
Levélnedvesség 80°C-os felhalmozott óránkénti átlaghőmérséklet esetén, amelyet fényes időszak (150 W/m²) követ 30°C-os felhalmozott óránkénti átlaghőmérséklet esetén.
- (ha T <= 24°C akkor ∑(Th) egyébként ∑ Th-24
- 10°C < Temp. < 35°C
Az FieldClimate-ben P. graminis a fertőzést a fent leírt feltételek mellett számították ki (zöld vonal). Az 100% fertőzés megjelenésekor a körülmények kedvezőek voltak a gomba számára, és növényvédelmi mérést (gyógyító) kell figyelembe venni.
Sárga rozsda
A búza csík- vagy sárga rozsdája, amelyet a következők okoznak P. striiformis f. sp. tritici ugyanolyan káros lehet, mint a szárrozsda. A csíkrozsdának azonban alacsonyabb az optimális fejlődési hőmérséklete, ami a világ számos területén korlátozza a betegség elterjedését. A csíkrozsda elsősorban télen vagy kora tavasszal, illetve magasabban fekvő területeken a búza fontos betegsége.
A búza csíkrozsdája okozhatja az árpa csíkrozsdáját (Stubbs, 1985). Európában a forma specialis a P. striiformis alakult ki, amely az árpán általánosan, és csak ritkán a legérzékenyebb búzaféléken fordul elő (Zadoks, 1961). Puccinia striiformis f. sp. hordei Dél-Amerikába került, ahol elterjedt az egész kontinensen (Dubin és Stubbs, 1986), majd később Mexikóban és az Egyesült Államokban is azonosították (Roelfs et al., 1992).
Epidemiológia
Puccinia striiformis a három búzarozsda-kórokozó közül a legalacsonyabb hőmérsékletigényű. A csíkrozsdafertőzés minimális, optimális és maximális hőmérséklete 0 °C, 11 °C és 23 °C (Hogg és mtsai., 1969). Puccinia striiformis gyakran aktívan telelhet át az őszi vetésű búzán. A legtöbb járványügyi munkát Európában végezték, és a közelmúltban Zadoks és Bouwman (1985) és Rapilly (1979) áttekintette.
Európában, P. striiformis a búzán túlszaporodók (Zadoks, 1961). A túlnyári rozsda mennyisége az önkéntes búza mennyiségétől függ, ami viszont a szezonon kívüli nedvesség függvénye. A kovászos-iniospórák ezután az őszi vetésű búzára fújódnak. Északnyugat-Európában az áttelelés az élő levélszövetekben lévő urediniomyceliumokra korlátozódik, mivel a -4°C-os hőmérséklet elpusztítja a szabadon lévő spórás elváltozásokat. A látens léziók túlélhetik, ha a levél túléli. A világ más területein a hó elszigetelheti a sporuláló elváltozásokat a hideg hőmérséklettől, így a -4°C alatti levegő hőmérséklete nem pusztítja el a rozsdaváltozásokat. A csíkrozsda látenciaideje télen akár 118 nap is lehet, hótakaró alatt pedig feltételezhetően 150 nap is lehet (Zadoks, 1961).
Az Egyenlítőhöz közeli területeken a csíkrozsda hajlamos arra, hogy endémiásan ciklikusan az alacsonyabb magasságokból a magasabbakra kerüljön, és a termés fenológiáját követve visszatérjen (Saari és Prescott, 1985). Az északabbra fekvő szélességi körökben a ciklus hosszabbá válik, a csíkrozsda a hegyvidéki területekről a hegylábak és a síkságok felé mozog.
Az ultraibolya fényre való érzékenységük miatt a csíkrozsda urediniospórái valószínűleg nem szállítódnak olyan messzire életképes állapotban, mint a levél- és szárrozsdáké. Maddison és Manners (1972) a csíkrozsda urediniospóráit háromszor érzékenyebbnek találta az ultraibolya fényre, mint a szárrozsdáéit. Zadoks (1961) mégis arról számolt be, hogy a csíkrozsdát a szél több mint 800 km-t szállította életképes állapotban. A búza csíkrozsdájának Ausztráliába és Dél-Afrikába, valamint az árpa csíkrozsdájának Kolumbiába történő behurcolását valószínűleg az ember segítette a sugárhajtással (Dubin és Stubbs, 1986; O'Brien? et al., 1980). A csíkrozsda Ausztráliából Új-Zélandra történő, 2 000 km távolságot jelentő elterjedése azonban valószínűleg a levegőben terjedő urediniospórák révén történt (Beresford, 1982). Lehet, hogy a csíkrozsda átlagos spóráinak kisebb a valószínűsége arra, hogy életképes állapotban nagy távolságokra a levegőben terjedjenek, mint a többi búzarozsda esetében, de bizonyos, hogy néhány spórának különleges és kedvező körülmények között képesnek kell lennie a hosszú távú szállítás túlélésére. A csíkrozsda szekvenciális vándorlására több példa is van. Az Yr2 gén virulenciáját (Siete Cerros, Kalyansona és Mexipak fajták) először Törökországban jegyezték fel, majd egy idő után az indiai és pakisztáni szubkontinensre is eljutott (Saari és Prescott, 1985), és a "nyugati zavarnak" nevezett időjárási rendszerekkel hozható összefüggésbe. Mint említettük, az árpa csíkrozsdája Dél-Amerikában néhány év alatt Kolumbiából Chilébe vándorolt (Dubin és Stubbs, 1986).
A világ legtöbb vizsgált területén úgy tűnik, hogy az önkéntes búzából származó inokulum helyi vagy közeli forrása van (Line, 1976; Stubbs, 1985; Zadoks és Bouwman, 1985). Néhány bizonyíték azonban arra utal, hogy az inokulum nem gabonafélékből származó fűfélékből származik (Hendrix és mtsai., 1965; Tollenaar és Houston, 1967). A csíkrozsda járványtanának jövőbeli vizsgálatai során nemcsak a rozsda jelenlétét kell figyelembe venni a közeli fűfélékben, hanem azt is, hogy a rozsdának a gabonaféléken való megjelenése előtt a fűfélékben kell megjelennie. A virulenciafenotípusról be kell mutatni, hogy mindkét gazdaszervezeten azonos, és hogy a növény szezonja során a fűből a búzába kerül.
Hollandiában a csíkrozsda-járványt hektáronként egyetlen uredinium is okozhatja, amely túléli a telet, ha a tavaszi időszak kedvező a rozsda fejlődéséhez (Zadoks és Bouwman, 1985). A hektáronként egyetlen uredinium vizuális észlelése valószínűtlen, azonban ahogyan a kezdeti uredinium körül fókuszok alakulnak ki, egyre könnyebbé válik az észlelés.
Házigazdák
Puccinia striiformis a fűfélék és a gabonafélék - búza, árpa, tritikálé és rozs - kórokozója. A csíkrozsda a búza egyetlen olyan rozsdája, amely következetesen a növényen belül a kezdeti fertőzési ponton túl is terjed.
Alternatív házigazdák
A csíkrozsdának csak a telialis és uredinialis stádiuma ismert. Eriksson és Henning (1894) a Boraginaceae fajok között kereste a váltógazdát. Tranzschel (1934) azt javasolta, hogy Aecidium valerianella, a valerianella rozsda, kapcsolatban állhat a következőkkel P. striiformis. Mains (1933) úgy vélte, hogy P. koeleriae Arth., P. arrhenatheri Eriks. és P. montanensis Ellis, amelyek a Berberis és Mahonia spp. fajokon aecidialis állapotot mutatnak, kapcsolatban állhatnak a P. striiformis.
Straib (1937) és Hart és Becker (1939) sikertelenül próbálták megfertőzni a Berberis, Mahonia és Valerianella spp. A rozsda alternatív gazdája, P. agropyri Ell. & Ev., az Clematis vitalba. Ez a rozsda nagyon hasonlít P. striiformis Viennot-Bourgin (1934) ezért azt javasolta, hogy a csíkrozsda alternatív gazdanövénye a Clematis családban fordulhat elő. A telioszpórák azonnal kicsíráznak, hogy bazidiospórákat termeljenek (Wright és Lennard, 1980), és a telioszpórák valószínűleg nem segítik a gombát téli túlélési mechanizmusként. Járványügyi szempontból figyelembe kell venni az alternatív gazdaszervezet késő nyári fertőzésének lehetőségét, így az aeciospórák megfertőzhetik az újonnan vetett búzát vagy a késői hűvös évszakú fűféléket. Nyugat-Ázsia egyes magasan fekvő területein a búzatermés érése 13 hónapig is eltarthat. Ilyen esetekben a kora tavaszi szezonban lehetséges az alternatív gazdaszervezet fertőzése.
Életciklus
Puccinia striiformis valószínűleg egy hemiform rozsda, mivel úgy tűnik, hogy az életciklus csak az uredinialis és a telialis szakaszokból áll. Az urediumok keskeny, sárga, lineáris csíkokban fejlődnek, főként a leveleken és a tüskéken (20. tábla). Amikor a fejek fertőzöttek, a pustulák a levélkék és a levélkék belső felületén jelennek meg (21. tábla). Az urediniospórák sárgától narancssárgáig terjedő színűek, többé-kevésbé gömb alakúak, echinulárisak és 28-34 µm átmérőjűek (22. tábla). A leveleken a telialis fejlődés során keskeny fekete csíkok alakulnak ki. A teliospórák sötétbarnák, kétsejtűek, méretükben és alakjukban hasonlítanak a következő fajokéhoz P. triticina (23. tábla). A csíkrozsda-populációk létezhetnek, virulenciájuk változhat, és járványokat okozhatnak alternatív gazdától függetlenül. A búza egyetlen ismert inokulumforrása az uredinospórák, amelyek hűvösebb hőmérsékleten csíráznak és fertőznek.
Forrás: A búza rozsdásodik: R.P. Singh, J. Huerta-Espino, A.P. Roelfs
Puccinia striiformis Fertőzési modell
Puccinia striiformis a hűvös éghajlatú területek búzarozsdája, amelynek optimális hőmérséklete már 15 °C-tól kezdődik. Fertőzése néhány órás levélnedvesedés után, optimális hőmérsékleti viszonyok között történik. A gomba széles hőmérséklet-tartományban képes fertőzni. A modell feltételezi, hogy a fertőzéshez 80°C-os felhalmozott óránkénti léghőmérsékletre van szükség a levélnedvességhez az 5°C és 20°C közötti léghőmérséklet-tartományban. Alacsony fényintenzitású időszakokban nincs fertőzés.
A levélnedvesség és a fény a 80°C-os felhalmozott óránkénti átlaghőmérsékletre vonatkozóan
- (ha T
- 5°C < Temp. < 20°C
Az FieldClimate-ben a fertőzés P. striiformis augusztus 23-án látható, egy hosszú levélnedves időszak után, 15 °C körüli hőmérsékleten (piros vonal). A fertőzés után gyógyító növényvédelmi stratégiákat kell figyelembe venni (szisztémás), míg a fertőzés 100% elérését megelőzően védekező alkalmazásra kerülhet sor.
Fusarium head blight
A fuzáriumos fejfoltosságot vagy az apró szemű gabonafélék rücskösödését a következő gomba okozza Fusarium graminearum (Schwabe), bár Hollandiából és Közép-Európa más területeiről a F. culmorum mint a legelterjedtebb faj (Snidjers, 1989). Lengyelországban, F. culmorum, F. graminearum és F. nivale hasonló közepes vagy súlyos virulenciaszintet mutattak ki, míg a F. avenaceum közepesen vagy közepesen virulensnek bizonyult. A kórokozó azonosítására irányuló számos vizsgálatban azonban a kórokozót okozó szervezetet, akár 18 Fusarium spp. izolálták és azonosították (Mihuta-Grimm és Foster, 1989; Reis, 1985).
A cikket írta L. Gilchrist, H.J. Dubin A rühatka a meleg, nedves régiókban gyakori, ahol a virágzás egybeesik az esős időszakokkal. A betegség előfordulása az elmúlt tíz évben különböző okok miatt egyre nőtt. Talán a legfontosabb ok az, hogy megnőtt az a terület, ahol a búzát kukoricával vagy más gabonafélékkel váltogatják. További okok a talajvédelmi célú termesztési rendszerben bekövetkezett változások, valamint a búza termesztésének változása a hagyományos termesztésről a nedvesebb, nem hagyományos területekre (Gilchrist et al., 1997).
A fuzáriumos rühatka világszerte súlyos termésveszteséget okoz, amely akár az 50 százalékot is elérheti. Hasonlóképpen, Paraguayban az 1972-es és 1975-ös időjárási körülmények kedveztek a Fusarium- és Septoria-járványoknak, amelyek együttesen akár 70 százalékos veszteséget is okozhattak (Viedma, 1989). Lengyelország, Hollandia, az Egyesült Királyság, a volt Csehszlovákia, az Oroszországi Föderáció, Franciaország és Ausztria - néhány európai ország, amely a varasodás előfordulását jelentette. Az amerikai kontinensen Kanada, az Egyesült Államok, Mexikó, Guatemala, Brazília, Ecuador, Uruguay és Argentína területeit nagymértékben érinti a Fusarium (Ireta és Gilchrist, 1994).
A varasodás jelentős termés- és minőségi károkat, valamint mérgezéseket okozhat az állatokban és az emberekben (Ireta és Gilchrist, 1994; Baht és mtsai., 1989; Luo, 1988; Snidjers, 1989; Marasas és mtsai., 1988). Az Egyesült Államokban a varasodás okozta károkat 1993-ban több mint $1 milliárd USD-re, 1994-ben pedig $500 millió USD-re becsülték. Kínában a becslések szerint a varasodás akár 7 millió hektárt is érinthet, és 2,5 millió tonna gabona veszhet el a járványos években. A fuzáriás mikotoxinnal kapcsolatos emberi megbetegedéseket Kínából, Indiából és Japánból jelentettek, míg állatoknál a világ számos pontjáról jelentettek betegségeket (Dubin és mtsai., 1997).
Ma már világszerte léteznek a mikotoxinokra vonatkozó szabályozások (Van Egmond és Dekker, 1995). Sok országban azonban nem alkalmazzák a szabályozást, és sokan, különösen a vidéki emberek, mindenféle ellenőrzés nélkül fogyasztják a gabonát, akár gabonaszemek formájában, akár közvetett formában, a szennyezett gabonával etetett állatokból származó hús formájában. A 16.1. táblázat a sertésekre és baromfikra gyakorolt főbb hatásokat mutatja be, amelyeket az alábbiakban felsorolt fontosabb toxinok váltanak ki Fusarium fajok.
A fejés és az érés közötti nedves és meleg időjárási körülmények fokozzák a varasodás súlyosságát. A F. graminearum behatolási pontja a tüske, különösen a virágszervek. Ez hatással van a magkötésre és a szemtöltésre. A fertőzött tüskék gyorsan veszítenek klorofillt és fakó színűvé válnak. Később rózsaszínűvé vagy barackszínűvé válnak, különösen a levélkék tövénél és széleinél (41. tábla). Ha a környezeti feltételek kedvezőek maradnak, a fertőzés átterjed a szomszédos tüskékre, és egyes esetekben az egész tüskét megfertőzheti, beleértve a vesszőt és annak szárát is. Ha a fertőzés súlyos, a károsodott szemeket micéliummal borítják be, és rózsaszínű, pelyhes massza megjelenését veszik fel. Ha a betegség mértéke mérsékelt, a szemek fonnyadtak, kis tömegűek és fehéres színűek lehetnek (sírköves szemek).
Az egyes Fusarium fajok által termelt fontosabb toxinok által a sertésekre és baromfikra gyakorolt főbb toxikus hatások
| Mikotoxin | Klinikai tünetek |
| Zearalenon | Duzzadt, vörös szeméremtest; hüvelyprolapsus sertéseknél; szopós malacoknál a szeméremtest megnagyobbodása; termékenységi problémák. |
| Vomitoxin (dezoxinivalenol, DON) | Csökkent takarmányfelvétel és súlygyarapodás a sertéseknél, ha a DON-t >2 mg/kg takarmányt kaptak; hányás; a takarmány visszautasítása nagyon magas DON-koncentráció esetén (>20 mg/kg takarmány)a |
| Egyéb trichotecének T-2 toxin HT-2 toxin Diacetoxyescirpenol> | Mérgezőbb, mint a DON; csökkent takarmányfelvétel; hányás; bőr- és gyomor-bélrendszeri irritáció; neurotoxicitás; abnormális utódok; fokozott betegségérzékenység; vérzés. |
| Ocharatoxin | Elsősorban a vesék proximális tubulusait érinti sertésben és baromfiban; a vesék durván megnagyobbodtak és sápadtak; baromfiban a máj zsírosodik. |
amg/kg = milliomodrész (ppm).
Forrás: Trenholm et al., 1984.
Fusarium graminearum (42. tábla) a búzanövényeket minden növekedési szakaszban megtámadhatja, magonc-, szár- és gyökérrothadásos betegségeket okozva. Az elsődleges fertőzések aszkozospórákból vagy makrokonídiumokból származhatnak, amelyek a levélkékre és az extrudált porzókra rakódnak le. A 10° és 30 °C közötti hőmérséklet és a 95 százalék feletti relatív páratartalom 40-60 órán keresztül általában elegendő ahhoz, hogy a makrokonídiumok sikeresen megfertőzzék a tüskéket (Ireta, 1989).
Fusarium graminearum egyike azon kevés Fusarium olyan faj, amely szabadföldi körülmények között peritéciákat termel (43. tábla, 44. tábla). A peritéciák a Gibberella zeae nevű gomba ivaros stádiumát képviselik, és a búzaszemeken termelődnek. A peritéciumok fontos szerepet játszanak a kórokozó évről évre történő túlélésében (Khonga és Sutton, 1988), és az előző termés maradványaiban lévő micéliumokkal együtt léteznek, és így képezik a varasodás kezdeti inokulumforrását. A Kínában végzett kutatások kimutatták, hogy a peritéciák termelődéséhez a legalacsonyabb hőmérséklet 7 °C és 10 °C között, a legmegfelelőbb pedig 15 °C és 20 °C között van. A peritéciák termelődéséhez a talaj legalacsonyabb nedvességtartalma 50-60 százalék, a legmegfelelőbb pedig 70-80 százalék volt (Wang, 1997).
A betegség kialakulását meghatározó tényezők közé tartozik az éghajlat, az inokulumszint és a búza növekedési szakasza. A búzarozsda-járványok elsősorban az elsődleges inokulum mennyiségétől függenek, nem pedig a másodlagos inokulumtól. Az invázió főként a virágzás időszakában következik be. A másodlagos fertőzés konídiumokkal (45. tábla) a beteg tüskéknek a szántóföldön való megjelenése után következik be.
A növényi maradványok és a termesztési gyakorlatok fontos szerepet játszanak a F. graminearum és következésképpen járványok. A kukoricamaradványokkal borított szántóföldre vetett búzán a fertőzés kétszer-háromszor súlyosabb lehet (Teich és Nelson, 1984). Általában a kórokozó csak rizs-búza vetésforgóban lévő rizstáblákon és Kína száraz vetésű területein lévő kukoricaszárakon volt szaprofita (Wang, 1997). Ha a maradékot beszántják, a peritéciumok túlélése csökken, és ez csökkenti az elsődleges inokulumforrást (Reis, 1989).
Fusarium graminearum fakultatív parazita, és számos más fűfélén, köztük a közönséges gyomnövényeken és gabonaféléken (rozs, rizs, árpa és tritikálé) is kórokozó. Ha az olyan gyakorlatok, mint a nem gazdanövényekkel való vetésforgó vagy a növényi maradványok kezelése, önmagukban nem hatékonyak, kombinálva csökkenthetik az elsődleges inokulum forrását. A betegség elleni védekezés hatékonyan az integrált kezelésen alapul, beleértve a megfelelő agronómiai gyakorlatokat, a rezisztens vagy toleráns fajták használatát és a vegyszeres alkalmazásokat.
Fuzáriumos fejfoltosság biológiája
Alkalmi kórokozók
Az FHB-t a Fusarium nemzetségbe tartozó gombafajok okozzák. Az FHB-t leggyakrabban okozó faj a Fusarium graminearum (szexuális szakasz - Gibberella zeae). Ez a gomba ugyanaz, amely gyakran a kukoricaszár rothadásával is összefüggésbe hozható. Egy másik Fusarium az FHB-t okozó faj Fusarium culmorum. Mindkét F. graminearum és F. culmorum szintén okozhat gyökérrothadást a kis szemeknél. Az árpán két másik Fusarium fajok, F. poae és F. avenaceum, szintén okozhat magfoltosságot.
Túlélés és terjedés
A gomba megmarad és elszaporodik a fertőzött apró szemű gabonafélék és kukorica termésmaradványain. Nedves időjárás esetén a gomba spóráit a szél elfújja vagy a gabonafélék fejére szórja. A spórák származhatnak a terményből, vagy a környező terményekből, néha nagy távolságokra is elfújhatják őket. A búza és a durumnövények a virágzási (beporzási) időszaktól a magfejlődés kemény tésztás szakaszáig fogékonyak a fertőzésre. A kórokozó gomba spórái a virágzás idején a szabadon lévő porzókon landolhatnak, majd a magokba, a búzaszemekbe vagy a fej egyéb részeibe fejlődhetnek. A tavaszi árpa esetében, amely akkor virágzik, amikor a fej a csizmában van, a fertőzés a virágzás után a leggyakoribb, amint a fej áttöri a levélhüvelyt. A fertőzés bármelyik kultúrában folytatódhat egészen a szemérésig, amennyiben a szervezet(ek) számára kedvezőek a környezeti feltételek.
A fertőzéshez a legkedvezőbb feltételeket a magas páratartalom és a meleg hőmérséklet (75-85 Fahrenheit fok (24°C-30°C)) jelenti. A fertőzés azonban hűvösebb hőmérsékleten is előfordul, ha a magas páratartalom 72 óránál hosszabb ideig fennáll. A korai fertőzések levegőben terjedő spórákat termelhetnek, amelyek felelősek a betegség másodlagos terjedéséért, különösen akkor, ha a növény a késői kelés miatt egyenlőtlenül virágzik.
Mivel az FHB kialakulása a virágzástól (árpában a fej megjelenésétől) a magok fejlődéséig tartó időszakban a kedvező környezeti feltételektől függ, a betegség előfordulása és súlyossága évről évre változik. A legsúlyosabb termés- és minőségi veszteségekhez a következő tényezők kombinációja vezethet: a bőséges inokulum, a virágzás (árpában a fej megjelenése) és a magfejlődés közötti hosszabb vagy ismétlődő nedves és magas páratartalmú időszakok, valamint a nagyon fogékony fajták használata.
Fusarium head blight fertőzési modell
A búzán a Fusarium head blight komplexhez tartozó gombakórokozókról ismert, hogy a 20 °C és 30 °C közötti meleg hőmérséklet és a hosszú párás időszakok kedveznek nekik. A többnapos levélnedves időszakok korai látható szeptómákhoz vezetnek. A tünetek azonban hosszabb lappangási idő után is jelentkezhetnek, ha a fertőzést 18 órás vagy még rövidebb levélnedves időszak követi. A tünetek 15 °C-os mesterséges beoltás után is jelentkezhetnek.
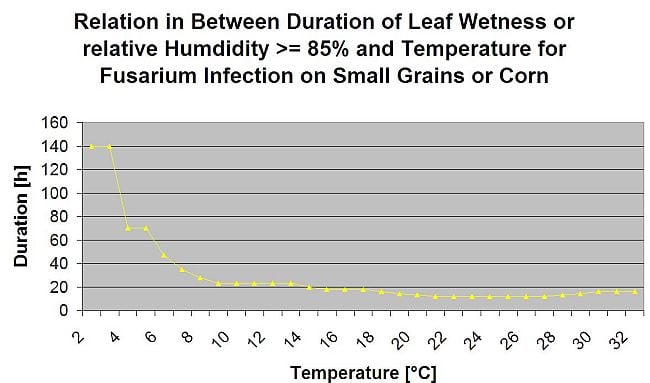


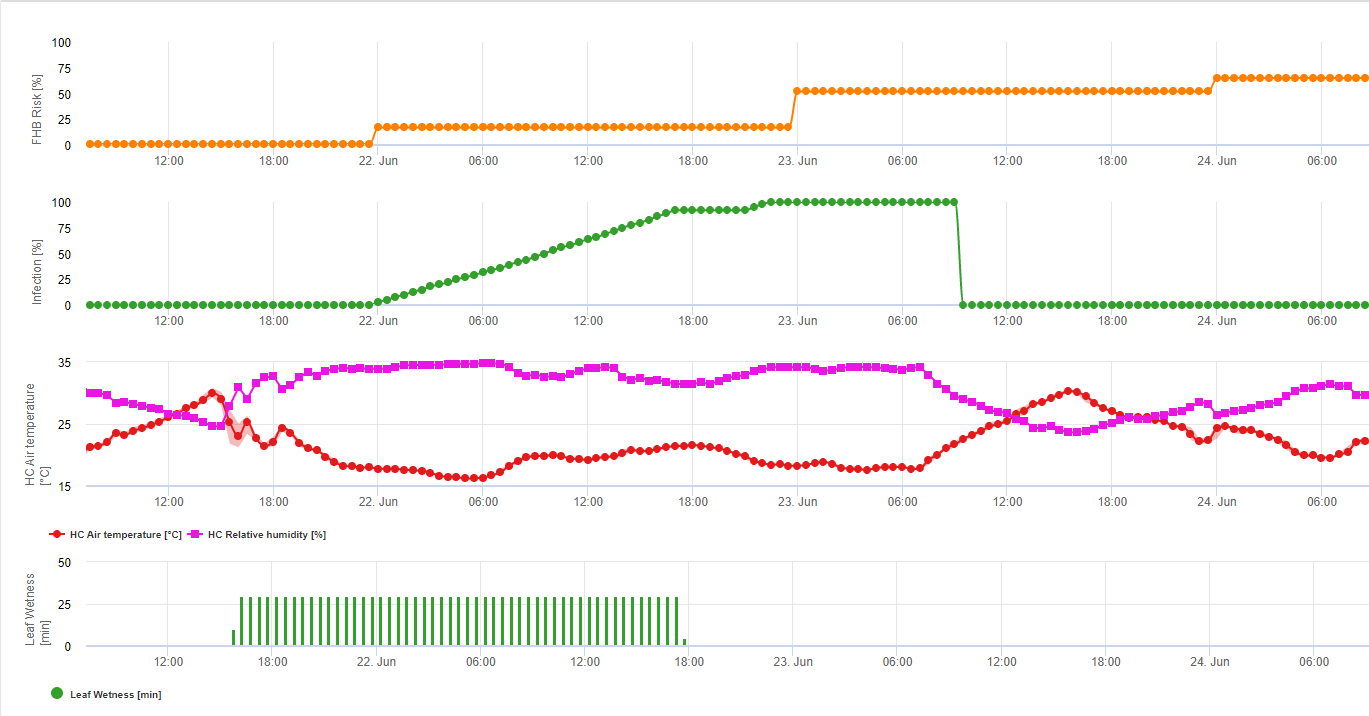
Összefoglalva a szakirodalomban talált különböző hőmérséklet- és nedvességkombinációkat, úgy döntöttünk, hogy a Fusarium head bligh fertőzésre akkor mutatunk rá, ha a hőmérséklet és a levélnedvesség, illetve a 85%-nél nagyobb relatív nedvességtartalmú időszakok meghaladják a következő grafikonon látható értékeket.
A fertőzéseket 2 mm-es eső indítja el. Fuzáriumos fejfoltosság fertőzésről akkor beszélhetünk, ha a fertőzés előrehaladási értéke eléri az 100% értéket. A fertőzés előrehaladási értékének kiszámítása a fenti grafikonon látható, a nedves körülmények időtartama és a hőmérséklet közötti összefüggést követi.
Ezt a modellt a fertőzéses napok és az éghajlati viszonyok megjelenítésére használják az éghajlat alatt. A termelők ismerete a különböző búzafajták fejlődési stádiumáról lehetőséget ad arra, hogy a fertőzés után azonnal döntsenek a gyógyító permetezés alkalmazásáról.
Fuzárium mikotoxin riasztás
A Fusarium fejfoltosság hosszan tartó levélnedvességgel járó fertőzési kísérletek magas mikotoxin-tartalomhoz vezettek. Ezen információk alapján a 61. és 69. stádiumban 48 órás vagy annál hosszabb levélnedvesedési időszak feltételezhetően magas mikotoxin kockázatot jelent. A DON-analízisek során a kereskedelemben termesztett búzában szerzett tapasztalatok azt mutatták, hogy a 61-69. stádiumban bekövetkező kezdeti fertőzést követő, a fertőzéshez elég hosszú levélnedvesedési időszakok a DON-értékeket is növelhetik. Hosszabb levélnedvesedési időszakok esetén a mikotoxinok mennyisége a 85. stádiumig növekedhet. Az FieldClimate a fertőzés előrehaladásával arányos kockázati értéket halmoz fel minden egyes sikeres fertőzési időszakon keresztül az e számításokhoz megfelelőnek választott időszak alatt. 6 éppen lezajlott fertőzési időszak 100% kockázatot eredményezne. A fuzáriumfertőzéshez vezető levélnedvesedési időszak általában hosszabb, mint a minimálisan szükséges. Ezért a legtöbb fuzáriumfertőzés 17%-nél nagyobb kockázatnövekedést eredményez. A problémás mikotoxin helyzetre utaló kockázati érték a szántóföldi előzményektől függ. A talajművelés nélküli kukorica után termesztett búza vagy a talajművelés nélküli kukorica után termesztett talajművelés nélküli búza csak akkor hordozhat kis kockázatot, ha nem az optimális helyzetben permetezik. A nem permetezett búzában már 35% kockázat után megnövekedett DON értékekkel kell számolnunk. A kukoricán vagy búzán kívüli egyéb kultúrát követő nem talajművelő búza után a búzánál magasabb, 50% kockázatot hordozhat. Ha kukorica vagy talajműveléses búza után van búza, akkor a kockázat 70%-ig terjedhet. Az elsőéves búzát DON-tesztnek kell alávetni, ha a kockázat meghaladja az 100% értéket.
1) Fuzáriumos fejfoltosság kockázati modell amely kiszámítja a fertőzés kockázatos időszakait. Amikor az 100% fertőzés (zöld vonal) elérte a kockázat (kék vonal) nagyon magas, és a gomba számára kedvezőek voltak a fertőzéshez szükséges feltételek. Az alkalmazási módtól függően (gyógyító, megelőző) a kockázatos időszakot a kék vonal mutatja.
2) Fuzáriumos fejfoltosság: ebben a modellben az FHB fertőzését a csapadék (2 mm szükséges), a relatív páratartalom (85% felett) vagy a levélnedvesség, a hőmérséklet alapján számítják ki a folyamat során. Ha a fertőzés eléri az 100% értéket, akkor a gombakórokozó számára optimális feltételek valósultak meg. A továbbiakban a modell kiszámítja az FHB mikotoxin kockázatát.
Pettyes levélfoltosság
A búzában két fő Septoria-betegség létezik. Ezek a Septoria tritici foltosság, amelyet a gomba okoz. Septoria tritici (teleomorf: Mycophaerella graminicola), és Septoria nodorum a Septoria nodorum (teleomorf: Leptosphaeria nodorum) gomba által okozott foltosság. Mindkét betegség súlyos terméskiesést okoz, amely a jelentések szerint 31-53 százalék között mozog (Eyal, 1981; Babadoost és Herbert, 1984; Polley és Thomas, 1991). Világszerte több mint 50 millió hektárnyi, főként a csapadékban gazdag területeken termesztett búza érintett. Az elmúlt 25 év során ezek a betegségek egyre terjedtek, és bizonyos területeken a búzatermesztés egyik fő korlátozó tényezőjévé váltak. Súlyos járványok esetén a fogékony búzafajták magjai összezsugorodnak, és nem alkalmasak őrlésre. A Septoria tritici foltosság és a Septoria nodorum foltosság járványai kedvező időjárási körülményekhez (gyakori esőzések és mérsékelt hőmérséklet), különleges termesztési gyakorlatokhoz, az inokulum elérhetőségéhez és a fogékony búzafajták jelenlétéhez kapcsolódnak (Eyal et al., 1987).
Septoria spp. Biológia
Erick De Wolf után, Septoria Tritici Blotch, Kansasi Állami Egyetem, 2008. április Septoria tritici foltos levélfoltosság néven ismert foltosság, amelyet a gomba okoz. Septoria tritici. A világ valamennyi búzatermő vidékén elterjedt, és számos régióban komoly problémát jelent. A Septoria tritici foltosság akkor a legkártékonyabb, amikor a betegség a szezon végén a fogékony fajták felső leveleit és fejét támadja meg.
Tünetek
Septoria tritici a foltosság tünetei először ősszel jelennek meg. A kezdeti tünetek kis sárga foltok a leveleken. Ezek a sérülések az öregedés során gyakran világosbarnára színeződnek, és a gombák termőtestei a levélnyélen lévő sérülésekbe ágyazódva láthatók. A sérülések szabálytalan alakúak, és az elliptikustól a hosszú és keskenyig terjednek (1. ábra). A sérülések apró, kerek, fekete pöttyöket tartalmaznak, amelyek a gomba termőtestjei. A fekete termőtestek úgy néznek ki, mint a fekete borsszemek, és általában nagyító nélkül is láthatóak. A betegség az alsó leveleken kezdődik, és fokozatosan halad előre a zászlóslevél felé. A levélhüvelyek is fogékonyak a támadásra. Csapadékos években a pettyes levélfoltosság gomba átvándorolhat a fejekre, és barna elváltozásokat okozhat a levélkéken és a levélnyélen, az úgynevezett levélfoltosságot. Ezek az elváltozások az öregedés során gyakran világosbarnára színeződnek, és a gombák termőtesteit gyakran látni a levélnyélen lévő elváltozásokba ágyazódva.
A levélfoltosság fázisa jelentős terméskiesést okozhat, de a betegség súlyossága és a terméskiesés közötti kapcsolat nem jól ismert. Septoria tritici a foltosság összetéveszthető más levélbetegségekkel, amelyeknek nagyon hasonló tünetei vannak: a barnafoltosság és az Stagonspora nodorum foltos, például. Gyakori, hogy a növényeket több ilyen lombbetegség is megfertőzi, és laboratóriumi vizsgálatra lehet szükség annak pontos diagnosztizálásához, hogy melyik betegség a legelterjedtebb. Szinte mindig laboratóriumi vizsgálatra van szükség a levélfoltosság okának megkülönböztetéséhez. A faj ismerete nem fontos a permetezési döntések szempontjából, mivel mindhárom betegség hasonlóan reagál a fungicidekre. Azonban annak ismerete, hogy mely betegségek a legelterjedtebbek, fontos része a fajtaszelekciónak, mivel különböző gének szabályozzák a betegségekkel szembeni ellenállást.
A Septoria tritici foltosságot a legmegbízhatóbban a fekete termőtestek jelenléte alapján lehet megkülönböztetni a többi betegségtől. A barnafoltosságot okozó gomba nem termel ilyen típusú szaporodási struktúrát. A Stagonospora nodorum foltosságot okozó gomba azonban nedves körülmények között világosbarna termőtesteket hoz létre. A színkülönbségen kívül ezek a struktúrák kisebbek is, mint a Septoria tritici által termeltek.
Életciklus
Septoria tritici a nyarat átvészeli az előző búzatermés maradványain, és ősszel fertőzést indít. Bizonyos bizonyítékok vannak arra, hogy a gomba más fűgazdákkal és búzamagvakkal társulva is képes túlélni. A gomba ezen forrásai valószínűleg akkor a legfontosabbak, amikor a búzamaradványok hiányoznak. A vetésforgótól vagy a maradványkezelési gyakorlattól függetlenül általában elegendő inokulum áll rendelkezésre az őszi fertőzések elindításához. Septoria tritici a foltosságnak kedvez a hűvös, nedves időjárás. Az optimális hőmérsékleti tartomány 16 és 21 °C között van; a téli hónapokban azonban akár 5 °C-os hőmérsékleten is előfordulhat fertőzés. A fertőzéshez legalább 6 órán át tartó levélnedvesedés szükséges, és a maximális fertőzéshez akár 48 órán át tartó nedvesség is szükséges. A fertőzés után a gombának 21-28 napra van szüksége ahhoz, hogy kifejlődjenek a jellegzetes fekete termőtestek, és új spóratermést hozzon létre. Az ezekben a termőtestekben termelődő spórák ragacsos tömegben válnak ki, és esőre van szükségük ahhoz, hogy a felső levelekre és a fejekre fröccsenjenek.
Fertőzés Septoria tritici
Püknidiospórák a S. tritici szabad vízben csíráznak a spóra mindkét végéből vagy az interkaláris sejtekből (Weber, 1922). A spórák csírázása csak a levéllel való érintkezés után kb. 12 órával kezdődik. A csíracsövek véletlenszerűen nőnek a levél felületén. Weber (1922) csak az epidermális sejtek közötti közvetlen behatolást figyelte meg, mások azonban arra a következtetésre jutottak, hogy a nyitott és zárt sztómákon keresztül történő behatolás a gazdaszervezetbe való behatolás elsődleges módja (Benedict, 1971; Cohen és Eyal, 1993; Hilu és Bever, 1957). Kema és munkatársai (1996) csak sztómás penetrációt figyeltek meg. A sztómákon keresztül növekvő hifák körülbelül 1 μm átmérőre szűkülnek, majd a szubszomatális üreg elérését követően kiszélesednek.
A levél felszínével párhuzamosan, a levél epidermális sejtjei alatt, majd a mezofillumon keresztül az alsó epidermisz sejtjeihez nőnek, de nem az epidermiszbe. Nem képződnek haustóriumok, és a hifák növekedését az érkötegek körüli szklerenchimasejtek korlátozzák, kivéve, ha a hifák nagyon sűrűek. Az érkötegek nem hatolnak be. A hifák intercellulárisan nőnek a sejtfalak mentén a mezofillumon keresztül, a szeptumnál vagy a sejt közepén elágazva. Körülbelül 9 napig nem jelentkeznek makroszkópos tünetek, kivéve egy-egy elhalt sejtet, de a mezofill sejtek 11 nap után gyorsan elpusztulnak. A piknídiumok a szubszomatális kamrákban fejlődnek. A hifák ritkán nőnek be a gazdasejtekbe (Hilu és Bever, 1957; Kema et al, 1996; Weber, 1922).
A sikeres fertőzés csak legalább 20 óra magas páratartalom után következik be. Csak néhány barna folt alakult ki, ha a levelek a spórák lerakása után 5-10 órával (Holmes és Colhoun, 1974) vagy akár 24 órán át (Kema és mtsai., 1996) nedvesek maradtak. A gazdatest-parazita viszony a rezisztens és a fogékony búzákon azonos. A spórák csírázása a levélfelületen a fogékonyságtól függetlenül azonos. A sikeres behatolások száma nagyjából azonos, de a fogékony fajtákban gyorsabb a levéltetvek növekedése, ami több elváltozást eredményez. A hifák minden kultúrában a nekrotikus területen túlra terjednek 44 2. ülésszak - B.M. Cunfer. A patogenezisben szerepet játszhat egy toxin (Cohen és Eyal, 1993; Hilu és Bever, 1957). Ezzel szemben egy rezisztens vonalon a kolonizáció jelentősen csökkent (Kema és mtsai., 1996).
A gabonafélék Stagonospora (Septoria) és Septoria kórokozói: A fertőzési folyamat
B.M. Cunfer, Növénykórtani Tanszék, University of Georgia, Griffin, GA
A fertőzés folyamata legintenzívebben a Stagonospora (Septoria) nodorum és a Septoria tritici. Egy mélyreható tanulmány a Septoria passerinii rendelkezésre áll. A bejelentett információk szinte mindegyike a piknidiospórák általi fertőzésre vonatkozik. A fertőzés folyamata azonban más spóraformák esetében meglehetősen hasonló. A bemutatott információk többnyire a levelek optimális körülmények közötti fertőzésére vonatkoznak. Néhány vizsgálatot ép csíranövényekkel, míg másokat leválasztott levelekkel végeztek. A búza koleoptiliumának és csíranövényének fertőzése a S. nodorum Baker (1971) részletesen leírta, és Cunfer (1983) felülvizsgálta. Bár pontos összehasonlításokat nem végeztek, úgy tűnik, hogy a fertőzési folyamat sok hasonlóságot mutat az egyes gazdatest-parazita rendszerekben, és számos nekrotróf kórokozóra jellemző. A tünetek kialakulását és a betegség kifejeződését befolyásoló tényezőkről nincs információ, de más szerzők már áttekintették őket (Eyal et al., 1987; King et al., 1983; Shipton et al., 1971). A levélfelületen lévő spórák élettartamát befolyásoló tényezők összefoglalása szerepel.
A Cirrus szerepe és a spórák túlélése a levélfelületen A piknídiumból kinyert piknídiumspórákat burkoló cirrus funkciójáról a legrészletesebb információk a következőkre vonatkoznak S. nodorum. A cirrus egy fehérje- és szacharidvegyületekből álló gél. Összetétele és funkciója hasonló a Sphaeropsidales más gombákéhoz (Fournet, 1969; Fournet és mtsai., 1970; Griffiths és Peverett, 1980). A cirrus komponensek elsődleges szerepe a piknidiospórák védelme a kiszáradástól és a korai csírázás megakadályozása.
A cirrus védi a piknidiospórákat, így néhányuk legalább 28 napig életképes marad (Fournet, 1969). Ha a cirrus oldatot vízzel hígították, és a cirrus oldat koncentrációja >20% volt, a piknidiospórák kevesebb, mint 10% csírázott ki. Alacsonyabb koncentrációban az összetevők olyan tápanyagokat biztosítanak, amelyek serkentik a spórák csírázását és a csíracsövek megnyúlását. A csíracsövek hossza 15% cirrus koncentrációig nőtt, majd magasabb koncentrációknál mérsékelten csökkent (Harrower, 1976). Brennan és munkatársai (1986) híg cirrus folyadékban nagyobb csíraképződésről számoltak be. A cirrus komponensek 10-60% relatív páratartalomnál csökkentették a csírázást. Miután a spórák szétszóródtak, a cirrus folyadék stimuláló hatása valószínűleg elhanyagolható (Griffiths és Peverett, 1980).
35-45% relatív páratartalom mellett a spórák a S. tritici a cirriben legalább 60 napig életképes maradt (Gough és Lee, 1985). A cirri összetevői a spórák csírázásának gátlójaként hathatnak, vagy a cirri magas ozmotikus potenciálja megakadályozhatja a csírázást. A püknidiospórák a S. nodorum nem maradtak életben 24 órán keresztül 80% feletti relatív páratartalom mellett 20 C-on. A spórák két hétig vagy tovább éltek <10% relatív páratartalom mellett (Griffiths és Peverett, 1980). Amikor a cirrus folyadék a S. nodorum vízzel hígították, a piknidiospórák mintegy kétharmada 8 órán belül elvesztette életképességét, és 30 óra nappali fényben töltött idő után csak 5% csírázott. Amikor a spórákat sötétben tárolták, 40% 30 óra elteltével is életképes maradt (Brennan és mtsai., 1986).
Száraz konídiumok S. nodorum, árnyékban és közvetlen napfényben legalább 56 órán át éltek a szabadban (Fernandes és Hendrix, 1986a). A S. nodorum piknídióspórák csírázását folyamatos UV-B sugárzás (280-320 nm) gátolta, míg a S. nodorum piknídióspórák csírázását a S. tritici nem volt. A csíracsövek kiterjedése folyamatos UV-B sugárzás mellett mindkét gomba esetében gátolt volt a sötétben történő növekedéshez képest (Rasanayagam és mtsai., 1995).
Fertőzés Septoria nodorum által
A gazdaszervezet behatolásának és fejlődésének folyamata S. nodorum a levélen belül több kutató is részletesen vizsgálta (Baker és Smith, 1978, Bird és Ride 1981, Karjalainen és Lounatmaa, 1986; Keon és Hargreaves, 1984; Straley, 1979; Weber, 1922). A piknidiospórák általában két epidermális sejt közötti mélyedésekben rakódnak le, és sok levélbehatolási kísérlet ott kezdődik. A spórák a szabad nedvesség hatására a levél felszínén csíráznak (Fernandes és Hendrix, 1986b). Csírázásuk a lerakódás után 2-3 órával kezdődik, és 8 óra elteltével a csírázóképesség elérheti a 90%. A levélpenetráció körülbelül 10 órával a spórák lerakódása után kezdődik (Bird és Ride, 1981; Brönnimann és mtsai., 1972; Holmes és Colhoun, 1974).
A csírázás kezdetén a csíracsövet egy amorf anyag veszi körül, amely a levélhez tapad. A spóra mindkét végéből és az interkaláris sejtekből kinövő csíracsövek általában a sejtek közötti mélyedések mentén nőnek, és gyakran a levél hossztengelye mentén helyezkednek el (O'Reilly és Downes, 1986). A nem a mélyedésekben lévő spórákból származó hifák véletlenszerűen nőnek, esetenként elágazással (Straley, 1979). Appresszórium képződik egy fertőzési pálcikával, amely áthatol az epidermális sejtek kutikuláján és periklinális falán közvetlenül a sejtlumenbe, ami gyors sejthalált eredményez.
Sok behatolás először szubkutikuláris vagy oldalsó növekedés történik a sejtfalon belül, mielőtt a növekedés a citoplazmába történik (Bird és Ride, 1981; O'Reilly és Downes, 1986). A nyitott és zárt sztómákon keresztül történő behatolás is előfordul, és gyorsabb lehet, mint a közvetlen behatolás (Harrower, 1976; Jenkins, 1978; O'Reilly és Downes, 1986; Straley, 1979). A csíracsövek a sztómáknál és az epidermális sejtek csomópontjainál ágaznak el. A csíracső behatolása egy sztómába appresszorium kialakulása nélkül is megtörténhet. A behatolás néha a trichomákon keresztül történik (Straley, 1979). Úgy tűnik, a legtöbb behatolási kísérlet sikertelen, a behatolási kísérlet helyén a sejtekben sűrű papillák képződnek (Karjalainen és Lounatmaa, 1986; Bird és Ride, 1981).
A behatolás után az epidermális sejtek gyorsan elhalnak és elszarusodnak, a hifák pedig a mezofillumba nőnek. A mezofill sejtek eldeformálódnak, és a lignifikálódott anyag néhány sejten kívül rakódik le, amelyek ezután összeesnek. A lignifikáció még azelőtt bekövetkezik, hogy a hifák elérnék a sejtet. A folyamat minden fajtában ugyanúgy zajlik, de az ellenálló fajtákban lassabban fejlődik. A hifák intercellulárisan nőnek az epidermális sejtek között, majd a mezofillumba. A mezofillumba való behatoláskor a kloroplasztiszok pusztulása 6-9 nap alatt kezdődik (Karjalainen és Lounatmaa, 1986).
A fotoszintetikus sebesség azonban a fertőzést követő egy napon belül csökkenni kezd, mielőtt a tünetek láthatóvá válnának (Krupinsky és mtsai., 1973). Az érkötegek körüli szklerenchimaszövet megakadályozza az érszövet fertőzését. Az érkötegek megakadályozzák a hifák terjedését a mezofillumon keresztül, kivéve, ha a szklerenchimaszövet fiatal és nem teljesen kialakult (Baker és Smith, 1978).
A Stagonospora nodorum sejtfalbontó enzimek széles skáláját szabadítja fel, beleértve az amilázt, pektin-metilészterázt, poligalakturonázt, xilanázt és cellulázt in vitro és a búzalevelek fertőzése során (Baker, 1969; Lehtinen, 1993; Magro, 1984). Az enzimek által végzett sejtfallebontással kapcsolatos információk megegyeznek a szövettani megfigyelésekkel. ezek az enzimek toxinokkal együtt is működhetnek. Az enzimérzékenység összefügghet a rezisztenciával és a gombakolonizáció sebességével (Magro, 1984). Sok nekrotrófhoz hasonlóan a Septoria és Stagonospora kórokozók is termelnek fitotoxikus vegyületeket in vitro. A sejtek károsodása és elhalása a mezofillszövetbe történő hipófális növekedés előtt (Bird és Ride, 1981) összhangban van a toxintermeléssel. A toxinoknak a fertőzési folyamatban betöltött végleges szerepét és a gazdaszervezet rezisztenciájával való kapcsolatát azonban nem állapították meg (Bethenod és mtsai, 1982; Bousquet és mtsai, 1980; Essad és Bousquet, 1981; King és mtsai, 1983). A búzára és árpára adaptált törzsek közötti gazdanövénytartománybeli különbségek a S. nodorum a toxintermeléssel függhet össze (Bousquet és Kollmann, 1998). A spórák csírázásának megindulását és a csírázott spórák százalékos arányát nem befolyásolja a gazdaszervezet fogékonysága (Bird és Ride, 1981; Morgan 1974; Straley, 1979; Straley és Scharen, 1979; Baker és Smith, 1978).
Bird és Ride (1981) arról számolt be, hogy a csíracsövek kiterjedése a levélfelületen lassabban terjedt a rezisztens, mint a fogékony fajtákon. Ez a mechanizmus, amely legalább 48 órával a spórák lerakódása után fejeződik ki, a csíracsövek megnyúlásának behatolás előtti rezisztenciájára utal. A rezisztens fajtákon kevesebb sikeres behatolás történt, és a behatolás lassabban haladt a rezisztens fajtákon (Baker és Smith, 1978; Bird és Ride, 1981). A lignifikáció a fertőzés korlátozására javasolták mind a rezisztens, mind a fogékony kultúrákban, de más tényezők lassították a gomba fejlődését a rezisztens vonalakban. A fogékony vonalakon a gyorsabban növekvő hifák elkerülhetik a gazdasejtek lignifikációját.Négy nappal az árpa beoltása után egy búza biotípusú izolátummal történő beoltás után az S. nodorum, a hifák a kutikulán és néha az epidermális sejtfalak külső cellulózrétegén keresztül nőttek. A penetrációs hifák alatt vastag papillák rakódtak le, és a sejtekbe nem hatoltak be (Keon és Hargreaves, 1984).
Fertőzés Septoria passerinii által
Green és Dickson (1957) részletes leírást ad a fertőzés folyamatáról a S. passerinii árpán. A fertőzés folyamata hasonló a S. tritici. A S. triticihez hasonlóan a levélbe való behatoláshoz szükséges idő jelentősen hosszabb, mint a S. tritici esetében. S. nodorum. A csíracsövek véletlenszerűen ágaznak el és nőnek a levél felszínén, de néha az epidermális sejtek közötti mélyedések mentén is. A levélbe való behatolás szinte kizárólag a sztómákon keresztül történik. A csírázó hifák megduzzadnak, és ha a behatolás sikertelen, a hifák tovább nyúlnak. A spórák lerakódása után 48 órával nem történik behatolás. 72 óra elteltével a csíracsövek megvastagodnak a sztómák fölött, az őrsejtek között és a járulékos sejtek urfáján, valamint a szubszomatális üregekbe nőnek. Közvetlen behatolás az epidermális sejtek között csak ritkán figyelhető meg.
A spórák csírázása és a gazdaszervezetbe való behatolás azonos a rezisztens és a fogékony fajtákon. A rezisztens fajtákon a leveleken belül sokkal kevésbé terjednek ki a levélhifák, és sok, de nem minden sejtfalon megfigyelhetőek papillák. A hifák az epidermisz alatt nőnek egyik sztómától a másikig, de nem hatolnak be az epidermisz sejtjei közé. A mezofil kolonizálódik, de nem képződnek haustóriumok. Miután a mezofill sejtek nekrotikussá válnak, az epidermális sejtek összeesnek. A levélben a micéliumfejlődés ritkás, és általában az érkötegek elzárják. Fiatalabb leveleken, ha az érhüvely kevésbé fejlett, a hifák a köteg és az epidermisz között haladnak át. A piknídiumok a szubszomatális üregekben képződnek, többnyire a levél felső felületén (Green és Dickson, 1957).
A spórák élettartamát befolyásoló tényezők a levélfelületen A gabonafélék Stagonospora- és Septoria-kórokozói közül a fertőzési folyamatról csak a következőkre vonatkozóan közöltek végleges információkat S. nodorum, S. tritici, és S. passerinii. Számos más nekrotróf kórokozóhoz hasonlóan a kórokozók egyik csoportja sem vált ki túlérzékenységi reakciót. A Septoria és a Stagonospora kórokozók közötti fertőzési folyamat jelentős különbsége az, hogy a spórák csírázása és behatolása sokkal gyorsabban megy végbe a Septoria és a Stagonospora kórokozók esetében. S. nodorum mint a S. tritici és S. passerinii. Ez jelentős hatással van a betegség járványtanára.
A Septoria-kórokozók elsősorban a sztómákon keresztül hatolnak be a növénybe, míg a S. nodorum közvetlenül és a sztómákon keresztül is behatol. S. nodorum behatol és gyorsan elpusztítja az epidermális sejteket, de a S. tritici és a S. passerinii nem pusztítják el az epidermális sejteket, amíg a levél mezofillumán át nem ágaznak a hifák, és meg nem kezdődik a gyors nekrózis. A gazdaszervezetbe való behatolást követő gombanövekedés szövettani vizsgálatai megfelelnek a gazdaszervezet rezisztenciájára vonatkozó járványtani vizsgálatokból származó adatoknak. A rezisztencia lassítja a gazdaszervezet kolonizációjának sebességét, de nincs számottevő hatása az elváltozás kialakulásának folyamatára.
A gazdaszervezet válaszát irányító mechanizmusok - akár enzimek és toxinok, akár a kórokozók által a fertőzés során felszabaduló egyéb metabolitok - még mindig nem tisztázottak. Az aszkospórák általi fertőzésről kevés információ áll rendelkezésre. A fertőzési folyamat valószínűleg nagyon hasonló a piknídiumspórákéhoz. A Phaeosphaeria nodorum aszkospórái a hőmérséklet széles tartományában csíráznak, és csíracsövük közvetlenül behatol a levélbe. Rapilly és munkatársai (1973) szerint azonban az aszkospórák a piknídióspórákkal ellentétben nem csíráznak szabad vízben.
Septoria spp. fertőzési modell
A Septoria-fertőzés alacsony hőmérsékleten lehetséges, míg a 7 °C alatti hőmérséklet 2 napon belül nem feltétlenül vezet fertőzéshez. A betegség optimális hőmérséklete 16 és 21°C között alakul ki. A fertőzések a magas relatív páratartalom vagy a 14 órás vagy annál hosszabb levélnedvesség esetén lehetségesek. A feltételek teljesítése érdekében úgy döntöttünk, hogy a gyenge, közepes és súlyos fertőzésre vonatkozó modelleket különítjük el. Gyenge fertőzés akkor adható, ha a kórokozó képes megfertőzni a gazdaszövetet. Ez azt jelenti, hogy gyenge fertőzésre akkor kerülhet sor, ha a hőmérséklet a minimumon van, és a levélnedvesség kritikus időtartamú. Mérsékelt fertőzésre olyan körülmények között kerül sor, ahol a legtöbb fertőzési kísérlet elfogadható eredményre vezet, súlyos fertőzésre pedig olyan körülmények között kerül sor, ahol a kórokozónak optimálisak a fertőzési feltételei.
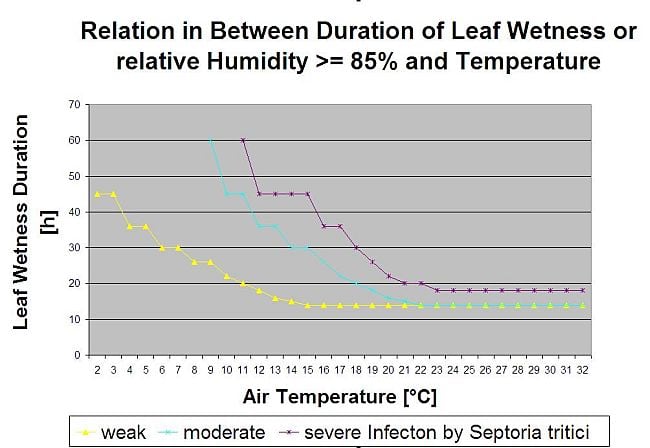


A fertőzés elkezdődik 0,5 mm eső után. Úgy döntöttünk, hogy nem használunk modellt a piknídiumképződésre. A piknídiumképződéshez szükséges feltételnek a 85%-nél magasabb relatív nedvességtartalmú időszakot feltételeztük. A piknídiumok élettartamát 24 órára becsüljük. Minden olyan éghajlaton, ahol a Septoria triticinek esélye van a fertőzésre, szinte minden nap napfelkelte körül 2 órát találunk, amely megfelel ennek a feltételnek.
A fertőzés súlyosságának értékelése
Ahhoz, hogy a Septoria tritici fertőzési nyomást a 10. stádium (az első levél átmérője a koleoptiliumon) és a 32. stádium (a második csomópont legalább 2 cm-rel az első csomópont felett), valamint a 32. és 51. stádium (a fejés kezdete) között fel tudjuk mérni, a fertőzések súlyosságát az éghajlati viszonyok alapján kell értékelnünk. Ezt az értékelést 1-5-ig terjedő skálán végezzük. Az 1-es súlyossági fokozatot akkor kapjuk, ha a gyenge fertőzés feltételei teljesülnek, és 5 mm-nél kevesebb eső esett, ellenkező esetben a megfelelő súlyossági fokozat 2 lesz. A 3-as súlyossági fokozatot akkor kapjuk, ha a közepes fertőzés teljesül, és kevesebb mint 5 mm eső esett. Ha a mérsékelt fertőzés során több mint 5 mm eső esett, vagy kevesebb mint 5 mm eső esett a súlyos fertőzés során, akkor 4-es súlyossági fokozatot kapunk.
Az 5 mm-nél több csapadékkal járó súlyos fertőzés 5-ös súlyossági értéknek felel meg.
Septoria tritici a betegség nyomásának értékelése
Az éghajlat csak az egyik tényező, amely meghatározza a betegségnyomást a szántóföldön. A másik két tényező a termőterület története és a termesztett fajta fogékonysága. Ha a betegség súlyossági értékeit a 10. stádiumtól a 32. stádiumig 4-es értékre tudjuk felhalmozni, akkor az éghajlat által okozott gyenge betegségnyomásra számíthatunk. Ha ez az érték eléri a 6-os értéket, akkor mérsékelt betegségnyomásra számíthatunk, ha pedig eléri a 10-es értéket, akkor magas betegségnyomásra számíthatunk az éghajlat részéről. A fajta fogékonyságának és a termőhely előzményeinek ismeretében ebben a helyzetben gyenge vagy mérsékelt betegségnyomás esetén permetezzünk vagy ne permetezzünk. A 10-es kumulált érték mindenképpen a 32-es stádiumban történő permetezéshez vezethet. A későbbi stádiumban történő permetezésről szóló döntés inkább a tavaszi éghajlattól függ. Ha a 10. stádium óta a súlyossági értékeket 6-os értékre tudjuk felhalmozni, akkor gyenge betegségnyomásra számíthatunk. Ha ez az érték eléri a 10-es értéket, akkor mérsékelt betegségnyomásra számíthatunk, ha pedig ez az érték eléri a 15-ös értéket, akkor az éghajlati helyzetből adódóan magas betegségnyomásra számíthatunk.
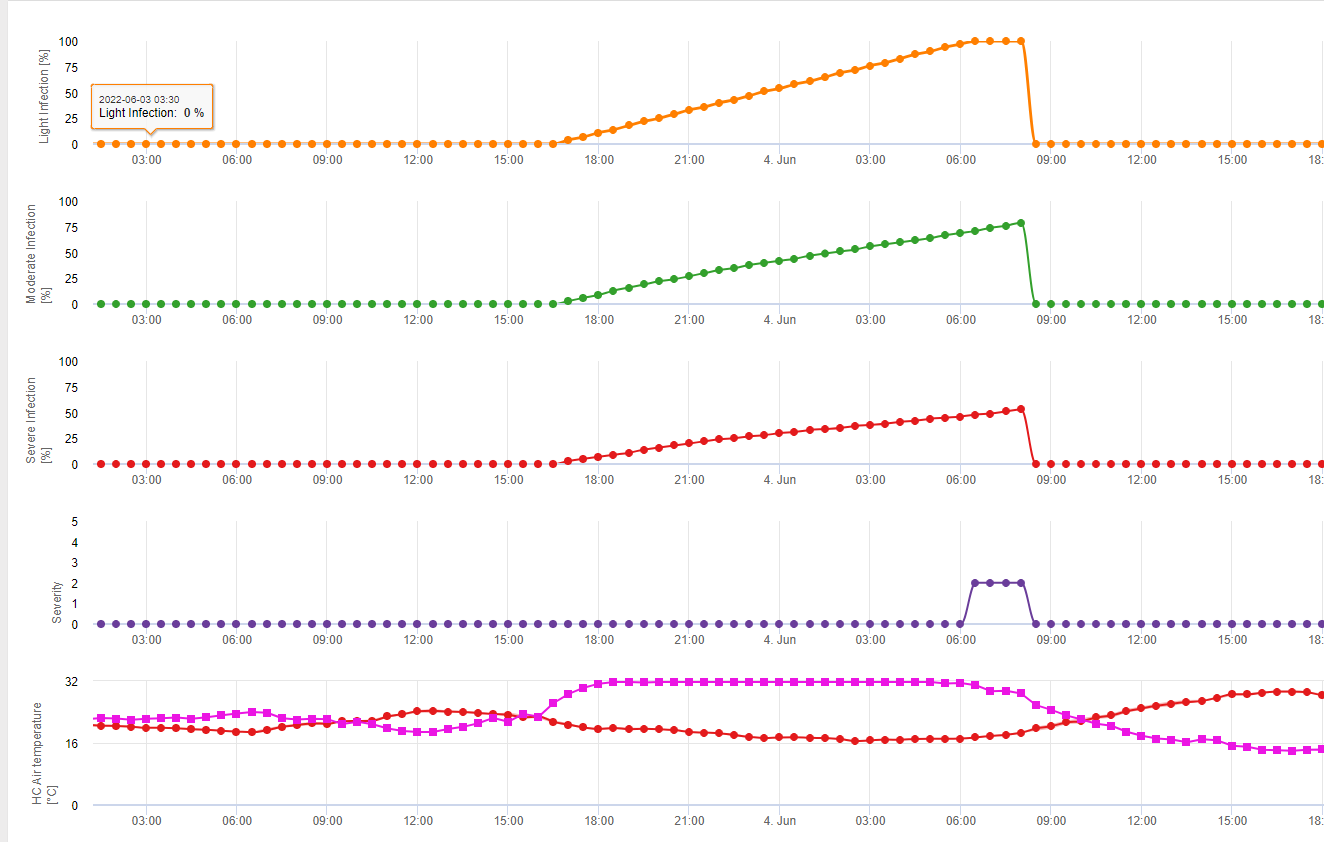
Az FieldClimate-ben megmutatjuk a Septoria tritici Súlyosság a három különböző fertőzési súlyossággal együtt egy grafikonon (lásd fent). A csapadék és a hosszú levélnedvesedési időszakok miatt a súlyos fertőzés feltételei a következőkkel biztosítottak S. tritici május 14-én és 16-án már teljes mezőny volt. A súlyossági szintek május 14-én érik el a legmagasabb, 5-ös értéket, ami azt jelenti, hogy most magas a fertőzésveszély.
A Stagonospora nodorum fertőzésbiológiája bizonyos mértékben eltér a S. tritici fertőzésbiológiájától, de ez a különbség nem elég nagy ahhoz, hogy külön modellt alkossunk. Ezért azt javasoljuk, hogy ezt a modellt a gabonafélék Stagnospora és Septoria betegségeinek teljes komplexumára használjuk, beleértve a következőket is S. passerinii. S. tritici és S. passerinii általában hosszabb levélnedvesítési időszakot igényelnek, mint S. nodorum. A magas nyomású területeken S. nodorum A 2-es súlyossági értéket adó gyenge osztályba sorolt fertőzéseket súlyosabban kell kezelni, mint más területeken.
A oldalon. Septoria nodorum a kockázati modell az FieldClimate-ben látható (lásd fent). A június 17-i és a július 7-i (100%) találkozón magas kockázatot állapítottak meg. A fertőzésre fogékony növény stádiumától függően növényvédelmi intézkedéseket kell figyelembe venni, ha a kockázat eléri a 80% értéket (lásd még időjárás-előrejelzés, növényvédelmi védekezés). Ha a kockázat 100% és a fertőzést már megállapították, akkor a növény védelme érdekében szisztémás növényvédelmi intézkedéseket (gyógyító alkalmazást) kell végezni.
Rizs robbanás
A trópusokon a betegség spórái egész évben jelen vannak a levegőben, ami kedvez a betegség folyamatos fejlődésének. A gomba által okozott fertőzés a hegyvidéki rizst súlyosabban károsítja, mint az öntözött rizst. Ritkán támadja meg a levélhüvelyeket. Az elsődleges fertőzés ott kezdődik, ahol a vetőmagot sűrűn vetik el a mechanikus átültetésre szánt palántadobozokban.
A mérsékelt égövi országokban a fertőzött növényi maradványokban vagy a vetőmagban szezonálisan elszaporodik. A felhős égbolt, a gyakori eső és a szitálás kedvez a rizsroham kialakulásának és súlyosságának. A magas nitrogénszint, a magas relatív páratartalom és a nedves levelek elősegítik a gomba által okozott fertőzést. A sporuláció mértéke a 90% vagy magasabb relatív páratartalom növekedésével a legmagasabb. A levélnedvességhez a kórokozó csírázásának optimális hőmérséklete 25-28 °C. A rizs aerob talajban történő termesztése olyan vizes területeken, ahol a szárazságstressz uralkodik, szintén kedvez a fertőzésnek.
Egy gomba okozza a rizsrohamot. Konídiumfórái minden egyes stóma fürtökben termelődnek. Ritkán 2-4 szeptummal magányosan állnak. A konídióforák bazális területe duzzadt és a világosabb csúcs felé keskenyedik. A gomba konídiumai 20-22 x 10-12 µm méretűek. A konídiumok 2-szeptómásak, áttetszőek és enyhén sötétednek. Obclavák és a csúcsuknál elkeskenyednek. A tövük csonka vagy rövid fogazottá nyúlik az alapjuknál.
A rizs növényen kívül a gomba a következő növényeken is megél Agropyron repens (L.) Gould, Agrostis palustris, A. tenuis, Alopecurus pratensis, Andropogon sp., Anthoxanthum odoratum, Arundo donax L., Avena byzantina, A. sterilis, A. sativa, Brachiaria mutica (Forssk.) Stapf, Bromus catharticus, B. inermis, B. sitchensis, Canna indica, Chikushichloa aquatica, Costus speciosus, Curcuma aromatica, Cynodon dactylon (L.) Pers.., Cyperus rotundus L., C. compressus L., Dactylis glomerata, Digitaria sanguinalis (L.) Scop, Echinochloa crus-galli (L.) P. Beauv.., Eleusine indica (L.) Gaertn., Eragrostis sp., Eremochloa ophiuroides, Eriochloa villosa, Festuca altaica, F. arundinacea, F. elatior, F. rubra, Fluminea sp., Glyceria leptolepis, Hierochloe odorata, Holcus lanatus, Hordeum vulgare, Hystrix patula, Leersia hexandra Sw., L. japonica, L. oryzoides, Lolium italicum, L. multiflorum, L. perenne, Muhlenbergia sp., Musa sapientum, Oplismenus undulatifolius (Ard.) Roem. & Schult., Panicum miliaceum L., P. ramosum (L.) Stapf, P. repens L., Pennisetum typhoides (L.) R. Br., Phalaris arundinacea L., P. canariensis, Phleum pratense, Poa annua L., P. trivialis, Saccharum officinarum, Secale cereale, Setaria italica (L.) P. Beauv.., S. viridis (L.) P. Beauv., Sorghum vulgare, Stenotaphrum secundatum, Triticum aestivum, Zea mays L., Zingiber mioga, Z. officinale és Zizania latifolia..
A konídiumok a rizs növényen lévő sérüléseken keletkeznek, körülbelül 6 nappal a beoltás után. A spóratermelés a relatív páratartalom növekedésével fokozódik. A legtöbb spóra az éjszaka folyamán termelődik és szabadul fel. A spórák csírázása után következik a fertőzés. A fertőzési csövek az appresszóriumokból, majd a kutikula és az epidermisz áthatolásából alakulnak ki. A sejtbe való behatolás után a fertőzési cső hólyagot képez, amelyből hifák keletkeznek. A sejtben a hifák szabadon növekednek.
A rizsrothadás a rizs bármely növekedési szakaszban megfertőzi a rizs növényt. A rizs palántái vagy a kelő szakaszban lévő növények gyakran teljesen elpusztulnak. Hasonlóképpen, az erős fertőzés a rizsfürtökön általában terméskiesést okoz.
Anthracnose
A modell a R. solani a szántóföldeken a betegség kockázatát a hőmérséklet, a levélnedvesség és a globális sugárzás alapján értékeli. Az ellenőrzés 120 órán át tart:
- Egymást követő levélnedvesedés esetén percenként felhalmozza a hőmérsékletet az értékektől függő értékeket.
- 12 °C és 15 °C között percenként 1 felhalmozódik.
- 16 °C és 17 °C között percenként 2 felhalmozódik.
- 18°C és több, percenként 4 felhalmozódik. - A levélnedvesítési időszakok végén kiértékeli a felhalmozott értékeket.
- ha nagyobbak, mint 4096, akkor 64 ponttal növeli a kockázatot, és 4096-ot levon az értékből>
- ha a maradék nagyobb, mint 2048, akkor a kockázatot 16-tal növeli, és 2048-at levon az értékből.
- ha a maradék nagyobb, mint 1024, akkor a kockázatot 4-gyel növeli, és 1024-et levon az értékből. - Ha a globális sugárzás folyamatosan magasabb, mint 800 W/m², akkor az időt percekben kell felhalmozni, és ha a sugárzás alacsonyabb lesz, akkor értékelni kell az értékeket:
- Érték > 512 = RiskValue - 32 pont , Érték - 512
- Érték > 256 = RiskValue - 8 pont , Érték - 256
- Érték >128= RisKValue - 2 pont, Érték -128
A modell 0 és 100 közötti kockázati értéket eredményez, amely a következők szempontjából kedvező időszakokat jelzi R. solani a mezőkön.
Támogatási rendszer
A hüvelyfoltossági modell rámutat azokra az időszakokra, amelyekben a betegség magas kockázata fennáll. Azokban az időszakokban, amikor a kockázat alacsony, nem kell permetezni. A mérsékelt kockázatú időszakokban a permetezési időköz meghosszabbítható, a magas kockázatú időszakokban pedig a permetezési időközöket esetleg csökkenteni kell, vagy hatékonyabb vegyületeket kell használni.
Irodalom
Rozsda betegségek
- Anikster, Y., Bushnell, W.R., Eilam, T., Manisterski, J. & Roelfs, A.P. 1997. A Puccinia recondita levélrozsdát okozó búzafajta termesztett búzán, vadbúzán és rozson. Can. J. Bot., 75: 2082-2096.
- Azbukina, Z. 1980. A gabonafélék rozsdagombáinak gazdasági jelentősége a szovjet Távol-Keleten. In Proc. 5th European and Mediterranean Cereal Rusts Conf., p. 199-201. Bari, Róma.
- Beresford, R.M. 1982. Csíkrozsda (Puccinia striiformis), a búza új betegsége Új-Zélandon. Cer. Rusts Bull., 10: 35-41.
- Biffen, R.H. 1905. Mendel öröklési törvényei és a búzanemesítés. J. Agric. Sci., 1: 4-48.
- Borlaug, N.E. 1954. A mexikói búzatermesztés és szerepe a szárrozsda járványtanában Észak-Amerikában. Phytopathology, 44: 398-404.
- Buchenauer, H. 1982. A gabonarozsda kémiai és biológiai védekezése. In K.J. Scott & A.K. Chakravorty, szerk. A rozsdagombák, 247-279. o. London, Academic Press.
- Burdon, J.J., Marshall, D.R. & Luig, N.H. 1981. Az izoenzim analízis azt mutatja, hogy egy virulens gabonarozsda kórokozó szomatikus hibrid. Nature, 293: 565-566.
- Casulli, F. 1988. A búza levélrozsdájának túlszezonizálása Dél-Olaszországban. In Proc. 7th European and Mediterranean Cereal Rusts Conf., 5-9 Sept., p. 166-168. Bécs.
- Chester, K.S. 1946. A gabonarozsdák természete és megelőzése a búza levélrozsdájának példáján. In Chronica botanica. Walthan, MA, USA. 269 pp.
- Craigie, J.H. 1927. Kísérletek a rozsdagombák nemére. Nature, 120: 116-117.
- Cummins, G.B. & Caldwell, R.M. 1956. A binomiálisok érvényessége a gabonafélék és fűfélék levélrozsdagomba-komplexumában. Phytopathology, 46: 81-82.
- Cummins, G.B. & Stevenson, J.A. 1956. Az észak-amerikai rozsdagombák (Uredinales) ellenőrző listája. Plant Dis. Rep. Suppl., 240: 109-193.
- d'Oliveira, B. & Samborski, D.J. 1966. A Puccinia recondita aecialis stádiuma a Ranunculaceae és Boraginaceae fajokon Portugáliában. In Proc. Cereal Rusts Conf., Cambridge, 133-150. o.
- DeBary, A. 1866. Neue Untersuchungen uber die Uredineen insbesondere die Entwicklung der Puccinia graminis und den Zusammenhang duselben mit Aecidium berberis. In Monatsber Preuss. Akad. Wiss., Berlin, p. 15-20.
- de Candolle, A. 1815. Uredo rouille des cereales. In Flora francaise, famille des champignons, p. 83.
- Dubin, H.J. & Stubbs, R.W. 1986. Az árpa csíkrozsda járványos terjedése Dél-Amerikában. Plant Dis., 70: 141-144.
- Dubin, H.J. & Torres, E. 1981. Az 1976-1977-es búza levélrozsdajárvány okai és következményei Északnyugat-Mexikóban. Ann. Rev. Phytopath., 19: 41-49.
- Eriksson, J. 1894. Uber die Spezialisierung des Parasitismus bei dem Getreiderostpilzen. Ber. Deut. Bot. Ges., 12: 292-331.
- Eriksson, J. & Henning, E. 1894. Die Hauptresultate einer neuen Untersuchung uber die Getreideroste. Z. Pflanzenkr., 4: 66-73, 140-142, 197-203, 257-262.
- Eriksson, J. & Henning, E. 1896. Die Getreideroste. Ihre Geschichte und Natur sowie Massregein gegen dieselben, p. 463. Stockholm, P.A. Norstedt és Soner.
- Ezzahiri, B., Diouri, S. & Roelfs, A.P. 1992. Az alternatív gazdanövény, az Anchusa italica szerepe a Puccinia recondita f. sp. tritici járványtanában a durumbúzán Marokkóban. In F.J. Zeller & G. Fischbeck, szerk. Proc. 8th European and Mediterranean Cereal Rusts and Mildews Conf., 1992, p. 69-70. Heft 24 Weihenstephan, Németország.
- Fontana, F. 1932. Megfigyelések a gabona rozsdájáról. P.P. Pirone fordítása. Klasszikusok 2. sz. Washington, DC, Amer. Phytopathol. Society. (Eredetileg 1767-ben jelent meg).
- Green, G.J. & Campbell, A.B. 1979. A Puccinia graminis tritici ellen rezisztens búzafajták Kanada nyugati részén: fejlődésük, teljesítményük és gazdasági értékük. Can. J. Plant Pathol., 1: 3-11.
Groth, J.V. & Roelfs, A.P. 1982. Az ivaros és aszexuális szaporodás hatása a gabonafélék rozsdagomba-populációinak fajszámára. Phytopathology, 72: 1503-1507. - Hare, R.A. & McIntosh, R.A. 1979. Genetikai és citogenetikai vizsgálatok a "Hope" és rokon fajták tartós felnőtt növény rezisztenciájáról a búzarozsdával szemben. Z. Pflanzenzüchtg, 83: 350-367.
- Hart, H. & Becker, H. 1939. Beitrage zur Frage des Zwischenwirts fur Puccinia glumarum Z. Pflanzenkr. (Pflanzenpathol.) Pflanzenschutz, 49: 559-566.
- Hendrix, J.W., Burleigh, J.R. & Tu, J.C. 1965. A csíkrozsda túlnyáriasodása a Csendes-óceán északnyugati részén magasan fekvő területeken - 1963. Plant Dis. Rep., 49: 275-278.
- Hermansen, J.E. 1968. Tanulmányok a gabonarozsda és a lisztharmat terjedéséről és túléléséről Dániában. Contrib. No. 87. Koppenhága, Növénykórtani Tanszék, Royal Vet. Mezőgazdasági Főiskola. 206 pp.
- Hirst, J.M. & Hurst, G.W. 1967. Hosszú távú spóratranszport. In P.H. Gregory & J.L. Monteith, szerk. Airborne microbes, p. 307-344. Cambridge University Press.
- Hogg, W.H., Hounam, C.E., Mallik, A.K. & Zadoks, J.C. 1969. A búzarozsda járványtanát befolyásoló meteorológiai tényezők. WMO Tech. Note No. 99. 143 pp.
- Huerta-Espino, J. & Roelfs, A.P. 1989. A levélrozsda fiziológiai specializációja a durumbúzán. Phytopathology, 79: 1218 (abstr.).
- Hylander, N., Jorstad, I. & Nannfeldt, J.A. 1953. Enumeratio uredionearum Scandinavicarum. Opera Bot., 1: 1-102.
- Johnson, R. 1981. Tartós betegségekkel szembeni ellenálló képesség. In J.F. Jenkyn & R.T. Plumb, szerk. Stratégiák a gabonabetegségek elleni védekezésre, p. 55-63. Oxford, Egyesült Királyság, Blackwell.
- Johnson, T. 1949. Intervarietális kereszteződések a Puccinia graminisban. Can. J. Res. C, 27: 45-63.
- Joshi, L.M. & Palmer, L.T. 1973. A búza szár-, levél- és csíkrozsdájának epidemiológiája Észak-Indiában. Plant Dis. Rep., 57: 8-12.
- Katsuya, K. & Green, G.J. 1967. A búza szárrozsda 15B és 56 fajtáinak szaporodási potenciálja. Can. J. Bot., 45: 1077-1091.
- Kilpatrick, R.A. 1975. Új búzafajták és a rozsdaellenállás hosszú élettartama, 1971-1975. USDA, Agric. Res. Serv. Northeast Reg (Rep.), ARS-NE 64. 20 pp.
- Le Roux, J. & Rijkenberg, F.H.J. 1987. A Puccinia graminis f. sp. tritici patotípusai fokozott virulenciával az Sr24 esetében. Plant Dis., 71: 1115-1119.
- Lewellen, R.T., Sharp, E.L. & Hehn, E.R. 1967. A Puccinia striiformis-szal szembeni rezisztencia fő és mellékgénjei a búzában, valamint a hőmérsékletváltozásra adott válaszuk. Can. J. Bot., 45: 2155-2172.
- Line, R.F. 1976. A csíkrozsda járványhoz hozzájáruló tényezők a búzán a kaliforniai Sacramento völgyben 1974-ben. Plant Dis. Rep., 60: 312-316.
- Line, R.F., Qayoum, A. & Milus, E. 1983. A búza csíkrozsdával szembeni tartós rezisztencia. In Proc. 4th Int. Cong. Plant Pathol., 204. o. Melbourne.
- Luig, N.H. 1985. Epidemiológia Ausztráliában és Új-Zélandon. In A.P. Roelfs & W.R. Bushnell, szerk. Cereal rusts, vol. 2, Diseases, distribution, epidemiology, and control, p. 301-328. Orlando, FL, USA, Academic Press.
- Luig, N.H. & Rajaram, S. 1972. A hőmérséklet és a genetikai háttér hatása a Puccinia graminis tritici gének gazdanövényi kifejeződésére és kölcsönhatására. Phytopathology, 62: 1171-1174.
- Luig, N.H. & Watson, I.A. 1972. A vadon élő és termesztett fűfélék szerepe a Puccinia graminis formae speciales hibridizációjában. Aust. J. Biol. Sci., 25: 335-342.
- Maddison, A.C. & Manners, J.G. 1972. A napfény és a gabonarozsda urediospórák életképessége. Trans. Br. Mycol. Soc., 59: 429-443.
- Mains, E.B. 1932. Gazdaspecializáció a pázsitfűfélék Puccinia rubigovera levélrozsdájában. Mich. Acad. Sci., 17: 289-394.
- Mains, E.B. 1933. Tanulmányok a heteroecious rozsdáról. Mycologia, 25: 407-417.
- Mains, E.B. & Jackson, H.S. 1926. Fiziológiai specializáció a búza levélrozsdájában, Puccinia triticina Erikss. Phytopathology, 16: 89-120.
- Manners, J.G. 1960. Puccinia striiformis Westend. var. dactylidis var. nov. Trans. Br. Mycol. Soc., 43: 65-68.
- McIntosh, R.A. 1976. A búza és a búzarozsda genetikája Farrer óta: Farrer-emlékbeszéd 1976. J. Aust. Inst. Sci., 42: 203-216.
- McIntosh, R.A. 1992. A levélrozsdával és a csíkrozsdával szembeni rezisztenciát biztosító gének szoros genetikai kapcsolata búzában. Plant Pathol., 41: 523-527.
- McIntosh, R.A., Luig, N.H., Milne, D.L. & Cusick, J. 1983. A tritikálék érzékenysége a búza szárrozsdával szemben. Can. J. Plant Pathol., 5: 61-69.
- McIntosh, R.A., Hart, G.E., Devos, K.M., Gale, M.D. & Rogers, W.J. 1998. A búza génszimbólumainak katalógusa. In Proc. 9th Int. Wheat Genetics Symp., 1998. aug. 2-7. Saskatoon Saskatchewan, Kanada.
- Melander, L.W. & Craigie, J.H. 1927. A Berberis spp. Puccinia graminis-szal szembeni ellenálló képességének természete. Phytopathology, 17: 95-114.
- Mont, R.M. 1970. A szárrozsdával szembeni nem specifikus rezisztencia vizsgálata tavaszi búzában. M.Sc. St Paul, MN, USA, Minnesotai Egyetem. 61 pp.
- Nagarajan, S. & Joshi, L.M. 1985. Járványtan az indiai szubkontinensen. In A.P. Roelfs & W.R. Bushnell, szerk. The cereal rusts, vol. 2, Diseases, distribution, epidemiology, and control, p. 371-402. Orlando, FL, USA, academic Press.
- O'Brien, L., Brown, J.S., Young, R.M. & Pascoe, T. 1980. A búza csíkrozsda előfordulása és elterjedése Victoriában, valamint a kereskedelmi búzafajták fogékonysága. Aust. Plant Pathol. Soc. Newsl., 9: 14.
- Perez, B. & Roelfs, A.P. 1989. A búza levélrozsdával szembeni rezisztenciája a szárazföldi kultúrnövényeknek és származékaiknak. Phytopathology, 79: 1183 (abstr.).
- Pretorius, Z.A., Singh, R.P., Wagoire, W.W. & Payne, T.S. 2000. A búza szárrozsdával szembeni Sr31 rezisztenciagén virulenciájának kimutatása a Puccinia graminis f. sp. tritici búzában Ugandában. Phytopathology, 84: 203.
- Rajaram, S., Singh, R.P. & van Ginkel, M. 1996. A búza széleskörű alkalmazkodásra, rozsdamentességre és szárazságra való nemesítésének megközelítései. In R.A. Richards, C.W. Wrigley, H.M. Rawson, G.J. Rebetzke, J.L. Davidson & R.I.S. Brettell, szerk. Proc. 8th Assembly Wheat Breeding Society of Australia, p. 2-30. Canberra, The Australian National University.
- Rapilly, F. 1979. A sárgarozsda járványtana. Ann. Rev. Phytopathol., 17: 5973.
- Robbelen, G. & Sharp, E.L. 1978. A sárgarozsdával szembeni rezisztenciát kondicionáló gének öröklési módja, kölcsönhatása és alkalmazása. Fortschr. Pflanzenzucht. Beih. Z. Pflanzenzucht., 9: 1-88.
- Roelfs, A.P. 1978. A rozsda által okozott becsült veszteségek a kis szemű gabonafélékben az Egyesült Államokban 1918-1976 között. Misc. Publ. USDA, 1363: 1-85.
Roelfs, A.P. 1982. A borbolya kiirtásának hatása a szárrozsdára az Egyesült Államokban. Plant Dis., 66: 177-181. - Roelfs, A.P. 1985a. Járványtan Észak-Amerikában. In A.P. Roelfs & W.R. Bushnell, szerk. The cereal rusts, vol. 2, Diseases, distribution, epidemiology, and control, p. 403-434. Orlando, FL, USA, Academic Press.
- Roelfs, A.P. 1985b. Búza és rozs szárrozsda. In A.P. Roelfs & W.R. Bushnell, szerk. The cereal rusts, vol. 2, Diseases, distribution, epidemiology, and control, p. 3-37. Orlando, FL, USA, Academic Press.
- Roelfs, A.P. 1986. A regionális gabonarozsda-járványok kialakulása és hatása. In K.J. Leonard & W.E. Fry, szerk. Növénybetegségek járványtana, 1. kötet, 129-150. o. New York, NY, USA, MacMillan.
- Roelfs, A.P. 1988. A búza szárrozsda fenotípusainak genetikai szabályozása. Ann. Rev. Phytopathol., 26: 351-367.
- Roelfs, A.P. & Groth, J.V. 1980. A virulenciafenotípusok összehasonlítása a búza szárrozsdapopulációkban, amelyek szexuálisan és aszexuálisan szaporodnak. Phytopathology, 70: 855-862.
- Roelfs, A.P. & Groth, J.V. 1988. Puccinia graminis f. sp. tritici, a Triticum spp. fekete szárrozsdája In G.S. Sidhu, szerk. Advances in plant pathology, vol. 6, Genetics of pathogenic fungi, p. 345-361. London, Academic Press.
- Roelfs, A.P. & Long, D.L. 1987. A Puccinia graminis fejlődése Észak-Amerikában 1986-ban. Plant Dis., 71: 1089-1093.
- Roelfs, A.P. & Martell, L.B. 1984. Ure-dospóraszóródás egy pontforrásból a búza lombkoronáján belül. Phytopathology, 74: 1262-1267.
- Roelfs, A.P., Huerta-Espino, J. & Marshall, D. 1992. Árpa csíkrozsda Texasban. Plant Dis., 76: 538.
- Rowell, J.B. 1981. Az Idaed 59 búzacsemetékben bekövetkező posztpenetrációs események és a Puccinia graminis f. sp. tritici fertőzésre való alacsony fogékonyság kapcsolata. Phytopathology, 71: 732-736.
- Rowell, J.B. 1982. A búza szárrozsdájának egyetlen domináns gén által kondicionált alacsony fertőzésre való fogékonysággal történő szabályozása. Phytopathology, 72: 297-299.
- Rowell, J.B. 1984. Puccinia graminis f. sp. tritici kontrollált fertőzése mesterséges körülmények között. In. A.P. Roelfs & W.R. Bushnell, szerk. The cereal rusts, vol. 1, Origins, specificity, structure, and physiology, p. 291-332. Orlando, FL, USA, Academic Press.
- Saari, E.E. & Prescott, J.M. 1985. Világméretű elterjedés a gazdasági veszteségekkel összefüggésben. In A.P. Roelfs & W.R. Bushnell, szerk. The cereal rusts, vol. 2, Diseases, distribution, epidemiology, and control, p. 259-298. Orlando, FL, USA, Academic Press.
Saari, E.E., Young, H.C., Jr. & Fernkamp, M.F. 1968. Az észak-amerikai Thalictrum spp. fertőzése Puccinia recondita f. sp. tritici-vel. Phytopathology, 58: 939-943. - Samborski, D.J. 1985. Búza levélrozsda. In A.P. Roelfs és W.R. Bushnell, szerk. The cereal rusts, vol. 2, Diseases, distribution, epidemiology, and control, p. 39-59. Orlando, FL, USA, Academic Press.
- Savile, D.B.O. 1984. A gabonarozsda gombák rendszertana. In W.R. Bushnell & A.P. Roelfs, szerk. The cereal rusts, vol. 1, Origins, specificity, structures, and physiology, p. 79-112. Orlando, FL, USA, Academic Press.
- Sharp, E.L. & Volin, R.B. 1970. Additív gének a búza csíkrozsdával szembeni rezisztenciáját kondicionáló búzában. Phytopathology, 601: 1146-1147.
- Singh, R.P. 1992. Az Lr34 levélrozsda-rezisztenciagén genetikai kapcsolata a kenyérbúza csíkrozsdával szembeni kifejlett növényi rezisztenciájával. Phytopathology, 82: 835-838.
- Singh, R.P. & Rajaram, S. 1992. A "Frontana" és három CIMMYT búzafajta levélrozsdával szembeni rezisztenciájának genetikája. Genome, 35: 24-31.
- Singh, R.P. & Rajaram, S. 1994. A felnőtt növények csíkrozsdával szembeni ellenállásának genetikája tíz tavaszi kenyérbúzában. Euphytica, 72: 1-7.
- Singh, R.P., Mujeeb-Kazi, A. & Huerta-Espino, J. 1998. Lr46: A levélrozsdával szembeni lassú rozsdásodással szembeni rezisztenciát adó gén búzában. Phytopathology, 88: 890-894.
- Skovmand, B., Fox, P.N. & Villareal, R.L. 1984. A tritikálé a kereskedelmi mezőgazdaságban: fejlődés és ígéret. Adv. Agron., 37: 1-45.
- Spehar, V. 1975. A búzarozsda járványtana Európában. In Proc. 2nd Int. Winter Wheat Conf., 9-19 Jun., p. 435-440. Zágráb, Jugoszlávia.
- Stakman, E.C. 1923. Búzabetegségek. 14. A búzarozsda problémája az Egyesült Államokban. In Proc. 1st Pan Pac. Sci. Congr., p. 88-96.
- Straib, W. 1937. Untersuchungen uben dasn Vorkommen physiologischen Rassen der Gelbrostes (Puccinia glumarum) in den Jahren 1935-1936 und uber die Agressivitat eninger neuer Formes auf Getreide un Grasern. Arb. Biol. Reichsant. Land. Fortw. Berlin-Dahlem, 22: 91-119.
- Stubbs, R.W. 1985. Csíkos rozsda. In A.P. Roelfs & W.R. Bushnell, szerk. The cereal rusts, vol. 2, Diseases, distribution, epidemiology, and control, p. 61-101. Orlando, FL, USA, Academic Press.
- Stubbs, R.W. & de Bruin, T. 1970. Bestrijding van gele roest met het systemische fungicide oxycaroxin 'Plantvax'. Gewasbescherming, 1: 99-104.
- Stubbs, R.W., Prescott, J.M., Saari, E.E. & Dubin, H.J. 1986. Cereal disease methodology manual, p. 46. Mexikó, DF, CIMMYT.
- Sunderwirth, S.D. & Roelfs, A.P. 1980. Az Sr2 kifejlett növény rezisztenciájának üvegházi értékelése a búza szárrozsdával szemben. Phytopathology, 70: 634-637.
- Tollenaar, H. & Houston, B.R. 1967. Tanulmány a csíkrozsda, Puccinia striiformis West járványtanáról Kaliforniában. Can. J. Bot., 45: 291-307.
- Tozzetti, G.T. 1952. V. Alimurgia: A rozsdák, a búzák és a zab valódi természete, okai és szomorú hatásai, valamint a búza és a zab egyéb rosszindulatú betegségei a szántóföldön. In L.R. Tehon, ford. Phytopathological Classics No. 9, p. 139. St Paul, MN, USA, American Phytopathol. Society. (Eredetileg 1767-ben jelent meg).
- Tranzschel, W. 1934. Promezutocnye chozjaeva rzavwiny chlebov i ich der USSR. (A gabonarozsdagombák alternatív gazdanövényei és elterjedésük a Szovjetunióban). In Bull. Plant Prot., Ser. 2, p. 4-40. (Orosz nyelven, német nyelvű összefoglalóval).
- Viennot-Bourgin, G. 1934. La rouille jaune der graminees. Ann. Ec. Natl. Agric. Grignon Ser., 3, 2: 129-217.
- Wallwork, H. & Johnson, R. 1984. A sárgarozsdával szembeni rezisztencia transzgresszív szétválasztása búzában. Euphytica, 33: 123-132.
- Watson, I.A. & de Sousa, C.N.A. 1983. A Puccinia graminis tritici spóráinak hosszú távú szállítása a déli féltekén. In Proc. Linn. Soc. N.S.W., 106: 311-321.
- Wright, R.G. & Lennard, J.H. 1980. A Puccinia striiformis egy új fajának eredete. Trans. Br. Mycol. Soc., 74: 283-287.
- Zadoks, J.C. 1961. A sárgarozsda búzán a járványtan és a fiziológiai specializáció tanulmányozása. Neth. J. Plant Pathol., 67: 69-256.
- Zadoks, J.C. & Bouwman, J.J. 1985. Epidemiológia Európában. In A.P. Roelfs & W.R. Bushnell, szerk. The cereal rusts , vol. 2, Diseases, distribution, epidemiology, and control , p. 329-369. Orlando, FL, USA, Academic Press
Fusarium Head Blight
- Baht, C.V., Beedu, R., Ramakrishna, Y. & Munshi, R.L. 1989. Trichothecén toxikózis kitörése penészes búzakészítmények fogyasztásával összefüggésben a Kasmír-völgyben, Indiában. Lancet, 35-37. o.
- Bai, G. 1995. Búzarozsda: járványtan, a rezisztencia öröklődése és a fajták rezisztenciájához kapcsolódó molekuláris markerek. Doktori értekezés. West Lafayette, IN, USA, Purdue University.
- Chen, P., Liu, D. & Sun, W. 1997. Új ellenintézkedések a búza varasodással szembeni rezisztenciájának nemesítésében. In H.J. Dubin, L. Gilchrist, J. Reeves & A. McNab, szerk. Fusarium head scab: global status and future prospects. Mexikó, DF, CIMMYT.
- Diaz de Ackermann, M. & Kohli, M.M. 1997. A búza fuzáriumos fejfoltosságának kutatása Uruguayban. In H.J. Dubin, L. Gilchrist, J. Reeves & A. McNab, szerk. Fusarium head scab: globális helyzet és jövőbeli kilátások. Mexikó, DF, CIMMYT.
- Dill-Macky, R. 1997. Fuzáriumos fejfoltosság: A közelmúlt járványai és kutatási erőfeszítések az Egyesült Államok felső középnyugati részén. In H.J. Dubin, L. Gilchrist, J. Reeves & A. McNab, szerk. Fusarium head scab: globális helyzet és jövőbeli kilátások. Mexikó, DF, CIMMYT.
- Dubin, H.J., Gilchrist, L., Reeves, J. & McNab?, A. 1997. Fusarium head scab: globális helyzet és jövőbeli kilátások. Mexikó, DF, CIMMYT.
- Galich, M.T.V. 1997. Fuzáriumos fejfoltosság Argentínában. In H.J. Dubin, L. Gilchrist, J. Reeves & A. McNab, szerk. Fusarium head scab: Global status and future prospects. Mexikó, DF, CIMMYT.
- Gilchrist, L., Rajaram, S., Mujeeb-Kazi?, A., van Ginkel, M.,Vivar, H. & Pfeiffer, W. 1997. In H.J. Dubin, L. Gilchrist, J. Reeves & A. McNab, szerk. Fusarium head scab: global status and future prospects. Mexikó, DF, CIMMYT.
- Ireta, J. 1989. Seleccion de un modelo de crecimiento para la fusariosis del trigo causada por Fusarium graminearum Schw. In M.M. Kohli, ed. Taller sobre la Fusariosis de la espiga en America del Sur. Mexico, DF, CIMMYT.
- Ireta, M.J. & Gilchrist, L. 1994. A búza fuzáriumos fejtetűje (Fusarium graminearum Schwabe). Búzáról szóló 21b. sz. különjelentés. Mexikó, DF, CIMMYT.
- Khonga, E.B. & Sutton, J.C. 1988. A Giberella zeae inokulumtermelése és túlélése kukorica- és búzamaradványokban. Can. J. Plant Pathol., 10(3): 232-240.
- Luo, X.Y. 1988. Fuzáriumtoxin-szennyezés Kínában. Proc. Japan Assoc. Mycotoxicology Suppl., 1: 97-98. Marasas, W.F.O., Jaskiewickz, K., Venter, F.S. & Schalkwyk, D.J. 1988. A kukorica Fusarium moniliforme-szennyezettsége a Transkei nyelőcsőrákos területeken. S. AF. Med. J., 74: 110-114.
- Mihuta-Grimm, L. & Foster, R.L. 1989. Scab búzán és árpán Dél-Idahóban és a vetőmagkezelés értékelése a Fusarium spp. kiirtására. Plant Dis., 73: 769-771.
- Miller, J.D. & Armison, P.G. 1986. A deoxinivalenol lebontása a Frontana búzafajta Fusarium fejfoltosságnak ellenálló szuszpenziós kultúráiban. Can. J. Plant Pathol., 8: 147-150.
- Miller, J.D., Young, J.C. & Sampson, D.R. 1985. Deoxinivalenol és Fusarium head blight rezisztencia tavaszi gabonafélékben. J. Phytopathol., 113: 359-367.
- Reis, E.M. 1985. Doencas do trigo III. Fusariose. Brasil, Merck Sharp Dohme.
- Reis, E.M. 1989. Fusariosis: biologia y epidemiologia de Gibberella zeae en trigo. In M.M. Kohli, ed. Taller sobre la Fusariosis de la espiga en America del Sur. Mexico, DF, CIMMYT.
- Schroeder, H.W. & Christensen, J.J. 1963. A búza Gibberella zeae által okozott varasodással szembeni ellenállóképességét befolyásoló tényezők. Phytopathology, 53: 831-838.
- Snidjers, C.H.A. 1989. A búza Fusarium fejfoltossággal szembeni rezisztencia és a mikotoxinprobléma nemesítésének jelenlegi helyzete Hollandiában. Mezőgazdasági Növénynemesítési Alapítvány, Wageningen. In M.M. Kohli, szerk. Taller sobre la Fusariosis de la espiga en America del Sur. Mexico, DF, CIMMYT.
- Snijders, C.H.A. 1990. A Fusarium culmorum okozta fejfoltossággal szembeni rezisztencia öröklődése őszi búzában Euphytica, 50: 11-18.
- Teich, A.H. & Nelson, K. 1984. A fuzáriumos fejfoltosság és a termesztési gyakorlatok lehetséges hatásainak felmérése Lambton megye búzamezőin 1983-ban. Can. Plant Dis. Surv., 64(1): 11-13.
- Trenholm, H.L., Friend, D.H. & Hamilton, R.M.G. 1984. Vomitoxin és zearalenon az állati takarmányokban. Agriculture Canada Publication 1745 E.
- Van Egmond, H.P. & Dekker, W.H. 1995. A mikotoxinokra vonatkozó világszintű szabályozás 1994-ben. Nat. Toxins, 3: 332.
- Viedma, L. 1989. Importancia y distribucion de la fusariosis de trigo en Paraguay. In M.M. Kohli, ed. Taller sobre la Fusariosis de la espiga en America del Sur. Mexico, DF, CIMMYT.
- Wang, Y.Z. 1997. A búzarozsda epidemiológiája és kezelése Kínában In H.J. Dubin, L. Gilchrist, J. Reeves & A. McNab, szerk. Fusarium head scab: global status and future prospects. Mexikó, DF, CIMMYT.
- Wang, Y.Z. & Miller, J.D. 1988. A metabolitok hatása a búza szövetére a Fusarium head blight rezisztenciával kapcsolatban. J. Phytopathol., 122: 118-125.
Fusarium Head Blight
- Infektion und Ausbreitung von Fusarium spp. an Weizen in Abhängigkeit der Anbaubedingungen im Rheinland, Lienemann, K.
- E.-C. Oerke und H.-W. Dehne
A vízaktivitás, a hőmérséklet és a pH hatása a kukoricából származó Fusarium moniliforme és Fusarium proliferatum izolátumok növekedésére, Sonia Marin, Vicente Sanchis és Naresh Magan - A Fusarium graminearum és a F. moniliforme kölcsönhatása a kukoricafülben: a betegség előrehaladása, a gombák biomasszája és a mikotoxinok felhalmozódása, L. M. Reid, R. W. Nicol, T. Ouellet, M. Savard, J. D. Miller, J. C. Young, D. W. Stewart és A. W. Schaafsma.
- Evaluierung von Einflussfaktoren auf den Fusarium-Ährenbefall des Weizens, Wolf, P. F. J.; Schempp, H.; Verreet, J.-A.
Septoria spp.
- Baker, C.J. 1971. A Leptosphaeria nodorum által okozott magoncfertőzés morfológiája. Trans. Brit. Mycol. Soc. 56:306-309.
- Baker, C.J. 1969. A Leptosphaeria nodorum Müller és Septoria tritici Desm. búzán végzett vizsgálatai. Doktori értekezés. University of Exeter.
- Baker E.A. és Smith, I.M. 1978. A rezisztens és fogékony reakciók alakulása búzában Septoria nodorummal történő oltáskor. Trans. Brit. Mycol. Soc. 71:475-482.
- Benedict, W.G. 1971. A fényintenzitás differenciált hatása a búza Septoria tritici Desm. általi fertőzésére ellenőrzött környezeti körülmények között. Physiol. Pl. Pathol. 1:55-56.
- Bird, P.M. és Ride, J.P. 1981. A búza Septoria nodorummal szembeni ellenálló képessége: a gomba fejlődése a gazdaszervezet lignifikációjával összefüggésben. Physiol. Pl. Pathol. 19:289-299.
- A gabonafélék Stagonospora és Septoria kórokozói: Bethenod, O., Bousquet, J., Laffray, D., and Louguet, P. 1982. Reexamen des modalités d'action de l'ochracine sur la conductance stomatique des feuilles de plantules de blé, Triticum aestivum L., cv "Etoile de Choisy".Agronomie 2:99-102.
- Bousquet, J.F. és Kollman, A. 1998. A Septoria nodorum búzához vagy árpához alkalmazkodott izolátumok metabolittermelésének eltérései. J. Phytopathol. 146:273-277.
- Bousquet, J.F., Belhomme de Franqueville, H., Kollmann, A. és Fritz, R. 1980. Action de la septorine, phytotoxine synthétisée par Septoria nodorum, sur la phosphorylation oxydative dans les mitochondries isolées de coléoptiles de blé. Can. J. Bot. 58:2575-2580.
- Brennan, R.M., Fitt, B.D.L., Colhoun, J., and Taylor, G.S. 1986. A Septoria nodorum piknídióspórák csírázását befolyásoló tényezők. J. Phytopathol. 117:49-53.
- Brönnimann, A., Sally, B.K. és Sharp, E.L. 1972. A Septoria nodorum vizsgálata tavaszi búzában Montanában. Plant Dis. Reptr. 56:188-191.
- Cohen, L. és Eyal, Z. 1993. A Septoria tritici rezisztens és fogékony búzafajták Septoria tritici fertőzésével kapcsolatos folyamatok szövettana. Plant Pathol. 42:737-743.
- Cunfer, B.M. 1983. A vetőmagról terjedő Septoria nodorum epidemiológiája és ellenőrzése. Seed Sci. Tecnol. 11:707- 718.
- Essad, S. és Bousquet, J.F. 1981. Action de l'ochracine, phytotoxine de Septoria nodorum Berk., sur le cycle mitotique de Triticum aestivum L. Agronomie 1:689-694.
- Eyal, Z., Scharen, A.L., Prescott, J.M. és van Ginkel, M. 1987. A búza Septoria-betegségei: A betegség kezelésének koncepciói és módszerei. CIMMYT. Mexico D.F. 46 pp.
- Fernandes, J.M.C. és Hendrix, J.W. 1986a. A Septoria nodorum konídiumainak életképessége természetes körülmények között Washingtonban. Fitopathol. Bras. 11:705-710.
- Fernandes, J.M.C. és Hendrix, J.W. 1986b. A levélnedvesség és a hőmérséklet hatása a Septoria nodorum által fertőzött búzaleveleken a levélhifák növekedésére és a tünetek kialakulására. Fitopathol. Bras. 11:835-845.
- Fournet, J. 1969. Properiétés et role du cirrhe du Septoria nodorum Berk. Ann. Phytopathol. 1:87-94. Fournet, J., Pauvert, P. és Rapilly, F. 1970. Propriétés des gelées sporifères de quelques Sphaeropsidales et Melanconiales. Ann. Phytopathol. 2:31-41.
- Gough, F.J. és Lee, T.S. 1985. A nedvesség hatása a Septoria tritici konídiumainak ürülésére és túlélésére. Phytopathology 75:180-182.
- Green, G.J. és Dickson, J.G. 1957. Az árpa Septoria levélfoltosságának kórtani szövettana és a fajták reakciói. Phytopathology 47:73-79.
- Griffiths, E. és Peverett, H. 1980. A nedvesség és a cirrhus kivonat hatása a Septoria nodorum spórák túlélésére. Trans. Brit. Mycol. Soc. 75:147-150.
- Harrower, K.M. 1976. A cirrusok működése a Leptosphaeria nodorumban. APPS Newsletter 5:20-21.
- Hilu, H.M. és Bever, W.M. 1957. Oltás, túlnyáriasítás és a gyanúsító-kórokozó kapcsolat Triticum fajokon. Phytopathology 47:474-480.
- Holmes, S.J.I. és Colhoun, J. 1974. A búza fertőzése Septoria nodorum és S. tritici által. Trans. Brit. Mycol. Soc. 63:329-338.
- Jenkins, P.D. 1978. Kölcsönhatás a gabonabetegségeknél. Ph. D. Thesis. University of Wales.
- Karjalainen, R. és Lounatmaa, K. 1986. A Septoria nodorum búzalevelek behatolásának és kolonizációjának ultrastruktúrája. Physiol. Mol. Pl. Pathol. 29:263-270.
- Kema, G.H.J., DaZhao, Y., Rijkenberg, F.H.J., Shaw, M.W., és Baayen, R.P. 1996. A Mycosphaerella graminicola patogenezisének szövettana búzában. Phytopathology 86:777-786.
- Keon, J.P.R. és Hargreaves, J.A. 1984. Az árpalevél epidermális sejtjeinek válasza a Septoria nodorum fertőzésre. New Phytol. 98:387-398.
- King, J.E., Cook, R.J. és Melville, S.C. 1983. A búza és az árpa szeptóriás betegségeinek áttekintése. Ann.Appl. Biol. 103:345-373.
- Krupinsky, J.M., Scharen, A.L. és Schillinger, J.A. 1973. A Septoria nodorum Berk. kórokozóváltozása a szervspecifikussággal, a látszólagos fotoszintetikus sebességgel és a búza terméshozamával összefüggésben. Physiol. Pl. Pathol. 3:187-194.
- Lehtinen, U. 1993. A Septoria nodorum növényi sejtfalbontó enzimjei. Physiol. Mol. Pl. Pathol. 43:121-134.
- Magro, P. 1984. A poliszacharidokat lebontó enzimek termelése kultúrában és a patogenezis során. Plant Sci. Letters 37:63-68.
- Morgan, W.M. 1974. A Septoria spp. és a Fusarium culmorum által okozott búzabetegségek élettani vizsgálatai. Doktori értekezés. University of London.
- O'Reilly, P. és Downes, M.J. 1986. A Septoria nodorum túlélési formája tünetmentes őszi búzán. Trans. Brit. Mycol. Soc. 86:381-385.
- Rapilly, F., Foucault, B. és Lacazedieux, J. 1973. Études sur l'inoculum de Septoria nodorum Berk. (Leptosphaeria nodorum Müller) agent de la septoriose du blé I. Les ascospores. Ann. Phytopathol. 5:131-141.
- Rasanayagam, M.S., Paul, N.D., Royle, D.J. és Ayres, P.G. 1995. A Septoria tritici és a S. nodorum UV-B besugárzásra adott válaszainak változása in vitro. Mycol. Res. 99:1371-1377.
- Shipton, W.A., Boyd, W.R.J., Rosielle, A.A., and Shearer, B.L. 1971. A búza gyakori Septoria-betegségei. Bot. Rev. 37:231-262.
- Straley, M. L. 1979. A Septoria nodorum (Berk.) Berk patogenezise. A búzafajtáknak a levélfoltossággal szembeni ellenállóképességében eltérő búzafajtákon. Doktori értekezés. Montana Állami Egyetem. 99 pp.
- Straley, M.L. és Scharen, A.L. 1979. A Septoria nodorum fejlődése rezisztens és fogékony búzaleveleken. Phytopathology 69:920-921.
- Weber, G.F. 1922. A gabonafélék Septoria-betegségei. Phytopathology 12:537-585.
- Babadoost, M. & Herbert, T.T. 1984. A búzacsemeték Septoria nodorum általi fertőzését befolyásoló tényezők. Phytopathology, 74: 592-595.
- Eyal, Z.E. 1981. A búza Septoria-betegségeinek integrált védekezése. Plant Dis., 65: 763-768.
- Eyal, Z., Sharen, A.L., Prescott, J.M. & van Ginkel, M. 1987. A búza Septoria betegségei: a betegségkezelés koncepciói és módszerei. Mexikó, DF, CIMMYT.
- Polley, R.W. & Thomas, M.R. 1991. A búza betegségeinek felmérése Angliában és Walesben, 1976-1988. Ann. Appl. Biol., 119: 1-20.
- Henze, Mathias: Entwicklung einer anbauparameter- und witterunsabhängigen Befallsprognose von Septoria tritici, CUVILLER VERLAG, Göttingen 2008
- B.M. Cunfer: Stagonospora and Septoria Pathogens of Cereals: A fertőzési folyamat, in Septoria and Stagonospora Diseases of Cereals: A Compilation of Global Research, M. van Ginkel, A. McNab, and J. Krupinsky szerkesztők, Proceedings of the Fifth International Septoria Workshop September 20-24, 1999, CIMMYT, Mexico.
Ajánlott felszerelés
Ellenőrizze, hogy melyik érzékelőkészletre van szükség a növény potenciális betegségeinek megfigyeléséhez.