Napraforgó betegségmodellek
lisztharmat
A napraforgón a lisztharmatot okozó gomba a következő néven ismert Plasmopara halstedii vagy Plasmopara helianthi. A gombakórokozó komplex az Asteraceae család számos nemzetségét megfertőzi, beleértve a vadon élő és termesztett fajok közül a Helianthus. A betegség mindenütt jelen van, ahol napraforgót termesztenek.
Életciklus
Egyetlen oospórából kiindulva, amely kicsírázik és zoosporangiumot hoz létre, a fejlődés további lépései a zoospórák differenciálódása és felszabadulása. Szabad víz jelenlétében a zoospórák hamarosan a fertőzési helyekre (gyökér, hipokotil) vándorolnak, ha azok rendelkezésre állnak. Az encisztálódást és a csíracső megnyúlását követően (ez utóbbi általában appresszóriumban végződik egy gazdasejt ellenében) a gomba a közvetlen penetrációhoz fertőzési struktúrát (fertőzési peg) fejleszt ki. Kísérleti körülmények között kimutatták, hogy a csíracsövek vízben általában nem képeznek appresszóriumot, de gazdasejtek jelenlétében igen (Gray és mtsai., 1985). A penetrációt követően a gomba intracellulárisan, majd intercellulárisan növekszik, és miután a fogékony (kompatibilis) gazdaszervezetben megtelepedett, az egész növényt szisztémásan kolonizálni kezdi, előnyösen a hajtáscsúcs felé, kisebb mértékben a gyökér irányába növekedve. Kedvező körülmények esetén a fertőzött leveleken és esetenként a föld alatti szöveteken aszexuális sporuláció megy végbe. A teljesen kifejlődött sporangiumok széllel terjednek, és mivel rövid életűek és érzékenyek a szárazságra és a közvetlen napsütésre, túlélésük az aktuális időjárási helyzettől függ. A fertőzött növényi részeken, elsősorban a gyökér és a szár alsó szöveteiben is termelődnek oospórák, míg a levelek és a felső növényi részek - a magok kivételével - mentesek ezektől a nyugvó spóráktól (Sackston, 1981; Virányi, 1988; Onan és Onogur, 1991). A gazdaszervezet fejlődésének legérzékenyebb szakasza a csírázás és a kelés között van (Meliala et al. 2000).
Túlélés és az oltóanyag forrása
Az elsődleges fertőzéssel kapcsolatban, P. halstedii talajban terjedő kórokozó. Oospórái elsődleges inokulumként szolgálnak a fiatal napraforgócsemeték föld alatti szöveteiben. Széllel is terjedhet, másodlagos fertőzést okozva a leveleken és/vagy a virágzaton. Ha ez utóbbi a helyzet, a gomba magról terjedő is lehet: a fertőzött magok micéliumot és/vagy oospórákat hordoznak magukban. Az oospórák főként a lisztharmatos növények gyökér- és alsó szárszöveteiben fejlődnek, látható tünetekkel vagy anélkül, és az előző napraforgótermés növényi maradványaival a talajba kerülnek. Az oospórák hosszú életűek, és legalább 6-8 évig képesek életben maradni (Sackston, 1981; Virányi, 1988). Általában úgy gondolják, hogy az oospórák elsősorban nedves körülmények között csíráznak. A csírázási dinamikáról azonban eddig csak kevés eredmény állt rendelkezésre. A nedvességet megelőző alacsony hőmérsékleti sokk és a gyökerek által kibocsátott gazdaszervezeti exudátumok jelenléte a csírázási folyamatot fokozó hatásúnak bizonyult (Delanoe, 1972). Egy másik jelentésben (Spring & Zipper 2000) nem volt megfigyelhető ilyen hőmérsékleti hatás, és a frissen kifejlődött oospórák 10-30 napon belül spontán csíráznak vízben, de igen változó ütemben (1-17%).
A másodlagos fertőzés azonban bizonyos régiókban, kedvező környezeti feltételek mellett a betegség terjedésének fontos tényezőjének tekinthető. Eltekintve attól a ténytől, hogy a virágzat másodlagos fertőzése a magok látens fertőzését eredményezheti a P. halstedii (Sackston, 1981), a helyi levélsérülésekből a gomba képes továbbhaladni és a szárba nőni, szisztémás fertőzést okozva (Spring 2001).
Epidemiológia
Az inokulum jellege (oospóra vagy zoospóra), az időjárási változók (relatív páratartalom, hőmérséklet), a fertőzés helye (a szövetek kora), valamint a fajta reakciója olyan tényezők, amelyek befolyásolják vagy meghatározzák a fertőzés folyamatát, a betegség előfordulását és súlyosságát. Az ivaros vagy aszexuális sporulációból származó zoospóráknak szabad vízre van szükségük ahhoz, hogy életképességüket megőrizzék, és képesek legyenek a fertőzési helyek felé mozogni. Következésképpen a fertőzés megindulásának előfeltétele az esőzés vagy az intenzív öntözés. Több tanulmány is kimutatta, hogy ha a vetést követő első két hétben elegendő eső vagy megfelelő vízellátás volt, akkor a talajból történő elsődleges fertőzés előfordulása megnőtt. A fertőzésnek kedvező időtartam azonban viszonylag rövid, és még a fogékony napraforgó is ellenállóvá válik a kor előrehaladtával (Sackston, 1981). Tourvieille és munkatársai (2008a) azt találták, hogy a lisztharmatfertőzés kockázata akkor tűnt a legnagyobbnak, ha a napraforgó palántáinak legérzékenyebb állapotában heves esőzések voltak, míg a vetés előtt vagy a kelés után lehullott heves esőzések nem voltak hatással a beteg növények százalékos arányára. Göre (2009), hogy az alacsony hőmérséklet és a kiterjedt tavaszi esőzések körülbelül 85% terméskiesés és alacsonyabb minőség a napraforgótermelésben a máramarosi régióban Trace. A környezeti feltételek mellett a betegség intenzitását a kórokozó populáció agresszivitása is befolyásolhatja. Sakr és munkatársai (2009) a populáció látenciaideje és sporulációs sűrűsége alapján meg tudták különböztetni a két kórokozótörzset agresszivitásuk szempontjából.
Vetési szempontok
P. halstedii a természetes úton fertőzött növényekből származó napraforgómagokban micélium vagy oospórák formájában is előfordult (Novotel'nova, 1966). Doken (1989) arról számolt be, hogy a micélium csak a testa és a perikarpium belső rétegében volt megtalálható; az embrióban nem volt jelen. Mesterséges beoltást követően Cohen és Sackston (1973) megerősítette, hogy a napraforgó rügyekbe beoltott napraforgóbimbókat P. halstedii szisztémásan megfertőződött és fertőzött magokat termelt. Oospórákat figyeltek meg a beoltott és a természetes úton fertőzött növények magjaiban. A vetőmagfertőzésről további adatok ismertek Iránból (Zad, 1978), Törökországból (Döken, 1989) és Németországból (Spring, 2001). A gomba általában a petefészekbe és a perikarpiumba hatol, de nem növekszik be az embrióba (Novotel'nova, 1966; Döken, 1989). A szisztémásan fertőzött növényekben rendszeresen előfordul a magfertőzés, ha azok a virágzásig túlélik. Ilyen esetekben az embrió fejlődése gyakran késleltetett vagy gátolt. Ráadásul az ilyen növények törpék, és ritkán leszüretelhetők. Növelhetik az oospórák helyi állományát egy szántóföldön, de a kórokozó magról történő, hosszú távú terjedése szempontjából kevésbé fontosnak tűnnek, mint a későn fertőzött, tünetmentes növények magjai (Spring, 2001). Az utóbbi típusú fertőzés nagymértékben függ a virágzás alatti időjárási viszonyoktól. Így száraz években a kórokozóval fertőzött magok száma nagyon alacsony, és nem haladhatja meg az ezerből néhányat, de egy hűvös és nedves június-júliusi időszak után sokkal magasabb lehet. Spring (2001) például egy németországi szántóföldről származó vetőmagok közel 10%-je volt fertőzött, Döken (1989) pedig kedvező kísérleti körülmények között a vizsgált vetőmagok 28%-jén figyelt meg gombás szerkezeteket.
Hatás a vetőmag minőségére
A lisztharmatos növényeken termő napraforgómagok vagy alulfejlettek, színtelenek, vagy ritkán egészségesnek tűnnek. Az ilyen fertőzött magvak még az utóbbi esetben is rossz minőségűek; rendellenes magoncokat hoznak létre, és a csírázási arány alacsony (Döken, 1989).
További információért tekintse meg a honlapot a CABI.
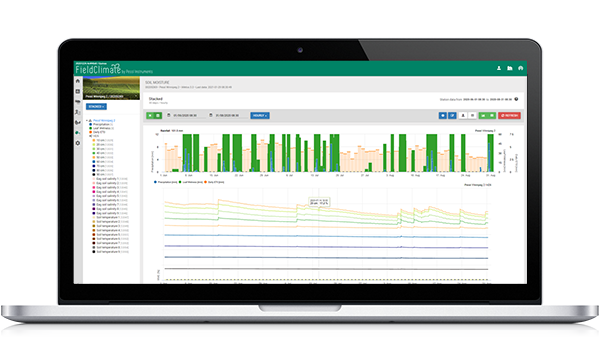
FieldClimate modell
Használt érzékelők: talajhőmérséklet, csapadék, levélnedvesség, levegő hőmérséklete és relatív páratartalma.
A fertőzés előrehaladását akkor kezdjük számítani, amikor a hőmérséklet 6 és 32°C között van, optimális esetben 18 és 24°C között, a talajhőmérséklet pedig 10°C felett van. A továbbiakban a nedves körülmények kedvezőek a betegség számára (esőzés, 70% feletti relatív páratartalom).
A makrosporangiumok 10°C feletti talajhőmérsékleten és csapadék esetén (relatív páratartalom több mint 70%) képződnek. Visszaáll, ha a relatív páratartalom 50% alá csökken.
Ha a Makrosporangiumok teljesen kifejlődtek - a talajfertőzés vagy a légfertőzés (a grafikonon elsődleges fertőzésnek nevezett) számításai megkezdődnek (levélnedvességi körülmények között).
A sporangiumok nedves körülmények között (több mint 95% r.h.), sötétben és 12°C feletti hőmérsékleten képződnek. Visszaállítása napközben történik, és amikor a sporangiumok még nem teljesen kifejlődtek.
Ha a sporangiumok teljesen kifejlődtek, a másodlagos fertőzés számítása a levegő hőmérsékletének függvényében kezdődik.
A grafikonon április végén egy hosszan tartó nedves időszakot látunk, amely makrospórák kialakulásához és talajfertőzéshez (elsődleges gyökérfertőzés) vezet. Május elsején nem határoztak meg légfertőzést (itt primer fertőzésnek nevezik), de a körülmények kedvezőek voltak, így május 2-án határozták meg. Ha a napraforgó palánták ekkor még érzékeny stádiumban vannak (éppen csak elvetett), akkor a védekezési méréseket figyelembe kell venni ( profilaktikus szisztémás gombaölő szerek, főként foszforsavak).
Hivatkozások:
- Achbani EH, Lamrhari A, Serrhini MN, Douira A, Tourvieille de Labrouche D, 1999. A vetőmagkezelések hatékonyságának értékelése a Plasmopara halstedii ellen. Bulletin OEPP, 29(4):443-449; 15 ref.
- Achbani EH, Tourvieille D, 1993. Le tournesol au Maroc. Phytoma, 448:30-32.
- Agrawal SC, Gupta RK, Prasad KVV, 1991. A napraforgó lisztharmatának egy esete Madhya Pradeshban. Journal of Oilseeds Research, 8(1):126.
- Albourie JM, Tourvieille J, Labrouhe DTde, 1998. A Plasmopara halstedii napraforgó kórokozó izolátumainak metalaxil rezisztenciája. European Journal of Plant Pathology, 104(3):235-242; 27 ref.
- Albourie JM, Tourvieille J, Tourvieille de Labrouhe D, 1998. Metalaxil-rezisztencia a lisztharmat francia izolátumaiban. In: Gulya T, szerk. Vear F, szerk. Proc. Third Sunflower Downy Mildew Symposium, Fargo, USA: ISA, 235-242.
- Bán R, Kovács A, Körösi K, Perczel M, Turóczi G, 2014. Első jelentés a Plasmopara halstedii (napraforgó lisztharmat) új, 714-es patotípusának magyarországi előfordulásáról. Plant Disease, 98(11):1580-1581.
- Bán R, Kovács A, Perczel M, Körösi K, Turóczi G, 2014. Első jelentés a Plasmopara halstedii 704-es patotípusának fokozott magyarországi elterjedéséről. Plant Disease, 98(6):844.
- Batinica J, Bes A, Dimic N, Numic R, Radman L, Ristanovic M, Vaclav V, 1973. Hozzájárulás a napraforgó káros faunájának és betegségeinek megismeréséhez a napraforgó termesztési területén a Boszniai és Hercegovinai Köztársaságban. Radovi Poljoprivrednog Fakulteta Univerziteta u Sarajevu, 21/22(24/25):203-210.
- Berlese AN, De-Toni JB, 1888. Phycomycetteae. In: Sylloge fungorum, VII:242.
- Bohár G, Vajna L, 1996. Az Ambrosia artemisifolia var. elatior (L.) Descourt. var. elatior (L.) Descourt. patogén mikroszkopikus gombák előfordulása Magyarországon. Növényvédelem, 32:527-528.
- Borovkov AY, McClean PE, 1993. Egy tandemszerűen ismétlődő szekvencia a Plasmopara halstedii genomjából. Gene, 124(1):127-130.
- Borovkova IG, Borovkov AY, McClean PE, Gulya TJ, Vick BA, 1992. Restrikciós töredékhosszúságú polimorfizmusok és RAPD markerek a Plasmopara halstedii, a napraforgó lisztharmatgomba DNS-ében. Proceedings of the 13th International Sunflower Conference Volume 2, Pisa, Italy, 7-11 September 1992., 1420-1425; 9 ref.
- Bouterige S, Robert R, Bouchara JP, Marot-Leblond A, Molinero V, Senet JM, 2000. A Plasmopara halstedii-re specifikus két monoklonális antitest előállítása és jellemzése. Applied and Environmental Microbiology, 66(8):3277-3282; 33 ref.
- Bouterige S, Robert S, Marot-Leblond A, Senet JM, 2000. ELISA-teszt kifejlesztése a Plasmopara halstedii antigének vetőmagban történő kimutatására. In: Proc. 15th Int. Napraforgó Konferencia Toulouse, Franciaország: ISA (F):44-49.
- CABI/EPPO, 1998. Az európai karanténkártevők elterjedési térképei (szerkesztette: Smith, I. M. és Charles, L. M. F.). Wallingford, UK: CAB International, xviii + 768 pp.
- CABI/EPPO, 2014. Plasmopara halstedii. Elterjedési térkép. Növénybetegségek elterjedési térképei, októberi szám. Wallingford, Egyesült Királyság: CABI, 286. térkép (6. kiadás).
- Choi YJ, Park MJ, Shin HD, 2009. Első koreai jelentés a Coreopsis lanceolata fürtös lisztharmatáról, amelyet a Plasmopara halstedii okoz. Plant Pathology, 58(6):1171.
- CMI, 1988. Növénybetegségek elterjedési térképei. A 286. számú térkép. Wallingford, Egyesült Királyság: CAB International.
- Cohen Y, Sackson WE, 1974. A napraforgó magfertőzése és látens fertőzése a Plasmopara halstedii által. Canadian Journal of Botany, 52:231-238.
- Delanoe D, 1972. Biologie et epidemiologie du mildiou du tournesol (Plasmopara helianthi Novot.). CETIOM Informations Techniques, 29:1-49.
- Delen N, Onogur E, Yildiz M, 1985. Hat Plasmopara helianthi Novot. izolátum metalaxil iránti érzékenységi szintje. Journal of Turkish Phytopathology, 14(1):31-36.
- Delos M, Penaud A, Lafon S, Walser P, De Guenin MC, Tourvieille J, Molinero V, Tourvieille D, 1997. Le mildiou de tournesol - Une maladie toujours d'actualitT. Phytoma, 495á:15-16.
- Doken MT, 1989. Plasmopara halstedii (Farl.) Berl. et de Toni napraforgómagban és a fertőzött magok szerepe a szisztémás tünetekkel rendelkező növények előállításában. Journal of Phytopathology, 124(1-4):23-26.
- Duarte LL, Choi YJ, Barreto RW, 2013. A Plasmopara halstedii által okozott lisztharmat első jelentése a Gerbera jamesonii-n Brazíliában. Plant Disease, 97(10):1382.
- EPPO, 2014. PQR adatbázis. Párizs, Franciaország: Európai és Mediterrán Növényvédelmi Szervezet.
- Európai és Mediterrán Növényvédelmi Szervezet, 2008. Plasmopara halstedii. OEPP/EPPO Bulletin, 38(3):343-348.
- Garcia GM, Gulya TJ, 1991. A napraforgó lisztharmat fajmegoszlása Észak-Dakotában és Minnesotában. In: Proceedings of the 1991 Sunflower Research Workshop, Fargo, USA: National Sunflower Association, 3-5.
- Giresse X, Labrouhe DTDe , Richard-Cervera S, 2007. Tizenkét polimorf expresszált szekvenciacímkéből származó marker a napraforgó lisztharmat kórokozójának, a Plasmopara halstedii-nek a markerei, 7:1363-1365.
- Göre ME, 2009. A Plasmopara halstedii által okozott lisztharmat járványos kitörései a napraforgón Törökország Máramarai régiójához tartozó Trákiában. Plant Pathology, 58(2):396.
- Gray AB, Sackston WE, Thauvette L, 1985. A Plasmopara halstedii fertőzési struktúráinak kialakulása napraforgósejtek szuszpenziójában. Canadian Journal of Botany, 63(10):1817-1819.
- Gray B, Sackston WE, 1983. A Plasmopara halstedii-vel beoltott napraforgó szövet- és sejtkultúráinak vizsgálata. Canadian Journal of Plant Pathology, 5:206.
- Greathead DJ, Greathead AH, 1992. A rovarkártevők biológiai védekezése rovarparazitoidok és ragadozók által: a BIOCAT adatbázis. Biocontrol News and Information, 13(4):61N-68N.
- Gullino ML, Garibaldi A, 1988. A legfontosabb cserepes virágos növények kriptogámiás betegségei. Panorama Floricolo, 13(5):4-8.
- Gulya TJ, 1995. Egyszerű módszer a lisztharmatra "rezisztens" napraforgóvonalak gyökérreakciójának értékelésére. In: Proceedings of the 17th Sunflower Research Workshop, Fargo, USA: National Sunflower Association, 63-66.
- Gulya TJ, 1995. Javaslat a napraforgó lisztharmatfajták osztályozásának felülvizsgált rendszerére. In: Proceedings of the 17th Sunflower Research Workshop, Fargo, USA: National Sunflower Association, 76-78.
- Gulya TJ, 1996. Napraforgóbetegségek az Észak-Alföldön. In: Proceedings of the 18th Sunflower Research Workshop, Fargo, USA: National Sunflower Association, 24-27.
- Gulya TJ, 2000. Metalaxil-rezisztencia a napraforgó lisztharmatában, valamint a genetikai és alternatív fungicidekkel való védekezés. In: Proc. 15th Int. Napraforgó Konferencia Toulouse, Franciaország: ISA (G):16-21.
- Gulya TJ, 2007. A napraforgóból származó Plasmopara halstedii fajok elterjedése a világon, 3:121-134.
- Gulya TJ, Rashid KY, Masirevic SM, 1997. Napraforgóbetegségek. In: Schneiter AA, szerk. Napraforgó technológia és termelés. Az Agronómia sorozat 35. száma. Wisconsin, USA: Amer. Soc. Agronomy, 263-379.
- Gulya TJ, Sackston WE, Viranyi F, Masirevic S, Rashid KY, 1991. A napraforgó lisztharmat kórokozójának (Plasmopara halstedii) új fajtái Európában, Észak- és Dél-Amerikában. Journal of Phytopathology, 132(4):303-311.
- Gulya TJ, Tourvieille de Labrouhe D, Masirevic S, Penaud A, Rashid K, Viranyi F, 1998. Javaslat a Plasmopara halstedii (napraforgó lisztharmat) fajtáinak egységesített nómenklatúrájára és azonosítására. In: Gulya T, szerk. Vear F, szerk. Harmadik napraforgó lisztharmat szimpózium. Fargo, USA: ISA, 130-136.
- Gulya TJ, Virányi F, Nowell D, Serrhini MN, Arouay K, 1996. A napraforgó lisztharmat új fajtái Európából és Afrikából. In: Proceedings of the 18th Sunflower Research Workshop, Fargo, USA: National Sunflower Association, 181-184.
- Gulya TJ, Woods DM, Bell R, Mancl MK, 1991. A napraforgó betegségei Kaliforniában. Plant Disease, 75(6):572-574.
- Hall G, 1989. A növénypatogén Oomycetes szokatlan vagy érdekes rekordjai. Növénykórtan, 38(4):604-611.
- Harmon PF, Dunkle LD, Latin R, 2003. Gyors PCR-alapú módszer a Magnaporthe oryzae kimutatására fertőzött évelő rizsből. Plant Disease, 87(9):1072-1076.
- Heller A, Rozynek B, Spring O, 1997. A Plasmopara halstedii által okozott látens fertőzéstípus citológiai és élettani okai a napraforgóban. Journal of Phytopathology, 145(10):441-445; 15 ref.
- Henning AA, Franca Neto JB, 1985. A lisztharmattal (Plasmopara halstedii (Farl.) Berlese et de Toni) szembeni rezisztencia fiziológiai fajtái és forrásai Brazíliában. In: Mar del Plata, Argentína: Proceedings of the 11th International Sunflower Conference, Mar del Plata, Argentina: Volume 2, 407-409.
- Hong CX, 2006. A Rudbeckia fulgida cv. Goldsturm fürtös lisztharmata a Plasmopara halstedii által Virginiában. Plant Disease, 90(11):1461. HTTP://www.apsnet.org
- Hua Z, Ma G, 1996. A kínai napraforgóbetegségek kutatásának áttekintése. In: International Sunflower Conference, Peking, Kína: ISC-LAAS, 754-759.
- Intelmann F, Spring O, 2002. A teljes DNS elemzése miniszatellita és egyszerű szekvencia ismétlődő primerekkel a Plasmopara halstedii populációvizsgálataihoz. Canadian Journal of Microbiology, 48(6):555-559; 25 ref.
- IPPC, 2010. A Plasmopara halstedii első egyesült királyságbeli előfordulása. Az IPPC hivatalos kártevőjelentése, GBR-23/1. Róma, Olaszország: FAO.
- Jardine DJ, Gulya TJ, 1994. A Plasmopara halstedii által okozott lisztharmat első jelentése napraforgón Kansasban. Plant Disease, 78(2):208.
- Kinga R, Bíró J, Kovács A, Mihalovics M, Nébli L, Piszker Z, Treitz M, Végh B, Csikász T, 2011. Egy új napraforgó lisztharmat faj megjelenése az Alföld délkeleti régiójában. (Újabb napraforgó-peronoszpóra rassz megjelenése Magyarországon, a Dél-keleti Alföldi régióban.) Növényvédelem, 47(7):279-286.
- Kola K, 1980. Napraforgófajták összehasonlító vizsgálata a gombabetegségekkel szembeni ellenálló képességük felmérésére a Zadrima területén. Buletini i Shkencave Bujqesore, 19:87-94.
- Komjáti H, Walcz I, Virányi F, Zipper R, Thines M, Spring O, 2007. A Xanthium strumariumból származó Plasmopara angustiterminalis izolátum jellemzői. European Journal of Plant Pathology, 119(4):421-428.
- Kucmierz J, 1976. Plasmopara helianthi Novot., egy új gombafaj Lengyelországban. Fragmenta Floristica et Geobotanica, 22(3):373-375.
- Labrouhe DDe , Walser P, Serre F, Roche S, Vear F, 2008. A tavaszi csapadék és a napraforgó Plasmopara halstedii (lisztharmat) általi fertőzése közötti összefüggések. Cordoba, Spanyolország, 2008. június 8-12. In: A 17. Nemzetközi Napraforgókonferencia jegyzőkönyvei, szerkesztette: Velasco, L. Saville, Spanyolország: Mezőgazdasági és Halászati Tanács, 97-102.
- Lafon S, Penaud A, Walser P, De Guenin M-Ch, Molinero V, Mestres R, Tourvieille D, 1996. Le mildiou du tournesol toujour sou surveillance. Phytoma, 484:35-36.
- Leite RMVBde C, Henning AA, Rodrigues SR, Oliveira MFde, 2007. A Plasmopara halstedii kimutatása és változékonysága Brazíliában, valamint a napraforgó genotípusainak rezisztenciája a lisztharmattal szemben (Detecção e variabilidade de Plasmopara halstedii no Brasil e avaliação da resistência de genótipos de girassol ao míldio.). Summa Phytopathologica, 33(4):335-340.
- Leppik EE, 1966. A Plasmopara halstedii komplex eredetéről és specializációjáról a Compositae családban. FAO Plant Protection Bulletin, 14:72-76.
- Liese AR, Gotlieb AR, Sackston WE, 1982. Enzimhez kötött immunszorbent teszt (ELISA) alkalmazása a lisztharmat (Plasmopara halstedii) kimutatására napraforgóban. In: Proceedings of the 10th International Sunflower Conference, Surfers Paradise, Australia, 173-175.
- Ljubich A, Gulya TJ, 1988. Kotyledon-korlátozott szisztémás lisztharmatfertőzés. In: Proceedings of the 1988 Sunflower Research Workshop, Bismarck, USA: National Sunflower Association, 9.
- Masirevic S, 1992. A napraforgó lisztharmat (Plasmopara halstedii) nálunk és a világon előforduló fajtái. Zbornik Radova, 20:405-408.
- Mayee CD, Patil MA, 1987. A napraforgó lisztharmata Indiában. Tropical Pest Management, 33(1):81-82.
- Melero-Vara JM, Garcia-Baudin C, Lopez-Herrera CJ, Jimenez-Diaz RM, 1982. A napraforgó lisztharmat elleni védekezés metalaxillal. Plant Disease, 66(2):132-135.
- Melero-Vara JM, Molinero Luiz L, Merino A, Dominguez J, 1996. Razas de Plasmopara halstedii presentes en Espana y evaluacion de susceptibilidad en hibridos comerciales. In: Proceedings of the ISA Symposium I, Disease Tolerance in Sunflower, Peking, Kína: International Sunflower Association, 7-13.
- Meliala C, Vear F, Labrouhe DTde, 2000. A napraforgó lisztharmat (Plasmopara halstedii) fertőzésének időpontja és a tünetek kialakulása közötti kapcsolat. Helia, 23(32):35-44.
- Molinero-Ruiz ML, Domfnguez J, Melero-Vara JM, 2002. A Plasmopara halstedii spanyolországi izolátumainak fajtái és virulenciájuk vizsgálata. Plant Disease, 86(7):736-740; 28 ref.
- Moses GJ, 1989. A napraforgó lisztharmat új előfordulása Andhra Pradeshban. Journal of Research APAU, 17(1):73.
- Nandeeshkumar P, Ramachandra K, Prakash HS, Niranjana SR, Shetty H, 2008. A napraforgó lisztharmat elleni rezisztencia indukálása rizobaktériumokkal, 3(4):255-262.
- Nandeeshkumar P, Sarosh BR, Kini KR, Prakash HS, Shetty HS, 2009. A rezisztencia és a védekezéssel kapcsolatos fehérjék kiváltása béta-amino-vajsavval napraforgóban a Plasmopara halstedii lisztharmat kórokozóval szemben. Archives of Phytopathology and Plant Protection, 42(11):1020-1032.
- Nandeeshkumar P, Sudisha J, Ramachandra KK, Prakash HS, Niranjana SR, Shekar SH, 2008. A kitozán által kiváltott rezisztencia a Plasmopara halstedii által okozott lisztharmattal szemben napraforgóban. PMPP Physiological and Molecular Plant Pathology, 72(4/6):188-194.
- Nikolov G, 1981. Apron 35 SD, hatékony készítmény a napraforgó lisztharmat elleni védekezésben. Rastitelna Zashchita, 29(3):40-41.
- Nishimura M, 1922. A Plasmopara halstedii tanulmányozása. J. Coll. Agric, 3(XI):185-210.
- Novotel'nova NS, 1966. A napraforgó lisztharmata. Moszkva, Szovjetunió: Nauka.
- Onan E, Onogur E, 1989. A napraforgó lisztharmata (Plasmopara helianthi Novot.). Ege Universitesi Ziraat Fakultesi Dergisi, 26(1):271-286.
- Onan E, Onogur E, 1991. Vizsgálatok a napraforgó lisztharmat (Plasmopara helianthi Novot.) gazdanövénye és kórokozója közötti kapcsolatról. Journal of Turkish Phytopathology, 20(1):1-10.
- Oros G, Viranyi F, 1987. A napraforgó lisztharmat (Plasmopara halstedii) elleni fungicidek üvegházi értékelése. Annals of Applied Biology, 110(1):53-63.
- Patil MA, Mayee CD, 1988. A napraforgó lisztharmatának vizsgálata Indiában. In: Nemzetközi Napraforgó Konferencia, Újvidék, Jugoszlávia: 2:42.
- Patil MA, Phad HB, Ramtirthkar MS, 1993. A nemrégiben behurcolt napraforgó lisztharmat előfordulása és elterjedése Maharashtrában. Journal of Maharashtra Agricultural Universities, 18(1):129-130.
- Rahmani Y, Madjidieh-Ghassemi S, 1975. A napraforgó különböző fajtáinak és beltenyésztett vonalainak a Plasmopara helianthi Novt. lisztharmattal szembeni relatív rezisztenciájának vizsgálata üvegházban és kísérleti szántóföldi vizsgálatban, 1973. Iranian Journal of Plant Pathology, 11(3/4):96-104; 42-45.
- Rashid KY, 1991. Napraforgó lisztharmat Manitobában. In: Fargo, USA: National Sunflower Association, 12.
- Rashid KY, 1993. A Plasmopara halstedii előfordulása és virulenciája napraforgón Nyugat-Kanadában 1988-1991-ben. Canadian Journal of Plant Pathology, 15(3):206-210.
- Rivera Y, Rane K, Crouch JA, 2014. A Plasmopara halstedii által okozott lisztharmat első jelentése a fekete szemű susán (Rudbeckia fulgida cv. 'Goldsturm') fakófajdról Marylandben. Plant Disease, 98(7):1005-1006.
- Roeckel-Drevet P, Coelho V, Tourvieille J, Nicolas P, Labrouhe DTde, 1997. A genetikai variabilitás hiánya a Plasmopara halstedii, a Helianthus annuus napraforgó lisztharmatának okozója, Franciaországban azonosított fajtáiban. Canadian Journal of Microbiology, 43(3):260-263; 23 ref.
- Roeckel-Drevet P, Tourvieille J, Drevet JR, Says-Lesage V, Nicolas P, Labrouhe DTde, 1999. Polimeráz láncreakciós diagnosztikai teszt kifejlesztése a Plasmopara halstedii biotróf kórokozó kimutatására napraforgóban. Canadian Journal of Microbiology, 45(9):797-803; 27 ref.
- Rozynek B, Spring O, 2000. A napraforgó lisztharmat patotípusai Németország déli részein. Helia, 23(32):27-34; 18 ref.
- Rozynek B, Spring O, 2001. A levéllemezes oltás, gyors és pontos teszt a napraforgó lisztharmat metalaxil-toleranciájának szűrésére. Journal of Phytopathology, 149(6):309-312; 17 ref.
- Ruiz MLM, Dominguez J, Vara JMM, Gulya TJ, 2000. A Plasmopara halstedii spanyol izolátumainak metalaxil-toleranciája. In: Proc. 15th Int. Napraforgó Konferencia Toulouse, Franciaország: ISA, (G):11-15.
- Sackston WE, 1981. A napraforgó lisztharmata. In: Spencer DE, szerk. The Downy Mildews. London, UK: Academic Press, 545-575.
- Sackston WE, 1992. Futószalagon: napraforgó nemesítése a betegségekkel szembeni ellenálló képesség érdekében. Annual Review of Phytopathology, 30:529-551; 123 ref.
- Sackston WE, Anas O, Paulitz T, 1992. A napraforgó lisztharmat biológiai védekezése. In: Abstracts of the American Phytopathological Society North-East Division Meeting, Portland, USA: 33.
- Sakr N, Ducher M, Tourvieille J, Walser P, Vear F, Labrouhe DTde, 2009. A Plasmopara halstedii (napraforgó lisztharmat) agresszivitásának mérésére szolgáló módszer. Journal of Phytopathology, 157(2):133-136.
- Says-Lesage V, Meliala C, Nicolas P, Roeckel-Drevet P, Tourvieille de Labrouhe D, Archambault D, Billaud F, 2001. Molekuláris teszt a lisztharmat (Plasmopara halstedii) jelenlétének kimutatására napraforgómagban. OCL - Ole^acute~agineux, Corps Gras, Lipides, 8(3):258-260; 5 ref.
- Schuck E, Jobim CIP, 1988. A napraforgó (Helianthus annuus L.) betegségei Viamaóban és Santo Augustóban, Rio Grande do Sulban. Agronomia Sulriograndense, 24(2):221-232; 12 ref.
- Simay EI, 1993. Budapest Budatétény és Cinkota területén megfigyelt ritka mikrogombák előfordulása. Mikológiai Kozlemenyek, 32(1-2):81-89.
- Skoric D, 1994. A napraforgó nemesítése a domináns betegségekkel szembeni rezisztencia érdekében. In: Proceedings of the EUCARPIA Oil and Protein Crops Section, Symposium on Breeding of Oil and Protein Crops, Albena, Bulgária, 30-48.
- Spring O, 2000. Homotallikus ivaros szaporodás a Plasmopara halstedii-nél, a napraforgó lisztharmatánál. Helia, 23(32):19-26; 13 ref.
- O tavasz, 2001. A napraforgó nem szisztémás fertőzése a Plasmopara halstedii-vel és feltételezett szerepük a kórokozó elterjedésében. Journal of Plant Diseases and Protection, 108:329-336.
- Spring O, Benz A, Faust V, 1991. A lisztharmat (Plasmopara halstedii) fertőzés hatása a napraforgó fejlődésére és anyagcseréjére. Zeitschrift fur Pflanzenkrankheiten und Pflanzenschutz, 98(6):597-604.
- Spring O, Haas K, 2002. A Plasmopara halstedii zsírsavösszetétele és taxonómiai jelentősége. European Journal of Plant Pathology, 108(3):263-267; 20 ref.
- Spring O, Miltner F, Gulya TJ, 1994. A napraforgó lisztharmat (Plasmopara halstedii) új fajtái Németországban. Journal of Phytopathology, 142(3-4):241-244.
- Spring O, Rozynek B, Zipper R, 1998. A napraforgó lisztharmat egyspórás fertőzése. Journal of Phytopathology, 146(11/12):577-579; 7 ref.
- Spring O, Zipper R, 2000. A napraforgó lisztharmat, Plasmopara halstedii oospóráinak izolálása és az oospórák csírázásának mikroszkópos vizsgálata. Journal of Phytopathology, 148(4):227-231; 15 ref.
- Spring O, Zipper R, 2006. Bizonyíték az aszexuális genetikai rekombinációra a napraforgó lisztharmatában, a Plasmopara halstedii-ben. Mycological Research, 110(6):657-663.
- Sudisha J, Niranjana SR, Sukanya SL, Girijamba R, Devi NL, Shetty HS, 2010. A strobilurin készítmények relatív hatékonysága a napraforgó lisztharmat elleni védekezésben. Journal of Pest Science, 83(4):461-470.
- Thanassoulopoulos CC, Mappas CB, 1992. A napraforgó lisztharmatának első jelentése Görögországban. Növénybetegségek, 76(5):539.
- Tourvieille J, Roeckel-Drevet P, Nicolas P, Tourvieille de Labrouhe D, 1996. A napraforgó lisztharmat (Plasmopara halstedii) fajtáinak jellemzése RAPD-vel. In: Proceedings of the 14th International Sunflower Conference, Peking, 781-785.
- Vida R, 1966. A napraforgó lisztharmata: jelentős visszatérés. Növényvédelem, 32:533-535.
- Virányi F, 1984. A napraforgó lisztharmatának legújabb kutatásai Magyarországon. Helia, 7:35-38.
- Virányi F, 1988. A Plasmopara halstedii oospóraképződését befolyásoló tényezők. In: Proceedings of the 12th International Sunflower Conference, Novi Sad, Yugoslavia, Vol, 2:32.
- Viranyi F, Gulya TJ, 1995. A magyarországi Plasmopara halstedii (napraforgó lisztharmat) virulenciájának izolátumok közötti eltérése. Növénykórtan, 44(4):619-624.
- Virányi F, Gulya TJ, 1995a. A Plasmopara halstedii patogén variációja. In: Abstracts of papers of the 1st International Symposium on Downy Mildew Fungi, Gwatt, Svájc: Federation of European Microbiological Societies, Ciba-Geigy.
- Virányi F, Gulya TJ, 1996. A rezisztencia kifejeződése a Plasmopara halstedii - napraforgó patoszisztémában. In: Proceedings of the ISA Symposium I, Disease Tolerance in Sunflower, Peking, Kína: International Sunflower Association, 14-21.
- Viranyi F, Sziraki I, 1986. A Plasmopara halstedii és a napraforgó kettős kultúrájának létrehozása. Transactions of the British Mycological Society, 87(2):323-325.
- Viranyi F, Walcz I, 2000. Populációs vizsgálatok a Plasmopara halstedii-n: gazdaspecifikusság és gomba-tolerancia. In: Proceedings of the 15th International Sunflower Conference Toulouse, France: ISA, (I):55-60.
- Walcz I, Bogßr K, Virßnyi F, 2000. A Plasmopara halstedii egy ambróziai izolátumának vizsgálata. Helia, 23(33):19-24; 8 ref.
- Yang SM, Wei SE, 1988. A termesztett napraforgó betegségei Liaoning tartományban, a Kínai Népköztársaságban. Plant Disease, 72(6):546.
- Yorinori FT, Henning AA, Ferreira LP, Homechin M, 1985. A napraforgó betegségei Brazíliában. In: Mar del Plata, Brazília, 459.
- Zad J, 1978. A napraforgó lisztharmatának vetőmaggal való terjedése. Iranian Journal of Plant Pathology, 14(1/4):1-2; 1-7.
- Zazzerini A, 1978. A Plasmopara helianthi Novot elterjedése a lejtés függvényében. Phytopathologia Mediterranea, 17(3):153-156.
- Zazzerini A, 1983. A napraforgó Peronospora-betegsége (Plasmopara helianthi Novot.): a parazita fiziológiai fajai és a fertőzött anyag azonosításának módszerei. Informatore Fitopatologico, 33(2):117-119.
- Zimmer DE, 1974. A Plasmopara halstedii amerikai és európai fajai közötti fiziológiai specializáció. Phytopathology, 64(11):1465-1467
Sclerotinia rothadás
A szkleróciumok karpogén csírázását a folyamatos talajnedvesség serkenti. A talaj felszínén apotéciumok képződnek, amelyekből aszkospórák szabadulnak fel a levegőbe. A legtöbb növényfaj fertőzése elsősorban az aszkospórákkal történik, de az egészséges, ép növényi szövetek közvetlen fertőzése a csírázó aszkospórákból általában nem fordul elő. Ehelyett az egészséges növények levél- és szárszövetének fertőzése csak akkor következik be, ha a csírázó aszkospórák a fertőzési struktúrák kialakulása és a behatolás előtt az elhalt vagy elöregedő szöveteket, általában a virágrészeket, például a levágott szirmokat kolonizálják. A szkleróciumok mikeliogén csírázása a talaj felszínén szintén eredményezheti az elhalt szerves anyagok kolonizációját, a szomszédos élő növények későbbi fertőzésével. Egyes növényekben, például a napraforgóban a szkleróciumok mikeliogén csírázása azonban közvetlenül elindíthatja a gyökerek és az alapszár fertőzési folyamatát, ami hervadáshoz vezet. A napraforgóban a mikeliogén csírázás és fertőzés kiváltó oka nem ismert, de valószínűleg a gazdanövényektől származó táplálkozási jelektől függ a rizoszférában.
A fertőzés folyamata
Az egészséges szövetek fertőzése az appresszorium kialakulásától függ, amely a gazdaszervezet felszínétől függően egyszerű vagy összetett szerkezetű lehet. A legtöbb esetben a behatolás közvetlenül a kutikulán keresztül történik, nem pedig a sztómákon keresztül. Az appressóriumok a gazdaszervezet felületén növekvő hifák terminális, dichotóm elágazásaiból fejlődnek ki, és széles, többszeptumos, rövid hifákból álló, a gazdaszervezet felületére merőlegesen tájolt, nyálkával rögzített párnából állnak. Az összetett appressóriumokat gyakran nevezik fertőzési párnának. Bár a korábbi munkások a kutikula behatolását tisztán mechanikus folyamatnak tekintették, az ultrarendszeri vizsgálatok alapján erős bizonyíték van arra, hogy a kutikula enzimatikus emésztése is szerepet játszik a behatolási folyamatban. Keveset tudunk a S. sclerotiorum cutinázok, azonban a genom legalább négy cutinázszerű enzimet kódol (Hegedus nem publikált). Úgy tűnik, hogy a behatolás előtt az appresszorium csúcsán kialakuló nagyméretű vezikulát a behatolás során a gazdaszervezet kutikulájába szabadítják. A kutikulába való behatolás után egy szubkutikuláris vezikulum képződik, amelyből nagyméretű hifák nőnek ki, amelyek átnövik és feloldják az epidermisz szubkutikuláris falát.
Fertőzés a járványos sejtek enzimatikus lebontásával: Az oxálsav a sejtfalat lebontó enzimekkel, például a poligalakturonázzal (PG) együttműködve a gazdaszövet pusztulását idézi elő azáltal, hogy olyan környezetet teremt, amely kedvez a PG támadásának a középső lamellában lévő pektin ellen. Ez viszont olyan alacsony molekulatömegű származékokat szabadít fel, amelyek további PG-gének kifejeződését indukálják. Valójában a PG általános aktivitását a pektin vagy a pektinből származó monoszacharidok, mint például a galakturonsav indukálják, és glükóz jelenléte elnyomja. Az egyes Sspg gének expressziós mintázatának vizsgálata feltárta, hogy a PG-k és a gazdaszervezet közötti kölcsönhatás a fertőzés különböző szakaszaiban finoman összehangolt. (Dwayne D. Hegedus *, S. Roger Rimmer: Sclerotinia sclerotiorum: Mikor ''lenni vagy nem lenni'' kórokozó? FEMS Microbiology Letters 251 (2005) 177-184)
A fertőzés éghajlati feltételeinek keresése S. sclerotiorum figyelembe kell venni az apotéciumok képződését, a sporulációt, az apotéciumok általi közvetlen fertőzést (még ha ez nem is történik túl gyakran) és a fertőzött micéliumokból a járványos sejtek encimatikus lebomlása révén történő fertőzést. Apotheciumok képződése és sporuláció akkor következik be, ha a 8 mm-nél nagyobb eső után 20 óránál hosszabb ideig tartó magas relatív páratartalom következik, 21 °C és 26 °C közötti optimális hőmérsékleten.
Közvetlen fertőzés Apothecia által a levelek nedvesedése után várható, amelyet 16 órán át tartó, a 90%-nél magasabb relatív páratartalom követ az optimális 21°C-26°C közötti hőmérsékleten ("appressoriális fertőzés"). Míg a szaprofita növekedés, amelyet a hámsejtek encimatikus degratációja követ ("hidrolitikus fertőzés") várható a 80% kissé alacsonyabb relatív páratartalom mellett, amely 24 órán át tart, 21°C és 26°C közötti optimális körülmények között.
Irodalom:
- Lumsden, R.D. (1976) A Sclerotinia sclerotiorum pektolitikus enzimei és lokalizációjuk a fertőzött babon. Can. J. Bot. 54,2630-2641.
- Tariq, V.N. és Jeffries, P. (1984) Appresszoriumképződés a Sclerotinia sclerotiorum által: pásztázó elektronmikroszkópia. Trans. Brit. Mycol. Soc. 82, 645-651.
- Boyle, C. (1921) Tanulmányok a parazitizmus fiziológiájáról. VI. A Sclerotinia libertiana fertőzése. Ann. Bot. 35, 337-347.
- Abawi, G.S., Polach, F.J. és Molin, W.T. (1975) Infection of bean by ascospores of Whetzelinia sclerotiorum. Phytopathology 65, 673-678.
- Tariq, V.N. és Jeffries, P. (1986) Ultrastructure of penetration of Phaseolus spp. by Sclerotinia sclerotiorum. Can. J. Bot. 64, 2909- 2915.
- Marciano, P., Di Lenna, P. és Magro, P. (1983) Oxálsav, sejtfalbontó enzimek és pH a patogenezisben, valamint jelentőségük két Sclerotinia sclerotiorum izolátum virulenciájában a napraforgón. Physiol. Plant Pathol. 22, 339-345.
- Fraissinet-Tachet, L. és Fevre, M. (1996) A Sclerotinia sclerotiorum ppectinolitikus enzimtermelésének galakturonsav általi szabályozása. Curr. Microbiol. 33, 49-53.
A Sclerotinia modell gyakorlati alkalmazása
A fehér lábú fertőzés modellje azokat az időszakokat mutatja, amikor az apotéciumok kialakulása várható. Ha ezek az időszakok egybeesnek a repcemag vagy a repce virágzási időszakával, akkor a következőkre kell számítanunk S. sclerotiorum fertőzések nedves időszakban. Az apotéciumokban képződött spórák egytől több napig is rendelkezésre állhatnak. A fertőzések lehetőségét a fertőzés előrehaladásának számítása jelzi a közvetlen vagy közvetett, appresszóriumok vagy enzimatikus sejtfallebontás útján történő fertőzések esetében. Ha a fertőzés előrehaladását jelző vonal eléri az 100% értéket, akkor fertőzést kell feltételezni. Ezeket a fertőzéseket megelőzően vagy gyógyhatású gombaölő szerrel kell kezelni. S. sclerotiorum kell használni.
Szürke penész
Szürke penész (Botrytis cinerea) egy pusztító betegség, amely nagy gazdasági hatással van a termelésre. B. cinerea a virágokat és az éréshez közeli gyümölcsöket fertőzi.
A gombás kórokozónak nagyon széles a gazdanövények köre, több mint 200 különböző gazdanövényt fertőz meg. A gombásodás szaprofita és parazita módon történik.
Tünetek
A napraforgón a kórokozó szürkepenészt okoz a fejen és a száron. A levelek pedig elkezdenek kiszáradni. Ezek a tünetek a magok érése közben jelentkeznek a fejen. A hátoldalon barna foltok láthatók. Ezeket a foltokat a gomba micéliuma és spórái borítják, ami porhanyós megjelenést kölcsönöz. A spórák nedves időjárási körülmények között képesek terjedni.
A fekete, a bélhártyától megfosztott szkleróciumok a betakarítás után megjelennek a terménytörmeléken, vagy közvetlenül a növényeken, ha túl későn takarítják be őket.
A gomba a tél folyamán a talaj felszínén vagy a talajban telel át micélium vagy szklerócium formájában. Tavasszal az áttelelő forma csírázni kezd és konídiumokat termel. Ezek a konídiumok a szél és az eső által terjednek, és új növényi szöveteket fertőznek meg.
A csírázás 85% feletti relatív páratartalom mellett lehetséges. Az optimális csírázási hőmérséklet 18°C. A gombakórokozó többször is képes szaporodni.
Vezérlési lehetőségek: A vetőmag-szabályozás megvédheti a növényeket a nedvességtől. A kémiai védekezés a kórokozó rezisztenciája miatt nehézkes. Ezért a Trichoderma harzianummal próbálkoznak természetes védekezési stratégiákkal.
A fertőzés modellezésének feltételei
B. cinerea A fertőzések a szabad nedvességgel kapcsolatosak. Ezért a szabadföldi termelésben a levélnedvességet határozzák meg, amely jó indikátor.
Bulger és munkatársai (1987) a virágzás alatti levélnedvességi időszakok és a gyümölcsökön megjelenő szürkepenész összefüggését vizsgálták. Megállapították, hogy 20°C-on a fertőzés nagyobb kockázatához 32 óránál hosszabb levélnedvesítési időre van szükség. Alacsonyabb hőmérsékleten a betegség fertőzéséhez a levélnedvesítési időszakoknak hosszabbnak kell lenniük.
Az FieldClimate a Botrytis cinerea kockázatát jelzi a levélnedvességi időszakok és az ezekben az időszakokban mért hőmérséklet alapján.
Az alábbi ábra a nedves levelek időtartamát mutatja a tényleges hőmérséklet függvényében. Botrytis fertőzés. Ha a kockázat nagyobb, mint 0, akkor minden 4 óránál hosszabb levélnedvesítési időszak ugyanilyen arányban növeli a kockázatot.
A 4 óránál rövidebb levélnedvesedési periódusú napot száraz napnak kell tekinteni, és a kockázatot a tényleges érték 20%-vel csökkenti.
A szürke penész modell gyakorlati alkalmazása: A modell olyan időszakokat jelez, amelyekben a kockázat Botrytis fertőzés. Ez a kockázati időszak a szamóca virágzása alatt fertőzött gyümölcsökhöz vezet. Minél tovább tart a kockázati időszak és minél nagyobb a kockázat, annál nagyobb a valószínűsége és a fertőzött gyümölcsök száma. A figyelembe vehető kockázat a piactól függ. Azok a termelők, akik a gyümölcsüket szupermarketeknek adják el, nem vállalnak kockázatot, mivel tudják, hogy nem tudnak fertőzött gyümölcsöt értékesíteni. Míg azok a termelők, akik közvetlenül az embereknek adják el a gyümölcsüket, nagyobb kockázatot vállalhatnak.
Irodalom:
- Bulger M.A., Ellis M. A., Madden L. V. (1987): A hőmérséklet és a nedvesség druáció hatása az eper virágainak Botrytis cinerea fertőzésére és a fertőzött virágokból származó gyümölcsök megbetegedésének előfordulására. Ecology and Epidemiology; Vol 77 (8): 1225-1230.
- Sosa-Alvarez M., Madden L.V., Ellis M.A. (1995): A hőmérséklet és a nedvességtartam hatása a Botrytis cinerea sporulációjára a szamóca levélmaradványain. Növénybetegségek 79, 609-615.
TomCast
A TOMCAST (TOMato disease foreCASTing) egy szántóföldi adatokon alapuló számítógépes modell, amely megpróbálja megjósolni a gombabetegségek, nevezetesen a korai foltosság, a Septoria levélfoltosság és az antraknózis kialakulását a paradicsomon. A szántóföldön elhelyezett adatgyűjtők óránként rögzítik a levélnedvesség és a hőmérséklet adatait. Ezeket az adatokat 24 órán keresztül elemezték, és ennek eredményeként kialakulhat egy A betegség súlyossági értéke (DSV); lényegében a betegség kialakulásának növekedése. A DSV felhalmozódásával a betegségnyomás tovább növekszik a növényen. Ha a felhalmozódott DSV-k száma meghaladja a permetezési intervallumot, a betegségnyomás enyhítésére gombaölő szerek alkalmazása ajánlott.
A TOMCAST az eredeti F.A.S.T. (Forecasting Alternaria solani on Tomatoes) modellből származik, amelyet Dr. Madden, Pennypacker és MacNab? fejlesztettek ki a Pennsylvania Állami Egyetemen (PSU). A PSU F.A.S.T. modelljét Dr. Pitblado az Ontario állambeli Ridgetown College-ban tovább módosította az Ohio State University Extension által használt TOMCAST modellé. A DSV: A betegség súlyossági értéke (DSV) a betegség (korai foltosság) kifejlődésének egy adott fokozata számára adott mértékegység. Más szóval, a DSV egy számszerű ábrázolása annak, hogy a betegség (korai foltosság) milyen gyorsan vagy lassan halmozódik fel egy paradicsomültetvényen. A DSV-t két tényező határozza meg: a levélnedvesség és a hőmérséklet a "levélnedves" órák alatt. A levélnedves órák számának és a hőmérsékletnek a növekedésével a DSV gyorsabban halmozódik fel. Lásd az alábbi táblázatot a betegség súlyossági értékéről.
Ezzel szemben, amikor kevesebb a levélnedves órák száma és alacsonyabb a hőmérséklet, a DSV lassan halmozódik fel, ha egyáltalán felhalmozódik. Ha a felhalmozódott DSV-k összlétszáma meghalad egy előre meghatározott határértéket, amelyet permetezési intervallumnak vagy küszöbértéknek neveznek, gombaölő szeres permetezés ajánlott a lombozat és a termés védelme érdekében a betegség kialakulásától.
A permetezési időköz (amely meghatározza, hogy mikor kell permetezni) 15-20 DSV között lehet. A pontos DSV-t, amelyet a termelőnek használnia kell, általában a feldolgozó adja meg, és a gyümölcs minőségétől függ. A 15 DSV permetezési időköz betartása a TOMCAST rendszer konzervatív használata, ami azt jelenti, hogy gyakrabban kell permeteznie, mint annak a termelőnek, aki 19 DSV permetezési időközzel permetez a TOMCAST rendszerrel. A kompromisszum a szezon során alkalmazott permetezések számában és a gyümölcsminőségben mutatkozó lehetséges különbségekben rejlik.
A Michigan Staate Egyetemen vizsgálatokat indítottak a TomCast nevű betegség-előrejelző rendszer tesztelésére a sárgarépa lombfoltosságának kezelésére. A TomCastot kereskedelmi forgalomban már használták a paradicsomtermesztésben, és nemrégiben adaptálták a spárga betegségkezelésére. Az MSU Muck Soils Research Farmon a 'Early Gold' feldolgozó sárgarépát precíziós vákuumos vetőgéppel ültették el három sorban, egymástól 18 hüvelyk távolságra egy 50 láb hosszú emelt ágyáson. A sárgarépa ágyások 64 hüvelykes sortávolsággal, a soron belüli magtávolság pedig 1 hüvelyk volt. A kísérlet mind a négy ismétlése 36 ágyból álló, különálló sárgarépablokkokban helyezkedett el. Minden ismétlésben tizenhét, 20 láb hosszú kezelési ágyat helyeztek el véletlenszerűen, sakktáblás elrendezésben. A kezeléseket egy CO2-s hátizsákos permetezőgéppel végezték, amelyet úgy kalibráltak, hogy 8002-es lapos ventilátoros fúvókákkal hektáronként 50 gallon permetoldatot juttasson ki. A kezelések a Bravo Ultrex 82,5WDG (22,4 oz/A) kezeletlen és Quadris 2,08SC (6,2 fl oz/A) váltakozásából álltak. A vegyszeres programot 10 napos naptári program szerint alkalmazták, valamint a TomCast betegség-előrejelző program előrejelzései szerint. A gombaölő szerek kijuttatásának időzítéséhez három különböző, 15, 20 és 25 DSV küszöbértéket használtak. Amikor az összesített napi DSV-értékek elérték a meghatározott küszöbértéket, permetezést alkalmaztak. Minden kezelési rendszert négy különböző betegségnyomásszintnél (0%, nyom, 5% és 10% lombfoltosság) indítottak el. Az első kezelésekre július 2-án került sor, és az utolsó kezelésre szeptember 21-én került sor. A permetezési blokkok minden egyes középső sorának tíz lábát az első alkalmazás előtt megjelöltük, és ezeket használtuk a heti betegségértékelésekhez (lásd az alábbi grafikonokat). A terméshozamokat ugyanezen tíz lábnyi sorszakaszból vettük le, a sárgarépa kézi betakarításával, valamint a sárgarépa felszedésével és mérlegelésével.
Ez azt jelzi, hogy a sárgarépa első kezelését azonnal el kell végezni, amint a betegség első előfordulását észleljük a szántóföldön. Mostantól kezdve jól működött a TomCast modell használata az utolsó permetezés óta felhalmozódott 20 DSV küszöbértékkel.
A szántóföldi klíma két különböző modellben határozza meg az Alternaria-fertőzés súlyosságát:
Forrás: Jim Jasinski, TOMCAST koordinátor OHIO, INDIANA és MICHIGAN tartományban
TomCast Alternaria modell
A levélnedvesség órák és a levegő hőmérséklete éghajlati feltételeinek függvényében határozzák meg a fertőzés súlyosságának értékeit (0-tól 4-ig, lásd a fenti táblázatot).
Ajánlott felszerelés
Ellenőrizze, hogy melyik érzékelőkészletre van szükség a növény potenciális betegségeinek megfigyeléséhez.