Blé modèles de maladies
Blé (Triticum spp.) est la deuxième culture en série la plus importante. Le blé est cultivé dans une très large gamme de climats, allant de la production hivernale subtropicale au climat frais écossais de 11 mois avec son énorme productivité. Comme toutes les maladies des plantes, certaines ont des aspects plus historiques et d'autres sont principalement liées au climat.
Les maladies d'origine climatique sont les suivantes Le site les maladies de la rouillequi sont plus importantes dans les zones climatiques plus chaudes, sont principalement des maladies liées au climat. Fusariose de l'épi et sa capacité à former des toxines est influencée par l'histoire du champ et par la situation climatique ; elle ne se produira pas si le climat n'est pas favorable à une infection pendant la floraison. En outre, le Septoria tritici dépend des pluies diluviennes et de l'humidité durable des feuilles pour infecter la canopée et, plus loin, le maïs.
Maladies avec aspects historiques : Oïdium Blumeria graminisqui se produit dans une large gamme de climats, est principalement influencée par l'histoire d'un champ. Pseudocercosporella herpotrichoides (Maladie du point de vue de l'œil), Gaeumannomyces graminis (Take- all, Schwarzbeinigkeit) et Rhizoctonia cerealis (lot jaune) dépendent principalement de l'histoire du site et ne sont pas très influencées par le climat.
La maladie Pyricularia grisea est décrite en détail dans Rice Diseases et est appelée ici Magnaporthe grisea.
Rouille brune
L'agent pathogène Puccinia triticina Le champignon a besoin des mêmes conditions environnementales que la feuille de blé. Le champignon est capable d'infecter le tissu végétal dans des périodes de rosée de trois heures ou moins à des températures d'environ 20°C ; cependant, les infections sont plus nombreuses lorsque les périodes de rosée sont plus longues. A des températures plus fraîches, des périodes de rosée plus longues sont nécessaires, par exemple, à 10°C, une période de rosée de 12 heures est nécessaire. Peu ou pas d'infections se produisent lorsque la période de rosée est supérieure à 32°C (Stubbs et al., 1986) ou inférieure à 2°C.
La plupart des épidémies graves se produisent lorsque les urédines et/ou les infections latentes survivent à l'hiver à un certain seuil sur la culture de blé, ou lorsque le blé semé au printemps reçoit un inoculum exogène à une date précoce, généralement avant l'épiaison. Des épidémies graves et des pertes peuvent se produire lorsque la feuille étendard est infectée avant l'anthèse (Chester, 1946). Puccinia triticina est principalement un pathogène du blé, de ses ancêtres immédiats et de la culture artificielle du triticale.
Hôtes alternatifs
Le champignon produit ses gamètes sexuels (pycniospores et hyphes réceptives) sur l'hôte alternatif. La plupart des chercheurs sur la rouille supposent que Thalictrum speciosissimum (de la famille des Ranunculaceae) est le principal hôte alternatif du P. recondita f. sp. tritici en Europe. L'hôte alternatif est infecté lorsque les téleutospores germent en présence d'humidité libre. Des basidiospores (1n) sont produites et peuvent être transportées sur une courte distance (quelques mètres) pour infecter les hôtes alternatifs. Environ sept à dix jours après l'infection, des pycnies contenant des pycniospores et des hyphes réceptives apparaissent. Celles-ci servent de gamètes et la fécondation se produit lorsque le nectar contenant les pycniospores est transporté par des insectes, par des éclaboussures de pluie ou par cohésion jusqu'aux hyphes réceptifs de l'autre type d'accouplement. Les cupules écidiennes apparaissent sept à dix jours plus tard sur la face inférieure de la feuille, produisant des écidiospores qui sont transportées par le vent et qui provoquent l'infection en pénétrant dans les stomates des feuilles de blé. Les distances parcourues par les écidiospores semblent relativement courtes.
Cycle de vie (rouille brune)
La figure ci-contre illustre le cycle de vie d'un P. triticina et P. triticiduri et le cycle de la maladie de la rouille des feuilles du blé. La durée de chaque événement et la fréquence de certains événements (cycle sexuel, saison de culture du blé et pont vert) peuvent varier d'une zone à l'autre et d'une région à l'autre du monde.
L'hôte alternatif fournit actuellement peu d'inoculum direct de P. triticina au blé, mais peut être un mécanisme d'échanges génétiques entre races et peut-être entre populations. Dans de nombreuses régions, le pathogène survit à la période entre les cultures de blé sur un pont vert de blé spontané (semé par soi-même) (voir la section "Epidémiologie"). L'inoculum sous forme d'urédiniospores peut être transporté par le vent d'une région à l'autre. Le cycle sexuel est essentiel pour P. triticiduri. Les téliospores peuvent germer peu après leur développement et l'infection par les basidiospores peut se produire tout au long du cycle de croissance du blé.
Les urédiniospores commencent à germer 30 minutes après avoir été en contact avec de l'eau libre à des températures comprises entre 15 et 25°C. Le tube germinatif se développe le long de la surface de la feuille jusqu'à ce qu'il atteigne un stomate ; un appressorium se forme alors, suivi immédiatement par le développement d'une cheville de pénétration et d'une vésicule sous-stomatique à partir de laquelle se développent les hyphes primaires. Une cellule mère haustoriale se développe contre la cellule mésophylle et une pénétration directe se produit. L'haustorium se forme à l'intérieur de la cellule hôte vivante dans le cadre d'une interaction hôte-pathogène compatible. Des hyphes secondaires se développent et donnent naissance à d'autres cellules mères haustoriales et à d'autres haustoria. Dans le cas d'une réaction hôte-pathogène incompatible, les haustoria ne se développent pas ou se développent plus lentement. Lorsque la cellule hôte meurt, l'haustorium du champignon meurt également. Selon le moment ou le nombre de cellules impliquées, l'interaction hôte-pathogène se traduira par une réponse de résistance visible (Rowell, 1981, 1982).
La germination des spores jusqu'à la sporulation peut se produire dans une période de sept à dix jours à des températures optimales et constantes. En cas de températures basses (10° à 15°C) ou de fluctuations diurnes, des périodes plus longues sont nécessaires. Le champignon peut survivre sous forme de mycéliums insipides pendant un mois ou plus lorsque les températures sont proches ou inférieures au point de congélation. La sporulation maximale est atteinte environ quatre jours après la sporulation initiale (à environ 20°C). Bien que le nombre puisse varier considérablement, environ 3 000 spores sont produites par urédinium et par jour. Ce niveau de production peut se poursuivre pendant trois semaines ou plus si la feuille de blé reste vivante aussi longtemps (Chester, 1946 ; Stubbs et al., 1986). Les urédinies (pustules) sont rouges, de forme ovale et dispersées, et elles percent l'épiderme (Planche 12). Les urédiniospores sont orange à rouge foncé, échinulées, sphériques et mesurent généralement 20 à 28 µm de diamètre (figure 13). Les téleutospores (planche 14) sont brun foncé, bicellulaires avec des parois épaisses et arrondies ou aplaties à l'apex (planche 15). Puccinia triticiduri diffère de P. triticina en ce qu'il faut 10 à 12 jours pour que les urédospores apparaissent, et la production initiale de téleutospores a souvent lieu dans les 14 jours suivant l'infection initiale. Les urédines sont brun-jaune et produisent beaucoup moins d'urédiniospores par urédine, et en quelques jours la lésion produit principalement des téleutospores. La lésion produit principalement des téleutospores quelques jours plus tard. P. triticiduri Les infections sont susceptibles de se trouver sur la surface inférieure des feuilles.
Les téliospores de P. triticina se forment sous l'épiderme en cas de conditions défavorables ou de sénescence et restent avec les feuilles. Les tissus foliaires peuvent être dispersés ou déplacés par le vent, les animaux ou les humains sur des distances considérables. Les basidiospores sont formées et libérées dans des conditions humides, ce qui limite leur propagation. Les basidiospores sont également hyalines et sensibles à la lumière, ce qui limite encore leur déplacement à quelques dizaines de mètres. Les écidiospores sont plus semblables aux urédiniospores dans leur capacité à être transportées par les courants de vent, mais le transport sur de longues distances n'a pas été observé pour une raison quelconque. Puccinia triticiduri produira d'abondantes téleutospores dans les semaines qui suivent l'infection initiale, produisant un anneau sombre de téleutospores autour de chaque site d'infection.
Source : Les rouilles du blé : R.P. Singh, J. Huerta-Espino, A.P. Roelfs
Modèle d'infection par Puccinia tritici
Puccinia tritici Les infections ont lieu après :
- Quelques heures d'humidité des feuilles dans des conditions de température optimales. Le champignon peut s'infecter dans une large gamme de températures.
- Le modèle suppose que l'infection nécessite une température horaire cumulée de 90°C d'humidité foliaire dans une plage de température de l'air allant de 5°C à 30°C.
Humidité des feuilles pour des températures horaires moyennes cumulées de 90°C
- (si T <= 22,5°C alors ∑(Th) sinon ∑ (22,5-(Th-22,5))
- 5°C < Temp. < 30°C
Dans FieldClimate, le Puccinia tritici est représentée par la ligne jaune (voir ci-dessus). Les conditions sont similaires à P. graminismais avec un seuil de température inférieur de 5°C. En cas d'infection à 100%, une mesure phytosanitaire curative doit être prise en compte (application systémique). Si le risque est de 80% et que les prévisions météorologiques annoncent davantage de périodes d'humidité foliaire, des applications foliaires de protection peuvent être effectuées.
Rouille noire
La rouille des tiges ou rouille noire du blé est causée par P. graminis f. sp. tritici. Il fut un temps où cette maladie était redoutée dans la plupart des régions productrices de blé du monde. La crainte de la rouille des tiges était compréhensible car une culture apparemment saine trois semaines avant la récolte pouvait être réduite à un enchevêtrement noir de tiges cassées et de grains ratatinés avant la récolte. En Europe et en Amérique du Nord, l'élimination de l'hôte alternatif a réduit le nombre de combinaisons de virulence et la quantité d'inoculum produit localement (écidiospores). En outre, dans certaines régions, des cultivars à maturation précoce ont été introduits pour permettre une deuxième récolte ou pour éviter la floraison et le remplissage des grains par temps chaud. Les cultivars à maturation précoce échappent à la plupart des dégâts causés par la rouille des tiges en évitant la période de croissance du champignon. L'utilisation généralisée de cultivars résistants dans le monde entier a réduit l'importance de la maladie en tant que facteur de production. Bien que l'évolution de la virulence du pathogène ait rendu certaines résistances inefficaces, les cultivars résistants ont généralement été développés avant le pathogène. Les épidémies spectaculaires qui se sont développées sur Eureka (Sr6 en Australie) dans les années 1940 et sur Lee (Sr9g, Sr11, Sr16), Langdon (Sr9e, +) et Yuma (Sr9e, +) aux États-Unis au milieu des années 1950 ont vraiment été des exceptions dans le passé. L'expérience dans d'autres parties du monde a été similaire (Luig et Watson, 1972 ; Roelfs, 1986 ; Saari et Prescott, 1985). Aujourd'hui, la rouille des tiges est largement maîtrisée dans le monde entier.
Épidémiologie
L'épidémiologie de la P. graminis est similaire à P. triticina. Les températures minimales, optimales et maximales pour la germination des spores sont respectivement de 2°, 15° à 24° et 30°C (Hogg et al., 1969) et pour la sporulation, respectivement de 5°, 30° et 40°C, soit environ 5,5°C de plus dans chaque catégorie que pour la sporulation. P. triticina. La rouille des tiges est plus importante à la fin de la période de croissance, sur les cultivars de blé semés et mûris tardivement, et à des altitudes plus basses. Le blé semé au printemps est particulièrement vulnérable aux latitudes élevées si les sources d'inoculum sont situées sous le vent. Dans le sud des Grandes Plaines d'Amérique du Nord, on trouve de vastes zones de blé semé à l'automne, qui fournissent un inoculum aux cultures de blé semées au printemps dans le nord. Dans les climats chauds et humides, la rouille des tiges peut être particulièrement grave en raison de la longue période de conditions favorables au développement de la maladie lorsqu'une source locale d'inoculum est disponible.
La rouille des tiges diffère de la rouille des feuilles en ce qu'elle nécessite une période de rosée plus longue (six à huit heures sont nécessaires). En outre, de nombreux points de pénétration ne se développent pas à partir de l'appressorium à moins d'être stimulés par au moins 10 000 lux de lumière pendant une période de trois heures alors que la plante sèche lentement après la période de rosée. L'infection maximale est obtenue avec 8 à 12 heures de rosée à 18°C suivies de 10 000+ lux de lumière pendant que la rosée sèche lentement et que la température monte à 30°C (Rowell, 1984). La lumière est rarement limitante au champ car les rosées se produisent souvent le matin. Cependant, il y a peu d'infection lorsque les rosées et/ou les pluies du soir sont suivies par des vents qui provoquent un assèchement avant le lever du soleil. En serre, la réduction de la lumière est souvent à l'origine des faibles taux d'infection. L'effet de la lumière est probablement un effet sur la plante plutôt que sur le système fongique car les urédiniospores injectées à l'intérieur du verticille de la feuille réussissent à pénétrer dans le champignon sans que la lumière ne l'atteigne. Les urédinies de la rouille des tiges sont présentes à la fois sur les surfaces des feuilles et des tiges, ainsi que sur les gaines des feuilles, les épis, les glumes, les barbes et même les grains.
Une pustule de rouille des tiges (urédinium) peut produire 10 000 urédiniospores par jour (Katsuya et Green, 1967 ; Mont, 1970). C'est plus que la rouille des feuilles, mais l'infectiosité est plus faible, avec seulement un germe sur dix qui réussit à infecter. Les urédines de la rouille des tiges, qui se trouvent principalement sur les tissus de la tige et de la gaine foliaire, survivent souvent plus longtemps que celles de la rouille des feuilles, qui sont plus souvent confinées au limbe des feuilles. Le taux de progression des deux maladies est très similaire.
Les urédiniospores de la rouille des tiges sont assez résistantes aux conditions atmosphériques si leur teneur en eau est modérée (20 à 30 pour cent). Le transport sur de longues distances se produit chaque année (800 km) à travers les grandes plaines d'Amérique du Nord (Roelfs, 1985a), presque chaque année (2000 km) de l'Australie à la Nouvelle-Zélande (Luig, 1985) et au moins trois fois au cours des 75 dernières années (8000 km) de l'Afrique de l'Est à l'Australie (Watson et de Sousa, 1983).
Les écidiospores peuvent également être une source d'inoculum pour la rouille de la tige du blé. Historiquement, cette source était importante en Amérique du Nord et en Europe du Nord et de l'Est. Cette source d'inoculum a généralement été éliminée ou fortement réduite par l'élimination de l'épine-vinette commune ou européenne (Berberis vulgaris) en raison de la proximité de champs de blé. Les écidiospores infectent le blé de la même manière que les urédiniospores.
Hôtes
Le blé, l'orge, le triticale et quelques espèces apparentées sont les principaux hôtes de la maladie. P. graminis f. sp. tritici. Cependant, le pathogène étroitement apparenté, P. graminis f. sp. secalisest virulent sur la plupart des orges et certains blés (par exemple la lignée E). Puccinia graminis f. sp. secalis peut attaquer Sr6 et Sr11 dans un contexte d'hôte de la ligne E (Luig, 1985). Le principal hôte alternatif dans la nature a été B. vulgaris L.une espèce originaire d'Europe, bien que d'autres espèces aient été sensibles lors de tests en serre. Les hôtes alternatifs sont généralement sensibles à l'ensemble ou à aucune des formae speciales de la P. graminis.
Hôtes alternatifs
Le principal hôte alternatif de P. graminis est B. vulgarisCette plante a été répandue par l'homme sous les latitudes septentrionales de l'hémisphère nord. En raison de sa croissance érigée et buissonnante, avec de nombreuses épines acérées, il constituait une excellente haie le long des bordures de champs. Le bois était utile pour fabriquer des manches d'outils, l'écorce fournissait une teinture et les fruits étaient utilisés pour faire des confitures. Les colons venus d'Europe en Amérique du Nord ont apporté l'épine-vinette avec eux. L'épine-vinette s'est répandue vers l'ouest avec l'homme et s'est établie comme plante naturalisée de la Pennsylvanie à l'est des Dakotas et au sud dans le nord-est du Kansas. De nombreuses espèces de Berberis, Mahonia et Mahoberberis sont sensibles à l'anthracnose. P. graminis (Roelfs, 1985b). L'épine-vinette du Canada ou d'Allegheny, B. canadensisdevrait être ajouté à cette liste.
L'hôte alternatif était une source majeure de nouvelles combinaisons de gènes pour la virulence et l'agressivité du pathogène (Groth et Roelfs, 1982). La quantité de variations dans le pathogène rendait difficile, voire impossible, la sélection de la résistance. Parmi les combinaisons de virulence présentes une année, beaucoup ne se reproduiraient pas l'année suivante, mais beaucoup de nouvelles apparaîtraient (Roelfs, 1982). L'épine-vinette était la source d'inoculum (écidiospores) au début de la saison. En général, les buissons infectés se trouvaient à proximité des champs de céréales de la saison précédente, de sorte que l'inoculum parcourait de courtes distances sans la perte de nombre et de viabilité associée au transport sur de longues distances. Un seul grand buisson d'épine-vinette peut produire environ 64 x 109 écidiospores en quelques semaines (Stakman, 1923). Cela équivaut à la production quotidienne de 20 millions d'urédospores sur une surface de 400 m2.
L'épine-vinette était une source majeure d'inoculum de rouille des tiges au Danemark (Hermansen, 1968) et en Amérique du Nord (Roelfs, 1982). Le succès de la réduction des épidémies de rouille des tiges en Europe du Nord et en Amérique du Nord suite à l'élimination de l'épine-vinette près des champs de blé a probablement conduit à une surestimation du rôle de cet hôte alternatif dans la génération d'épidémies annuelles ailleurs.
Résistance à la P. graminis en Berbéris résulterait de l'incapacité du pathogène à pénétrer directement la cuticule coriace (Melander et Craigie, 1927). Berberis vulgaris devient résistant à l'infection environ 14 jours après le déploiement des feuilles. Cependant, les infections se produisent sur les baies, les épines et les tiges, ce qui suggère que le durcissement de la cuticule n'est peut-être pas aussi important qu'on le pensait à l'origine. Lors de tests récents sur des cultivars hôtes alternatifs, une réaction d'hypersensibilité a été observée, en particulier avec le Berberis spp. (Mahonia).
Cycle de vie
Dans la plupart des régions du monde, le cycle de vie des P. graminis f. sp. tritici consiste en une succession de générations d'urédospores. Le champignon se propage par des urédiniospores en suspension dans l'air d'une plante de blé à l'autre et d'un champ à l'autre. L'inoculum primaire peut provenir localement (endémique) de plantes spontanées ou être transporté sur de longues distances (exodémique) par le vent et déposé par la pluie. En Amérique du Nord, P. graminis se déplace chaque année sur 2 000 km, des blés d'hiver méridionaux aux blés de printemps les plus septentrionaux, en 90 jours ou moins et, au cours du cycle urédinal, peut survivre à l'hiver au niveau de la mer jusqu'à au moins 35° N. La neige peut fournir une couverture qui permet occasionnellement à P. graminis de se développer dans les champs. La neige peut fournir une couverture qui permet occasionnellement à P. graminis de survivre à l'hiver. P. graminis survivre en tant qu'infection sur blé d'hiver même à des températures négatives sévères rencontrées à 45°N (Roelfs et Long, 1987). Le cycle sexuel se produit rarement sauf dans le nord-ouest du Pacifique des Etats-Unis (Roelfs et Groth, 1980) et dans des zones locales d'Europe (Spehar, 1975 ; Zadoks et Bouwman, 1985). Bien que le cycle sexuel produise une grande diversité génétique (Roelfs et Groth, 1980), il produit aussi un grand nombre d'individus qui sont moins aptes en raison de la présence fréquente de gènes de virulence récessifs (Roelfs et Groth, 1988) et du réassortiment des gènes d'agressivité. Puccinia graminis a développé avec succès une stratégie de reproduction asexuée qui permet apparemment au champignon de conserver les gènes nécessaires dans des blocs qui sont occasionnellement modifiés par la mutation et la sélection.
La germination des urédiniospores commence en une à trois heures à des températures optimales (tableau 13.2) en présence d'eau libre. La période d'humidité ou de rosée doit durer de six à huit heures à des températures favorables pour que les spores germent et produisent un tube germinatif et un appressorium. Le développement visible s'arrête au stade de l'appressorium jusqu'à ce qu'au moins 10 000 lux (16 000 étant l'optimum) de lumière soient fournis. La lumière stimule la formation d'une tige de pénétration qui pénètre dans une stomie fermée. Si le germe se dessèche pendant la période de germination, le processus est irréversiblement interrompu. Le processus de pénétration dure environ trois heures lorsque la température passe de 18° à 30°C (Rowell, 1984). La lumière nécessaire à l'infection rend P. graminis beaucoup plus difficile à travailler en serre que P. recondita. Très probablement, la lumière a rarement un effet au champ, sauf lorsque les périodes de rosée se dissipent avant le lever du jour.
Les urédiniospores se développent dans des pustules (urédinia) qui rompent l'épiderme et exposent des masses de spores brun rougeâtre. Les urédinies sont plus grandes que celles de la rouille des feuilles et sont de forme ovale ou allongée, avec un tissu épidermique lâche ou déchiré le long des marges (planche 16). Les urédiniospores sont des structures échinulées brun rougeâtre, elliptiques à ovoïdes, mesurant 24 à 32 µm x 18 à 22 µm (Figure 17).
Lorsque l'hôte devient mature, des téleutospores (planche 18) sont produites directement à partir d'infections d'urédiniospores ou des téleutospores peuvent être produites dans une pustule urédinale mature. Les téleutospores sont bicellulaires brun foncé et ont une forme quelque peu cunéiforme. Elles ont des parois épaisses et mesurent 40 à 60 µm x 18 à 26 µm. La cellule apicale est arrondie ou légèrement pointue (planche 19). Les téleutospores sont dicaryotiques (n + n) et restent avec la paille jusqu'au printemps. Pendant cette période, la caryogamie se produit et les téliospores deviennent diploïdes (2n). Avec les pluies de printemps et des températures favorables, la téliospore germe, subit la méiose et produit une baside à quatre cellules. Chaque cellule produit un stigmate avec une seule basidiospore haploïde (1n). La basidiospore hyaline est transportée par le vent sur de courtes distances (mètres) jusqu'au buisson d'épine-vinette. Les basidiospores germent et pénètrent directement. Pour une infection maximale, le tissu foliaire de l'épine-vinette doit être âgé de moins de deux semaines. L'infection par une basidiospore entraîne la production d'un pycnium (1n). Le pycnium produit des hyphes réceptifs et des pycniospores d'un seul type d'accouplement (+ ou -) qui servent de gamètes femelles et mâles pour le champignon. Les pycniospores d'un type de reproduction doivent être transférées sur les hyphes réceptifs du type de reproduction opposé pour initier le développement de l'écidiospore. Le transfert des pycniospores est souvent effectué par des insectes, qui sont attirés par le nectar pycnique suintant produit par le pycnium. L'accouplement des types + et - peut également être facilité par les éclaboussures de pluie, le frôlement des feuilles, les animaux plus grands et les infections voisines qui coalescent. Les écidiospores sont dicaryotiques (n + n) et sont produites dans des écidies généralement situées sur la surface inférieure des feuilles d'épine-vinette sept à dix jours après la fécondation. Les écidiospores sont le produit d'une recombinaison génétique et peuvent différer par leur virulence et leur agressivité. L'ampleur des variations dépend des différences entre les isolats parentaux. Puccinia graminis f. sp. tritici a été croisé avec d'autres formae speciales, et les croisements avec P. graminis f. sp. secalis ont été relativement fertiles (Johnson, 1949). En Australie, des preuves indiquent une recombinaison de la rouille de la tige du blé et de la rouille du scabrum (P. graminis f. sp. secalis) (Burdon et al., 1981 ; Luig et Watson, 1972).
Les écidiospores sont libérées de manière hydroscopique par les écidiospores et sont transportées par l'air jusqu'au blé sur des distances allant de quelques mètres à quelques kilomètres. Les écidiospores nécessitent des conditions d'infection similaires à celles des urédiniospores. L'infection par les écidiospores entraîne la production d'urédinia dicaryotiques (n + n) avec des urédiniospores. Le cycle asexué répétitif implique alors que les urédiniospores produisent des urédinies dans un cycle d'environ 14 jours dans des conditions optimales. Dans les conditions de terrain, où les températures varient fortement, le cycle peut être allongé ou raccourci. En général, les températures plus basses dans les champs, au moins au début du cycle de culture, tendent à allonger la période de latence. Dans le nord de l'Inde, une période de latence de 31 jours a été enregistrée pour la rouille des tiges (Joshi et Palmer, 1973).
Source : Les rouilles du blé : R.P. Singh, J. Huerta-Espino, A.P. Roelfs
Modèle d'infection par Puccinia gramnis
Puccinia graminis Les infections ont lieu après :
- Quelques heures d'humidité des feuilles dans des conditions de température optimales. Le champignon peut s'infecter dans une large gamme de températures.
- Le modèle suppose que l'infection a besoin d'une température horaire cumulée de 80°C pour l'humidité des feuilles dans une fourchette de température de l'air allant de 10°C à 35°C. Elle préfère des températures un peu plus élevées que P. tritici et l'infection doit être suivie d'une exposition au soleil.
Humidité des feuilles pour des températures horaires moyennes cumulées de 80°C, suivie d'une période de lumière (150 W/m²) pour des températures horaires moyennes cumulées de 30°C.
- (si T <= 24°C alors ∑(Th) sinon ∑ Th-24
- 10°C < Temp. < 35°C
En FieldClimate P. graminis est calculée sur la base des conditions décrites ci-dessus (ligne verte). Lorsque l'infection 100% est montrée, les conditions ont été favorables au champignon et une mesure de protection des plantes (curative) doit être prise en compte.
Rouille jaune
Rouille jaune du blé causée par P. striiformis f. sp. tritici peut être aussi dommageable que la rouille des tiges. Cependant, la température optimale de développement de la rouille rayée est plus basse, ce qui limite son importance en tant que maladie majeure dans de nombreuses régions du monde. La rouille rayée est principalement une maladie importante du blé pendant l'hiver ou au début du printemps ou à haute altitude.
La rouille de la raie du blé peut être la cause de la rouille de la raie de l'orge (Stubbs, 1985). En Europe, une forma specialis de P. striiformis s'est développée, que l'on trouve couramment sur l'orge et rarement sur les blés les plus sensibles (Zadoks, 1961). Puccinia striiformis f. sp. hordei a été introduit en Amérique du Sud où il s'est disséminé sur tout le continent (Dubin et Stubbs, 1986) et a ensuite été identifié au Mexique et aux Etats-Unis (Roelfs et al., 1992).
Épidémiologie
Puccinia striiformis a les exigences de température les plus faibles des trois pathogènes de la rouille du blé. Les températures minimales, optimales et maximales pour l'infection par la rouille jaune sont respectivement de 0°, 11° et 23°C (Hogg et al., 1969). Puccinia striiformis peut fréquemment hiverner activement sur du blé semé à l'automne. La plupart des travaux épidémiologiques ont été réalisés en Europe et ont été récemment analysés par Zadoks et Bouwman (1985) et Rapilly (1979).
En Europe, P. striiformis la rouille de sur-été sur le blé (Zadoks, 1961). La quantité de rouille surnuméraire dépend de la quantité de blé spontané qui, à son tour, est fonction de l'humidité de l'arrière-saison. Les minispores urinaires sont ensuite soufflées sur le blé semé à l'automne. Dans le nord-ouest de l'Europe, l'hivernage est limité aux urédinomycéliums présents dans les tissus foliaires vivants, car des températures de -4°C tuent les lésions sporulantes exposées. Les lésions latentes peuvent survivre si la feuille survit. Dans d'autres régions du monde, la neige peut isoler les lésions sporulantes des températures froides, de sorte que les températures de l'air inférieures à -4°C n'éliminent pas les lésions de rouille. La période de latence de la rouille des stries pendant l'hiver peut atteindre 118 jours et on pense qu'elle peut aller jusqu'à 150 jours sous une couverture neigeuse (Zadoks, 1961).
Dans les régions proches de l'équateur, la rouille rayée a tendance à suivre un cycle endémique des basses aux hautes altitudes et à revenir en suivant la phénologie des cultures (Saari et Prescott, 1985). Dans les latitudes plus septentrionales, le cycle s'allonge, la maladie se déplaçant des zones montagneuses vers les piémonts et les plaines.
En raison de leur sensibilité à la lumière ultraviolette, les urédiniospores de la rouille jaune ne sont probablement pas transportées à l'état viable aussi loin que celles des rouilles des feuilles et des tiges. Maddison et Manners (1972) ont trouvé que les urédiniospores de la rouille de la raie sont trois fois plus sensibles à la lumière ultraviolette que celles de la rouille de la tige. Cependant, Zadoks (1961) signale que la rouille striée a été transportée par le vent à l'état viable sur plus de 800 km. Les introductions de la striure du blé en Australie et en Afrique du Sud et de la striure de l'orge en Colombie ont probablement été facilitées par l'homme grâce au transport par avion (Dubin et Stubbs, 1986 ; O'Brien ? et al., 1980). Cependant, la dissémination de la rouille jaune de l'Australie à la Nouvelle-Zélande, sur une distance de 2 000 km, s'est probablement faite par l'intermédiaire d'urédiniospores en suspension dans l'air (Beresford, 1982). Il est possible qu'une spore moyenne de la stripe rust ait moins de chances d'être transportée dans l'air à l'état viable sur de longues distances que celle des autres rouilles du blé, mais il est certain que certaines spores doivent être capables de survivre à un transport sur de longues distances dans des conditions particulières et favorables. Il existe plusieurs exemples de migration séquentielle de la rouille jaune. La virulence du gène Yr2 (cultivars Siete Cerros, Kalyansona et Mexipak) a été enregistrée pour la première fois en Turquie et, au fil du temps, a été localisée dans le sous-continent indien et pakistanais (Saari et Prescott, 1985) et pourrait être associée aux systèmes météorologiques appelés "Western Disturbance" (perturbation occidentale). Comme cela a été mentionné, la rouille jaune de l'orge en Amérique du Sud a migré de son point d'introduction en Colombie vers le Chili sur une période de quelques années (Dubin et Stubbs, 1986).
La plupart des régions du monde étudiées semblent avoir une source locale ou proche d'inoculum provenant de blé spontané (Line, 1976 ; Stubbs, 1985 ; Zadoks et Bouwman, 1985). Cependant, certains éléments indiquent que l'inoculum provient de graminées non céréalières (Hendrix et al., 1965 ; Tollenaar et Houston, 1967). Les études futures sur l'épidémiologie de la rouille jaune doivent prendre en compte non seulement la présence de la rouille sur les graminées voisines, mais aussi le fait que la rouille doit apparaître sur les graminées avant d'apparaître sur les céréales. Il faut démontrer que le phénotype de virulence est le même sur les deux hôtes et qu'il passe de la graminée au blé pendant la saison de culture.
Aux Pays-Bas, des épidémies de rouille des stries peuvent être générées par un seul urédinium par hectare qui survit à l'hiver si le printemps est favorable au développement de la rouille (Zadoks et Bouwman, 1985). La détection visuelle d'un seul urédonium par hectare est peu probable, cependant, au fur et à mesure que des foyers se développent autour de l'urédonium initial, il devient progressivement plus facile de le détecter.
Hôtes
Puccinia striiformis est un agent pathogène des graminées et des cultures céréalières : blé, orge, triticale et seigle. La rouille des stries est la seule rouille du blé qui se propage systématiquement au-delà du point d'infection initial dans la plante.
Hôtes alternatifs
On ne connaît que les stades téleutosporien et urédosporien de la rouille jaune. Eriksson et Henning (1894) ont cherché l'hôte alternatif parmi les espèces de Boraginaceae. Tranzschel (1934) a suggéré que Aecidium valerianellaLa rouille de la valériane, pourrait être liée à P. striiformis. Mains (1933) pensait que P. koeleriae Arth., P. arrhenatheri Eriks. et P. montanensis Ellisqui ont des états aecidiens sur Berberis et Mahonia spp. pourraient être liés aux P. striiformis.
Straib (1937) et Hart et Becker (1939) ont tenté sans succès d'infecter les Berbéris, Mahonia et Valerianella spp. L'hôte alternatif de la rouille, P. agropyri Ell. et Ev. Clematis vitalba. Cette rouille ressemble beaucoup à la P. striiformis Ainsi Viennot-Bourgin (1934) a suggéré que l'hôte alternatif de la stripe rust pourrait se trouver dans la famille des Clematis. Les téleutospores germent immédiatement pour produire des basidiospores (Wright et Lennard, 1980), et les téleutospores n'aident probablement pas le champignon à survivre à l'hiver. Un facteur épidémiologique à prendre en compte est la possibilité d'infection de l'hôte alternatif à la fin de l'été, de sorte que les écidiospores pourraient infecter le blé nouvellement semé ou les graminées de la fin de la saison fraîche. Dans certaines régions de haute altitude de l'Asie occidentale, la culture du blé peut prendre 13 mois pour arriver à maturité. Dans ces cas, des infections de l'hôte alternatif au début du printemps seraient possibles.
Cycle de vie
Puccinia striiformis est très probablement une rouille hémiforme dans la mesure où le cycle de vie semble ne comporter que les stades urédien et téleutosporien. Les urédies se développent en bandes étroites, jaunes et linéaires, principalement sur les feuilles et les épillets (planche 20). Lorsque les épis sont infectés, les pustules apparaissent sur les surfaces internes des glumes et des lemmes (figure 21). Les urédiniospores sont de couleur jaune à orange, plus ou moins sphériques, échinulées et de 28 à 34 µm de diamètre (Figure 22). D'étroites bandes noires se forment sur les feuilles pendant le développement téleutosporique. Les téleutospores sont brun foncé, bicellulaires et similaires en taille et en forme à celles de la P. triticina (planche 23). Les populations de rouille striée peuvent exister, changer de virulence et donner lieu à des épidémies indépendamment d'un hôte alternatif. Les urédiniospores sont la seule source connue d'inoculum pour le blé, et elles germent et infectent à des températures plus fraîches.
Source : Les rouilles du blé : R.P. Singh, J. Huerta-Espino, A.P. Roelfs
Puccinia striiformis Modèle d'infection
Puccinia striiformis est la rouille du blé des climats frais dont la température optimale se situe déjà à partir de 15°C. Ses infections ont lieu après quelques heures d'humidité des feuilles dans des conditions de température optimales. Le champignon peut s'infecter dans une large gamme de températures. Le modèle suppose que l'infection nécessite une température horaire cumulée de 80°C d'humidité foliaire dans une plage de température de l'air de 5°C à 20°C. Il n'y a pas d'infection pendant les périodes de faible intensité lumineuse.
Humidité des feuilles et lumière pour les températures moyennes horaires cumulées pour 80°C
- (si T )
- 5°C < Temp. < 20°C
Dans FieldClimate, une infection par P. striiformis est montré le 23 août après une longue période d'humidité des feuilles à des températures avoisinant les 15°C (ligne rouge). Après cette infection, des stratégies curatives de protection des plantes doivent être prises en compte (systémique), tandis qu'avant que l'infection n'atteigne 100%, une application de protection peut être effectuée.
Fusariose de l'épi
La fusariose des épis ou la gale des petits grains est causée par le champignon Fusarium graminearum (Schwabe), bien que les Pays-Bas et d'autres régions d'Europe centrale fassent état d'une baisse de la consommation d'eau. F. culmorum comme l'espèce la plus répandue (Snidjers, 1989). En Pologne, F. culmorum, F. graminearum et F. nivale ont montré des niveaux de virulence modérés à sévères similaires, tandis que les F. avenaceum s'est avéré moyennement ou modérément virulent. Cependant, dans plusieurs études visant à identifier l'organisme responsable, jusqu'à 18 Fusarium spp. ont été isolés et identifiés (Mihuta-Grimm et Foster, 1989 ; Reis, 1985).
Article de L. GilchristH.J. Dubin La tavelure est présente dans les régions chaudes et humides où la floraison coïncide avec les périodes de pluie. L'incidence de cette maladie a augmenté au cours des dix dernières années pour diverses raisons. La raison la plus importante est peut-être l'augmentation de la superficie où le blé est cultivé en rotation avec du maïs ou d'autres céréales. D'autres raisons sont les changements dans le système de culture à des fins de protection du sol et les changements dans la culture du blé, qui passe des zones traditionnelles à des zones plus humides et non traditionnelles (Gilchrist et al., 1997).
La gale fusarienne entraîne de graves pertes de production dans le monde entier, qui peuvent atteindre 50 pour cent. De même, au Paraguay, les conditions climatiques de 1972 et 1975 ont favorisé les épidémies de Fusarium et de Septoria qui, ensemble, ont causé des pertes allant jusqu'à 70 pour cent (Viedma, 1989). La Pologne, les Pays-Bas, le Royaume-Uni, l'ex-Tchécoslovaquie, la Fédération de Russie, la France et l'Autriche sont quelques-uns des pays européens qui signalent des cas de tavelure. Des régions du Canada, des Etats-Unis, du Mexique, du Guatemala, du Brésil, de l'Equateur, de l'Uruguay et de l'Argentine dans les Amériques sont fortement touchées par Fusarium (Ireta et Gilchrist, 1994).
La tavelure peut causer des dommages importants au niveau du rendement et de la qualité, ainsi que des toxicoses chez les animaux et les humains (Ireta et Gilchrist, 1994 ; Baht et al., 1989 ; Luo, 1988 ; Snidjers, 1989 ; Marasas et al., 1988). Les dégâts causés par la tavelure aux Etats-Unis ont été estimés à plus de 1,23 milliard de dollars US en 1993 et à 1,23 milliard de dollars US en 1994. En Chine, on estime que la tavelure peut affecter jusqu'à 7 millions d'hectares et que 2,5 millions de tonnes de céréales peuvent être perdues au cours des années épidémiques. Des maladies liées à la mycotoxine fusarienne ont été signalées chez l'homme en Chine, en Inde et au Japon, tandis que des maladies animales ont été signalées dans de nombreuses régions du monde (Dubin et al., 1997).
Aujourd'hui, il existe des réglementations mondiales pour les mycotoxines (Van Egmond et Dekker, 1995). Cependant, dans de nombreux pays, les réglementations ne sont pas appliquées et de nombreuses personnes, en particulier dans les zones rurales, consomment les céréales sans aucun contrôle, soit sous forme de grains de céréales, soit sous forme indirecte, sous forme de viande provenant d'animaux nourris avec des grains contaminés. Le tableau 16.1 présente les principaux effets sur les porcs et les volailles induits par les toxines les plus importantes produites par certaines céréales. Fusarium espèces.
Les conditions climatiques humides et chaudes entre l'épiaison et la maturité augmentent la gravité de la tavelure. Le point d'entrée de F. graminearum est l'épi, en particulier les organes floraux. Cela affecte la formation des graines et le remplissage des grains. Les épillets infectés perdent rapidement leur chlorophylle et prennent une couleur pâle. Plus tard, ils prennent une couleur rose ou pêche, en particulier à la base et sur les bords des glumes (planche 41). Si les conditions environnementales restent favorables, l'infection progresse vers les épillets adjacents et, dans certains cas, peut infecter l'ensemble de l'épi, y compris le rachis et son pédoncule. Lorsque l'infection est sévère, les grains endommagés sont couverts de mycéliums et prennent l'aspect d'une masse cotonneuse rose. Si la maladie est modérée, le grain peut être ratatiné, de faible poids et de couleur blanchâtre (grains de pierre tombale).
Principaux effets toxiques sur les porcs et les volailles induits par les toxines les plus importantes produites par certaines espèces de Fusarium
| Mycotoxine | Signes cliniques |
| Zéaralénone | Vulve rouge et gonflée ; prolapsus vaginal chez les porcs ; les porcelets allaités peuvent présenter une hypertrophie de la vulve ; problèmes de fertilité. |
| Vomitoxine (désoxynivalénol, DON) | Diminution de la consommation d'aliments et de la prise de poids chez les porcs ayant reçu >2 mg/kg d'aliments ; vomissements ; refus de s'alimenter à des concentrations très élevées de DON (>20 mg/kg d'aliments)a |
| Autres trichothécènes Toxine T-2 Toxine HT-2 Diacétoxyescirpénol > | Plus toxique que le DON ; réduction de la consommation d'aliments ; vomissements ; irritation cutanée et gastro-intestinale ; neurotoxicité ; progéniture anormale ; sensibilité accrue aux maladies ; hémorragies. |
| Ocharatoxine | Affecte principalement les tubules proximaux des reins chez les porcs et les volailles ; les reins sont grossièrement élargis et pâles ; foie gras chez les volailles. |
amg/kg = parties par million (ppm).
Source : Trenholm et al : Trenholm et al, 1984.
Fusarium graminearum (planche 42) peut attaquer les plantes de blé à tous les stades de croissance, provoquant des maladies des semis, des tiges et des racines. Les infections primaires peuvent provenir des ascospores ou des macroconidies déposées sur les glumes et les anthères extrudées. Des températures de 10° à 30°C et une humidité relative supérieure à 95% pendant 40 à 60 heures sont généralement suffisantes pour que les macroconidies infectent avec succès les épis (Ireta, 1989).
Fusarium graminearum est l'un des rares Fusarium qui produit des périthèces en conditions de terrain (Planche 43, Planche 44). Les périthèces représentent le stade sexuel du champignon, Gibberella zeae, et sont produits sur les glumes de blé. Les périthèces jouent un rôle important dans la survie du pathogène d'une année sur l'autre (Khonga et Sutton, 1988) et coexistent avec les mycéliums dans les résidus de la culture précédente pour constituer la source initiale d'inoculum pour la tavelure. Des recherches effectuées en Chine ont montré que la température la plus basse pour la production de périthèces était de 7 à 10°C, et la plus appropriée de 15 à 20°C. Le taux d'humidité du sol le plus bas pour la production de périthèces était de 50 à 60 %, et le plus approprié de 70 à 80 % (Wang, 1997).
Les facteurs qui déterminent le développement de la maladie sont le climat, les niveaux d'inoculum et le stade de croissance du blé. Les épidémies de gale du blé dépendent principalement de la quantité d'inoculum primaire, plutôt que de l'inoculum secondaire. L'invasion se produit principalement pendant la période de floraison. L'infection secondaire par les conidies (planche 45) se produit après l'apparition des épis malades dans le champ.
Les résidus de culture et les pratiques culturales jouent un rôle important dans la préservation de la biodiversité. F. graminearum et, par conséquent, des épidémies. Les infections sur blé semé dans un champ de résidus de maïs peuvent être deux ou trois fois plus graves (Teich et Nelson, 1984). En général, le pathogène n'était saprophyte que sur les chaumes de riz dans les zones de rotation riz-blé et sur les tiges de maïs dans les zones de plantation sèche en Chine (Wang, 1997). Si les résidus sont labourés, la survie des périthèces diminue et réduit la source primaire d'inoculum (Reis, 1989).
Fusarium graminearum est un parasite facultatif et est pathogène sur de nombreuses autres graminées, y compris des adventices communes et des cultures céréalières (seigle, riz, orge et triticale). Si les pratiques telles que la rotation avec des cultures non hôtes ou la gestion des résidus de culture ne sont pas efficaces seules, elles peuvent, en combinaison, réduire la source d'inoculum primaire. La lutte contre la maladie repose effectivement sur une gestion intégrée, comprenant des pratiques agronomiques appropriées, l'utilisation de cultivars résistants ou tolérants et des applications chimiques.
Biologie de la fusariose des épis
Pathogènes occasionnels
La fusariose est causée par des espèces fongiques du genre Fusarium. L'espèce la plus courante est Fusarium graminearum (stade sexuel - Gibberella zeae). Ce champignon est le même que celui qui est fréquemment associé à la pourriture des tiges de maïs. Un autre champignon Fusarium L'espèce responsable de la fusariose est Fusarium culmorum. Les deux F. graminearum et F. culmorum peut également provoquer la pourriture des racines des petites céréales. Sur l'orge, deux autres Fusarium espèces, F. poae et F. avenaceumpeut également provoquer une brûlure des grains.
Survie et propagation
Le champignon persiste et se multiplie sur les résidus de culture infectés de petites céréales et de maïs. Par temps humide, les spores des champignons sont soufflées par le vent ou projetées sur les épis des cultures céréalières. Les spores peuvent provenir de l'intérieur d'une culture ou être soufflées depuis les cultures environnantes, parfois sur de longues distances. Les cultures de blé et de blé dur sont susceptibles d'être infectées depuis la période de floraison (pollinisation) jusqu'au stade de la pâte dure du développement du grain. Les spores du champignon responsable peuvent se déposer sur les anthères exposées au moment de la floraison et se développer ensuite dans les grains, les glumes ou d'autres parties de l'épi. Pour l'orge de printemps, qui fleurit lorsque l'épi est dans la botte, l'infection est plus fréquente après la période de floraison, une fois que l'épi traverse la gaine foliaire. L'infection dans l'une ou l'autre culture peut se poursuivre jusqu'à une date proche de la maturité du grain si les conditions environnementales sont favorables à l'organisme (ou aux organismes).
Les conditions les plus favorables à l'infection sont des périodes prolongées (48 à 72 heures) d'humidité élevée et de températures chaudes (75 à 85 degrés Fahrenheit (24°C à 30°C)). Cependant, l'infection peut se produire à des températures plus fraîches lorsque l'humidité élevée persiste pendant plus de 72 heures. Les infections précoces peuvent produire des spores transportées par l'air, qui sont responsables de la propagation secondaire de la maladie, en particulier si la culture présente une floraison inégale en raison de talles tardives.
Étant donné que le développement de la fusariose dépend de conditions environnementales favorables depuis la floraison (émergence des épis chez l'orge) jusqu'au développement des grains, l'apparition et la gravité de la maladie varient d'une année à l'autre. Une combinaison de facteurs peut conduire aux pertes de rendement et de qualité les plus sévères : un inoculum abondant, des périodes prolongées ou répétées d'humidité et de forte hygrométrie pendant la floraison (émergence des épis chez l'orge) jusqu'au développement des grains, et l'utilisation d'un cultivar très sensible.
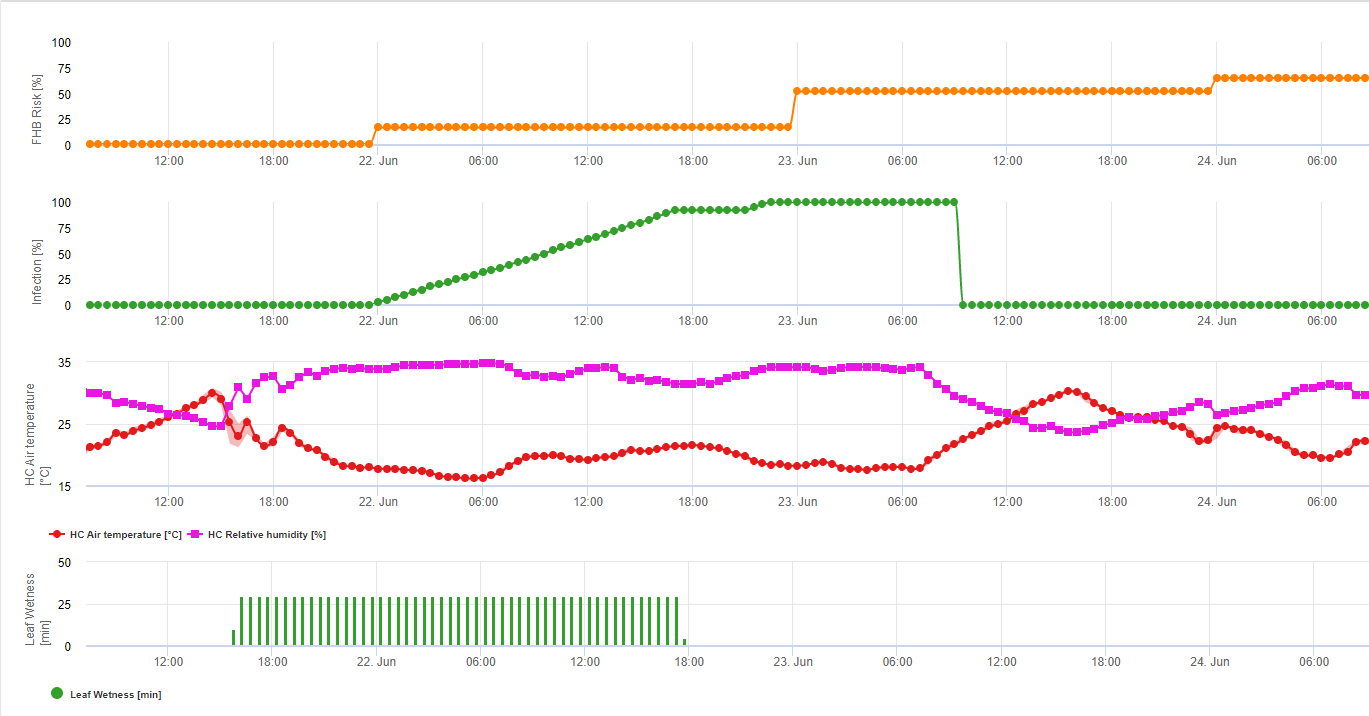
Modèle d'infection par la fusariose de l'épi
Les agents fongiques appartenant au complexe Fusarium Head Blight sur le blé sont connus pour être favorisés par des températures chaudes de 20 °C à 30 °C et de longues périodes d'humidité. Des périodes d'humidité foliaire de plusieurs jours conduisent à des symptômes visibles précoces. Mais les symptômes peuvent apparaître après une période de latence plus longue si l'infection est suivie d'une période d'humidité des feuilles de 18 heures ou même moins. Des symptômes peuvent également être observés après une inoculation artificielle à des températures de 15°C.
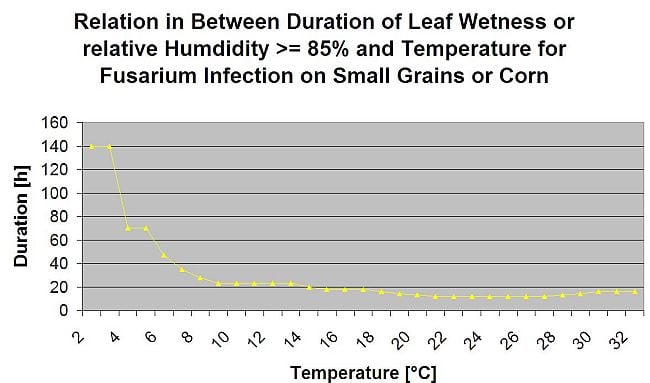


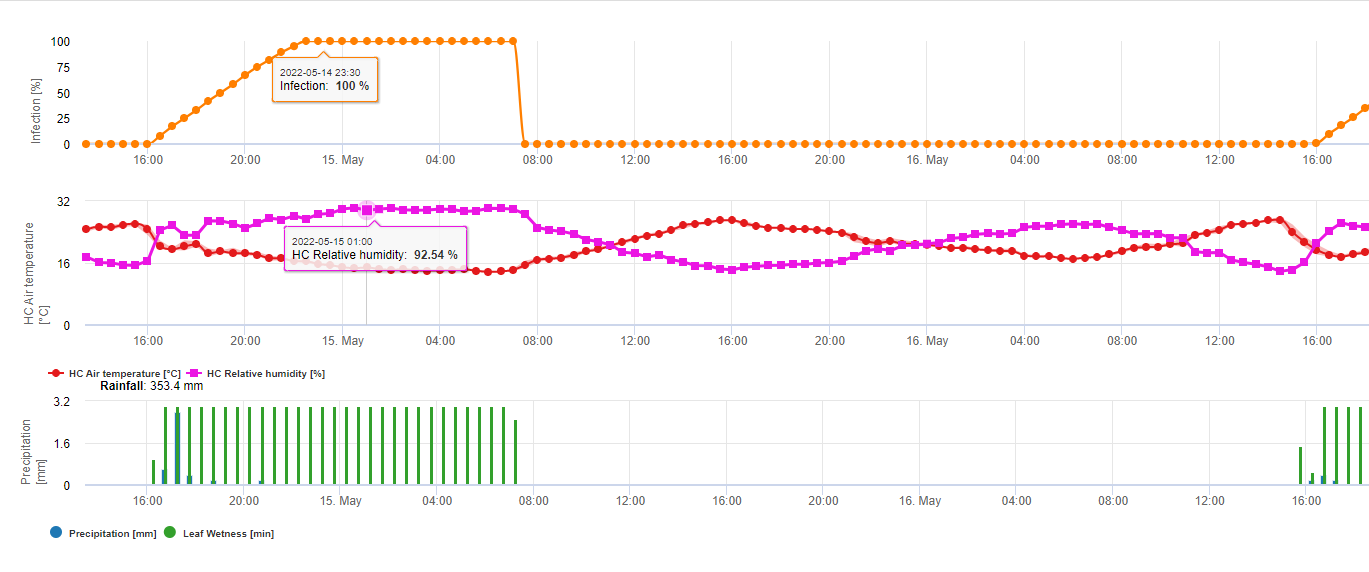
En résumant toutes les différentes combinaisons de températures et d'humidité que nous avons trouvées dans la littérature, nous avons décidé de signaler les infections par la fusariose de l'épi si la température et la période d'humidité des feuilles ou les périodes avec plus de 85% d'humidité relative dépassent les valeurs visualisées dans le graphique suivant.
Les infections sont déclenchées par une pluie de 2 mm. On peut supposer qu'il s'agit d'une infection par la fusariose de l'épi si la valeur de la progression de l'infection atteint 100%. Le calcul de cette valeur de progression suit la relation entre la durée des conditions humides et la température affichée dans le graphique ci-dessus.
Ce modèle est utilisé pour visualiser les jours d'infection et les conditions climatiques pendant le climat. La connaissance par les cultivateurs du stade de développement des différentes variétés de blé permet de décider de l'application d'une pulvérisation curative immédiatement après l'infection.
Alerte aux mycotoxines du fusarium
Les essais d'infection avec des périodes prolongées d'humidité foliaire de la fusariose de l'épi ont conduit à des teneurs élevées en mycotoxines. D'après ces informations, une période d'humidité foliaire de 48 heures ou plus au cours des stades 61 et 69 est considérée comme présentant un risque élevé de mycotoxines. Les expériences faites au cours des analyses de DON dans le blé cultivé commercialement ont montré que des périodes d'humidité foliaire suffisamment longues pour l'infection après une infection initiale dans les stades 61 à 69 peuvent également augmenter les valeurs de DON. En cas de périodes d'humidité foliaire plus longues, les mycotoxines peuvent augmenter jusqu'au stade 85. FieldClimate accumule un chiffre de risque proportionnel à la progression de l'infection pour chaque période d'infection réussie au cours de la période qui a été sélectionnée pour être appropriée pour ces calculs. 6 périodes d'infection tout juste terminées conduiraient à un risque de 100%. Normalement, la période d'humidité des feuilles menant à une infection par le fusarium est plus longue que le minimum nécessaire. Par conséquent, la plupart des infections par le fusarium entraîneront une augmentation du risque de plus de 17%. La valeur de risque indiquant une situation problématique en matière de mycotoxines dépend de l'historique du champ. Le blé cultivé après un maïs non travaillé ou le blé non travaillé après un maïs non travaillé ne présente qu'un faible risque s'il n'est pas pulvérisé dans des conditions optimales. Dans le cas du blé non pulvérisé, il faut s'attendre à une augmentation des valeurs de DON dès 35% de risque. Le blé qui suit une culture autre que le maïs ou le blé sans travail du sol peut présenter un risque plus élevé de 50%. Si le blé suit une culture de maïs ou de blé avec travail du sol, le risque accru peut atteindre 70%. Le blé de première année doit être testé pour le DON si le risque dépasse 100%.
1) Modèle de risque pour la fusariose de l'épi qui détermine les périodes à risque pour une infection. Lorsque l'infection 100% (ligne verte) est atteinte, le risque (ligne bleue) est très élevé et les conditions pour le champignon ont été favorables à l'infection. En fonction de la méthode d'application (curative, préventive), la période à risque est indiquée par la ligne bleue.
2) Fusariose de l'épi : Dans ce modèle, l'infection de la fusariose est calculée en fonction des précipitations (2 mm nécessaires), de l'humidité relative (supérieure à 85%) ou de l'humidité des feuilles, de la température pendant le processus. Si l'infection atteint 100%, les conditions optimales pour le champignon pathogène sont réunies. Le modèle calcule ensuite le risque de mycotoxine FHB.
Tache de la feuille mouchetée
Il existe deux principales maladies du blé dues à la septoriose. Il s'agit de la tache Septoria tritici, provoquée par le champignon Septoria tritici (téléomorphe : Mycophaerella graminicola) et Septoria nodorum blotch, causée par le champignon Septoria nodorum (téléomorphe : Leptosphaeria nodorum). Ces deux maladies entraînent de graves pertes de rendement allant de 31 à 53 pour cent (Eyal, 1981 ; Babadoost et Herbert, 1984 ; Polley et Thomas, 1991). Dans le monde entier, plus de 50 millions d'hectares de blé, poussant principalement dans les régions à forte pluviométrie, sont touchés. Au cours des 25 dernières années, ces maladies ont augmenté et sont devenues un facteur limitant majeur de la production de blé dans certaines régions. En cas d'épidémies graves, les grains des cultivars de blé sensibles sont ratatinés et impropres à la mouture. Les épidémies de Septoria tritici et de Septoria nodorum sont associées à des conditions climatiques favorables (pluies fréquentes et températures modérées), à des pratiques culturales spécifiques, à la disponibilité d'inoculum et à la présence de cultivars de blé sensibles (Eyal et al., 1987).
Septoria spp. Biologie
Suite à Erick De Wolf, Septoria Tritici Blotch, Kansas State University, avril 2008 Septoria tritici est causée par un champignon, l'acarien, qui est à l'origine de la tache des feuilles. Septoria tritici. Elle est présente dans toutes les zones de culture du blé du monde et constitue un problème sérieux dans de nombreuses régions. La tache Septoria tritici est la plus dommageable lorsque la maladie attaque les feuilles supérieures et les épis des variétés sensibles en fin de saison.
Symptômes
Septoria tritici Les symptômes de la tache noire apparaissent pour la première fois à l'automne. Les premiers symptômes sont de petites taches jaunes sur les feuilles. Ces lésions deviennent souvent légèrement bronzées en vieillissant, et les fructifications fongiques peuvent être observées dans les lésions sur les tiges. Les lésions sont de forme irrégulière et varient d'elliptiques à longues et étroites (figure 1). Les lésions contiennent de petites taches rondes et noires qui sont les fructifications du champignon. Les fructifications noires ressemblent à des grains de poivre noir et peuvent généralement être vues sans l'aide d'une loupe. La maladie commence sur les feuilles inférieures et progresse progressivement jusqu'à la feuille étendard. Les gaines des feuilles sont également susceptibles d'être attaquées. Les années humides, le champignon de la tache mouchetée peut se déplacer sur les têtes et provoquer des lésions brunes sur les glumes et les aulnes, connues sous le nom de tache des glumes. Ces lésions deviennent souvent légèrement bronzées en vieillissant et les fructifications fongiques sont souvent visibles dans les lésions sur les aulnes.
La phase de la tache des glumes peut entraîner une perte de rendement importante, mais la relation entre la gravité de la maladie et la perte de rendement n'est pas bien comprise. Septoria tritici peut être confondue avec d'autres maladies foliaires qui présentent des symptômes très similaires : la tache bronzée et la tache de l'épinette. Stagonspora nodorum par exemple. Il est fréquent que les plantes soient infectées par plusieurs de ces maladies foliaires, et il peut être nécessaire de procéder à des examens de laboratoire pour diagnostiquer avec précision les maladies les plus répandues. Un examen en laboratoire est presque toujours nécessaire pour déterminer la cause de la tache des glumes. La connaissance de l'espèce n'est pas importante pour les décisions de pulvérisation, car les trois maladies réagissent de la même manière aux fongicides. Cependant, le fait de savoir quelles sont les maladies les plus répandues est un élément important de la sélection des variétés, car différents gènes contrôlent la résistance aux maladies.
La manière la plus fiable de distinguer la tache septoriale des autres maladies est la présence de fructifications noires. Le champignon responsable de la tache bronzée ne produit pas ce type de structure reproductive. En revanche, dans des conditions humides, le champignon responsable de la tache Stagonospora nodorum produit des fructifications brun clair. Outre la différence de couleur, ces structures sont également plus petites que celles produites par Septoria tritici.
Cycle de vie
Septoria tritici survit pendant l'été sur les résidus d'une culture de blé précédente et commence les infections à l'automne. Il existe des preuves que le champignon est capable de survivre en association avec d'autres graminées hôtes et des semences de blé. Ces sources du champignon sont probablement les plus importantes lorsque les résidus de blé sont absents. Indépendamment des pratiques de rotation ou de gestion des résidus, il y a généralement suffisamment d'inoculum pour déclencher des infections à l'automne. Septoria tritici est favorisée par un temps frais et humide. La température optimale se situe entre 16 et 21 °C ; cependant, des infections peuvent se produire pendant les mois d'hiver à des températures aussi basses que 5 °C. L'infection nécessite au moins 6 heures d'humidité des feuilles, et jusqu'à 48 heures d'humidité pour une infection maximale. Une fois que l'infection a eu lieu, le champignon met 21 à 28 jours pour développer les fructifications noires caractéristiques et produire une nouvelle génération de spores. Les spores produites dans ces corps fructifères sont exsudées en masses collantes et il faut de la pluie pour les projeter sur les feuilles supérieures et les têtes.
Infection par Septoria tritici
Pycnidiospores de S. tritici germent dans l'eau libre à partir des deux extrémités de la spore ou des cellules intercalaires (Weber, 1922). La germination des spores ne commence qu'environ 12 heures après le contact avec la feuille. Les tubes germinatifs se développent au hasard sur la surface de la feuille. Weber (1922) n'a observé qu'une pénétration directe entre les cellules épidermiques, mais d'autres ont conclu que la pénétration à travers les stomates ouverts et fermés est le principal moyen de pénétration de l'hôte (Benedict, 1971 ; Cohen et Eyal, 1993 ; Hilu et Bever, 1957). Kema et al. (1996) n'ont observé que la pénétration stomatique. Les hyphes qui se développent à travers les stomates se resserrent jusqu'à un diamètre d'environ 1 μm, puis s'élargissent après avoir atteint la cavité sous-matale.
Les hyphes se développent parallèlement à la surface de la feuille sous les cellules épidermiques, puis à travers le mésophylle jusqu'aux cellules de l'épiderme inférieur, mais pas dans l'épiderme. Il n'y a pas de formation d'haustoria et la croissance des hyphes est limitée par les cellules du sclérenchyme autour des faisceaux vasculaires, sauf lorsque les hyphes sont très denses. Les faisceaux vasculaires ne sont pas envahis. Les hyphes se développent de manière intercellulaire le long des parois cellulaires à travers le mésophylle, se ramifiant au niveau d'un septum ou du milieu d'une cellule. Aucun symptôme macroscopique n'apparaît pendant environ 9 jours, à l'exception d'une cellule morte occasionnelle, mais les cellules du mésophylle meurent rapidement après 11 jours. Les pycnides se développent dans des chambres sous-matricielles. Les hyphes se développent rarement dans les cellules de l'hôte (Hilu et Bever, 1957 ; Kema et al, 1996 ; Weber, 1922).
L'infection ne réussit qu'après au moins 20 heures d'humidité élevée. Seules quelques mouchetures brunes se développent si les feuilles restent humides pendant 5-10 heures après le dépôt des spores (Holmes et Colhoun, 1974) ou jusqu'à 24 heures (Kema et al., 1996). Les relations hôte-parasite sont les mêmes sur les blés résistants ou sensibles. La germination des spores à la surface des feuilles est la même quelle que soit la sensibilité. Le nombre de pénétrations réussies est à peu près le même, mais la croissance des hyphes est plus rapide chez les cultivars sensibles, ce qui entraîne un plus grand nombre de lésions. Les hyphes s'étendent au-delà de la zone nécrosée chez tous les cultivars. Une toxine peut jouer un rôle dans la pathogenèse (Cohen et Eyal, 1993 ; Hilu et Bever, 1957). En revanche, la colonisation a été fortement réduite sur une lignée résistante (Kema et al., 1996).
Stagonospora (Septoria) et Septoria pathogènes des céréales : Le processus d'infection
B.M. Cunfer, Département de pathologie végétale, Université de Géorgie, Griffin, GA
Le processus d'infection a fait l'objet des études les plus approfondies pour Stagonospora (Septoria) nodorum et Septoria tritici. Une étude approfondie sur Septoria passerinii est disponible. Presque toutes les informations rapportées concernent l'infection par les pycnidiospores. Cependant, le processus d'infection pour d'autres formes de spores est assez similaire. Les informations présentées concernent principalement l'infection des feuilles dans des conditions optimales. Certaines études ont été réalisées avec des plants intacts, tandis que d'autres ont été réalisées avec des feuilles détachées. Infection du coléoptile et de la plantule de blé par des S. nodorum a été décrite en détail par Baker (1971) et analysée par Cunfer (1983). Bien qu'aucune comparaison précise n'ait été faite, il semble que le processus d'infection présente de nombreuses similitudes dans chaque système hôte-parasite et soit typique de nombreux pathogènes nécrotrophes. Les informations sur les facteurs influençant le développement des symptômes et l'expression de la maladie sont exclues mais ont été examinées par d'autres auteurs (Eyal et al., 1987 ; King et al., 1983 ; Shipton et al., 1971). Un résumé des facteurs affectant la longévité des spores à la surface des feuilles est inclus.
Rôle des cirrus et survie des spores sur la surface de la feuille Les informations les plus détaillées sur la fonction du cirrus enveloppant les pycnidiospores exsudées par le pycnidium sont pour S. nodorum. Le cirrus est un gel composé d'éléments protéiques et saccharidiques. Sa composition et sa fonction sont similaires à celles d'autres champignons des Sphaeropsidales (Fournet, 1969 ; Fournet et al., 1970 ; Griffiths et Peverett, 1980). Les rôles principaux des composants du cirrus sont la protection des pycnidiospores contre la dessiccation et la prévention de la germination prématurée.
Le cirrus protège les pycnidiospores de telle sorte que certaines restent viables pendant au moins 28 jours (Fournet, 1969). Lorsque le cirrus est dilué avec de l'eau, si la concentration de la solution de cirrus est >20%, moins de 10% de pycnidiospores germent. À une concentration plus faible, les composants fournissent des nutriments qui stimulent la germination des spores et l'allongement des tubes germinatifs. La longueur des tubes germinatifs augmente jusqu'à une concentration de 15% cirrus, puis diminue modérément à des concentrations plus élevées (Harrower, 1976). Brennan et al. (1986) ont rapporté une germination plus importante dans un cirrus dilué. Les composants du cirrus réduisent la germination à 10-60% d'humidité relative. Une fois que les spores sont dispersées, les effets stimulants du liquide de cirrus sont probablement négligeables (Griffiths et Peverett, 1980).
À une humidité relative de 35-45%, les spores de S. tritici dans les cirres sont restées viables pendant au moins 60 jours (Gough et Lee, 1985). Les composants du cirrus peuvent agir comme un inhibiteur de la germination des spores, ou le potentiel osmotique élevé du cirrus peut empêcher la germination. Les pycnidiospores de S. nodorum n'ont pas survécu pendant 24 heures à une humidité relative supérieure à 80% à 20 C. Les spores ont survécu deux semaines ou plus à une humidité relative <10% (Griffiths et Peverett, 1980). Lorsque le fluide de cirrus de S. nodorum diluées dans l'eau, environ deux tiers des pycnidiospores ont perdu leur viabilité en 8 heures, et après 30 heures à la lumière du jour, seules 5% ont germé. Lorsque les spores sont conservées dans l'obscurité, 40% restent viables après 30 heures (Brennan et al., 1986).
Conidies sèches de S. nodorumLes pycnidiospores de S. nodorum, à l'ombre et en plein soleil, ont survécu à l'extérieur pendant au moins 56 heures (Fernandes et Hendrix, 1986a). La germination des pycnidiospores de S. nodorum a été inhibée par des UV-B continus (280-320 nm), alors que la germination des pycnidiospores de S. nodorum a été inhibée par des UV-B continus (280-320 nm). S. tritici ne l'était pas. L'extension des tubes germinatifs sous UV-B continu a été inhibée pour les deux champignons, par rapport à l'obscurité (Rasanayagam et al., 1995).
Infection par Septoria nodorum
Le processus de pénétration de l'hôte et le développement des S. nodorum La pénétration des pycnidiospores dans la feuille a été examinée en détail par plusieurs chercheurs (Baker et Smith, 1978, Bird et Ride, 1981, Karjalainen et Lounatmaa, 1986 ; Keon et Hargreaves, 1984 ; Straley, 1979 ; Weber, 1922). Les pycnidiospores ont tendance à se loger dans les dépressions entre deux cellules épidermiques, et de nombreuses tentatives de pénétration des feuilles commencent par là. Les spores germent à la surface des feuilles en réponse à l'humidité libre (Fernandes et Hendrix, 1986b). Elles commencent à germer 2-3 heures après le dépôt, et après 8 heures la germination peut atteindre 90%. La pénétration des feuilles commence environ 10 heures après le dépôt des spores (Bird et Ride, 1981 ; Brönnimann et al., 1972 ; Holmes et Colhoun, 1974).
Au début de la germination, le tube germinatif est entouré d'une matière amorphe qui s'attache à la feuille. Les tubes germinatifs qui poussent à partir des deux extrémités d'une spore et des cellules intercalaires ont tendance à se développer le long des dépressions entre les cellules et sont souvent orientés le long de l'axe long de la feuille (O'Reilly et Downes, 1986). Les hyphes provenant de spores qui ne sont pas dans des dépressions poussent de manière aléatoire avec des ramifications occasionnelles (Straley, 1979). Un appressorium se forme avec une tige d'infection qui pénètre la cuticule et les parois périclinales des cellules épidermiques directement dans le lumen cellulaire, ce qui entraîne la mort rapide des cellules.
De nombreuses pénétrations sont d'abord subcuticulaires ou la croissance latérale d'un hyphe se produit à l'intérieur de la paroi cellulaire avant la croissance dans le cytoplasme (Bird et Ride, 1981 ; O'Reilly et Downes, 1986). La pénétration à travers les stomates ouverts ou fermés se produit également et peut être plus rapide que la pénétration directe (Harrower, 1976 ; Jenkins, 1978 ; O'Reilly et Downes, 1986 ; Straley, 1979). Les tubes germinatifs se ramifient au niveau des stomates et des jonctions de cellules épidermiques. La pénétration d'un tube germinatif dans un stomate peut se produire sans formation d'un appressorium. La pénétration se fait parfois à travers les trichomes (Straley, 1979). Apparemment, la plupart des tentatives de pénétration échouent, des papilles denses se formant dans les cellules au site de la tentative de pénétration (Karjalainen et Lounatmaa, 1986 ; Bird et Ride, 1981).
Après la pénétration, les cellules épidermiques meurent rapidement et se lignifient, et les hyphes se développent dans le mésophylle. Les cellules du mésophylle se déforment et du matériel lignifié se dépose à l'extérieur de certaines cellules, qui s'effondrent alors. La lignification se produit avant que les hyphes n'atteignent la cellule. Le processus est le même dans tous les cultivars mais se développe plus lentement dans les cultivars résistants. Les hyphes se développent de manière intercellulaire entre les cellules épidermiques, puis dans le mésophylle. Lorsque le mésophylle est pénétré, la détérioration des chloroplastes commence en 6-9 jours (Karjalainen et Lounatmaa, 1986).
Cependant, le taux de photosynthèse commence à diminuer un jour après l'infection et avant que les symptômes ne soient visibles (Krupinsky et al, 1973). Le sclérenchyme entourant les faisceaux vasculaires empêche l'infection des tissus vasculaires. Les faisceaux vasculaires bloquent la dissémination des hyphes à travers le mésophylle, sauf lorsque le tissu sclérenchyme est jeune et pas complètement formé (Baker et Smith, 1978).
Stagonospora nodorum libère une large gamme d'enzymes dégradant les parois cellulaires, y compris l'amylase, la pectine méthyl estérase, les polygalacturonases, les xylanases et la cellulase in vitro et pendant l'infection des feuilles de blé (Baker, 1969 ; Lehtinen, 1993 ; Magro, 1984). Les informations relatives à la dégradation des parois cellulaires par les enzymes sont en accord avec les observations histologiques. Ces enzymes peuvent agir en conjonction avec les toxines. La sensibilité aux enzymes peut être liée à la résistance et au taux de colonisation fongique (Magro, 1984). Comme de nombreux nécrotrophes, les pathogènes Septoria et Stagonospora produisent des composés phytotoxiques in vitro. La détérioration et la mort des cellules avant la croissance des hyphes dans le tissu mésophylle (Bird et Ride, 1981) sont compatibles avec la production de toxines. Cependant, le rôle définitif des toxines dans le processus d'infection et leur relation avec la résistance de l'hôte n'ont pas été établis (Bethenod et al, 1982 ; Bousquet et al, 1980 ; Essad et Bousquet, 1981 ; King et al, 1983). Les différences de gamme de plantes-hôtes entre les souches de S. nodorum peut être liée à la production de toxines (Bousquet et Kollmann, 1998). L'initiation de la germination des spores et le pourcentage de spores germées ne sont pas influencés par la sensibilité de l'hôte (Bird et Ride, 1981 ; Morgan 1974 ; Straley, 1979 ; Straley et Scharen, 1979 ; Baker et Smith, 1978).
Bird et Ride (1981) signalent que l'extension des tubes germinatifs à la surface des feuilles est plus lente sur les cultivars résistants que sur les cultivars sensibles. Ce mécanisme, qui s'exprime au moins 48 heures après le dépôt des spores, indique une résistance à l'élongation des tubes germinatifs avant la pénétration. Il y a eu moins de pénétrations réussies chez les cultivars résistants, et la pénétration s'est déroulée plus lentement sur les cultivars résistants (Baker et Smith, 1978 ; Bird et Ride, 1981). La lignification a été proposée pour limiter l'infection dans les cultivars résistants et sensibles, mais d'autres facteurs ont ralenti le développement du champignon dans les lignées résistantes. Dans les lignées sensibles, les hyphes à croissance plus rapide peuvent échapper à la lignification des cellules hôtes. Quatre jours après l'inoculation de l'orge avec un isolat de S. nodorumLes hyphes de pénétration se développent à travers la cuticule et parfois dans les couches externes de cellulose des parois cellulaires épidermiques. Des papilles épaisses se sont déposées sous les hyphes de pénétration et les cellules n'ont pas été pénétrées (Keon et Hargreaves, 1984).
Infection par Septoria passerinii
Green et Dickson (1957) présentent une description détaillée du processus d'infection du S. passerinii sur l'orge. Le processus d'infection est similaire à celui de la S. tritici. Comme pour S. tritici, le temps nécessaire à la pénétration des feuilles est considérablement plus long que pour S. tritici. S. nodorum. Les tubes germinatifs se ramifient et se développent sur la surface de la feuille au hasard, mais parfois le long des dépressions entre les cellules épidermiques. La pénétration des feuilles se fait presque exclusivement par les stomates. Les hyphes de germination se gonflent et, si la pénétration échoue, les hyphes continuent à s'allonger. Il n'y a pas de pénétration 48 heures après le dépôt des spores. Après 72 heures, les tubes germinatifs s'épaississent au-dessus des stomates, se développent entre les cellules de garde et sur les faces des cellules accessoires et dans les cavités sous-matales. La pénétration directe entre les cellules épidermiques n'est que rarement observée.
La germination des spores et la pénétration de l'hôte sont les mêmes sur les cultivars résistants et sensibles. L'extension des hyphes à l'intérieur des feuilles est beaucoup moins importante sur les cultivars résistants et des papilles sont observées sur de nombreuses parois cellulaires, mais pas sur toutes. Les hyphes se développent sous l'épiderme d'un stomate à l'autre, mais ne pénètrent pas entre les cellules épidermiques. Le mésophylle est colonisé, mais aucun haustoria ne se forme. Après la nécrose des cellules du mésophylle, les cellules de l'épiderme s'effondrent. Le développement mycélien dans la feuille est peu abondant et généralement bloqué par les faisceaux vasculaires. Dans les feuilles plus jeunes, si la gaine vasculaire est moins développée, les hyphes passent entre le faisceau et l'épiderme. Les pycnides se forment dans les cavités sous-matales, principalement sur la face supérieure des feuilles (Green et Dickson, 1957).
Facteurs affectant la longévité des spores Parmi les pathogènes Stagonospora et Septoria des céréales, des informations définitives sur le processus d'infection n'ont été rapportées que pour le Stagonospora et le Septoria. S. nodorum, S. triticiet S. passerinii. Comme beaucoup d'autres pathogènes nécrotrophes, aucun de ces deux groupes de pathogènes ne provoque de réaction hypersensible. Une différence significative dans le processus d'infection entre les pathogènes Septoria et Stagonospora est que la germination et la pénétration des spores se déroulent beaucoup plus rapidement pour les Septoria et les Stagonospora. S. nodorum que pour S. tritici et S. passerinii. Cela a une influence significative sur l'épidémiologie des maladies.
Les agents pathogènes de la septoriose pénètrent dans la plante principalement par les stomates, tandis que les agents pathogènes de la S. nodorum pénètre à la fois directement et à travers les stomates. S. nodorum pénètre et tue rapidement les cellules de l'épiderme, mais S. tritici et S. passerinii ne tuent pas les cellules épidermiques avant que les hyphes ne se soient ramifiées à travers le mésophylle de la feuille et qu'une nécrose rapide ne commence. Les études histologiques de la croissance fongique après la pénétration de l'hôte correspondent aux données générées par les études épidémiologiques de la résistance de l'hôte. La résistance ralentit le taux de colonisation de l'hôte mais n'a pas d'effet appréciable sur le processus de développement des lésions.
Les mécanismes contrôlant la réponse de l'hôte, qu'ils soient liés aux enzymes et aux toxines ou à d'autres métabolites libérés par les pathogènes au cours de l'infection, ne sont pas encore clairs. Il existe peu d'informations sur l'infection par les ascospores. Le processus d'infection est probablement très similaire à celui des pycnidiospores. Les ascospores de Phaeosphaeria nodorum germent dans une large gamme de températures, et leurs tubes germinatifs pénètrent directement dans la feuille. Cependant, selon Rapilly et al. (1973), les ascospores, contrairement aux pycnidiospores, ne germent pas dans l'eau libre.
Modèle d'infection par Septoria spp.
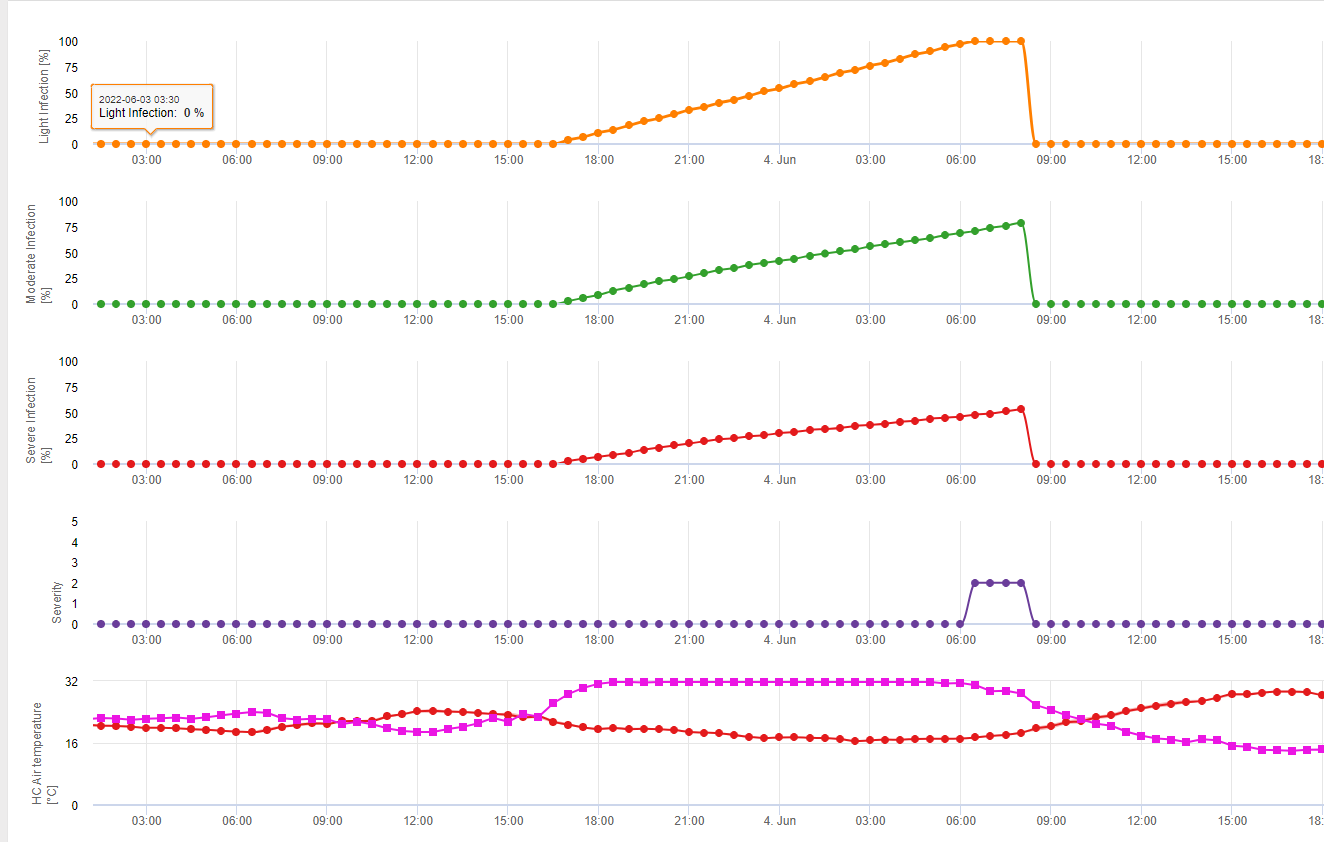
Les infections par la septoriose sont possibles à des températures basses, alors que les températures inférieures à 7°C peuvent ne pas conduire à une infection dans les 2 jours. La température optimale de la maladie est atteinte dans une zone de 16 à 21°C. Les infections sont possibles pendant une période d'humidité relative élevée ou d'humidification des feuilles de 14 heures ou plus. Pour répondre à ces conditions, nous avons décidé de séparer les modèles pour les infections faibles, modérées et sévères. Les infections faibles peuvent être données s'il est possible pour le pathogène d'infecter le tissu de l'hôte. Cela signifie que les infections faibles peuvent avoir lieu si les températures sont minimales et si les périodes d'humidité des feuilles sont d'une durée critique. Une infection modérée a lieu dans des conditions où la plupart des essais d'infection donnent des résultats raisonnables et les infections sévères ont lieu dans des conditions où le pathogène a des conditions optimales pour l'infection.
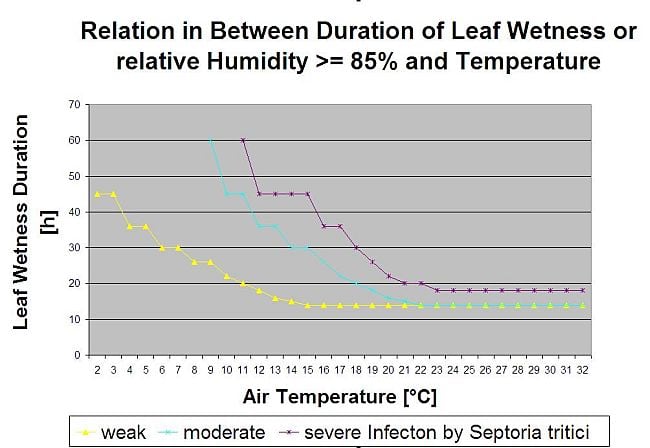


Début de l'infection après une pluie de 0,5 mm. Nous avons décidé de ne pas utiliser de modèle pour la formation des pycnides. Les conditions nécessaires à la formation des pycnides sont supposées être une période où l'humidité relative est supérieure à 85%. La durée de vie des pycnides est estimée à 24 heures. Dans tous les climats où Septoria tritici a une chance d'infecter, nous trouverons 2 heures remplissant ces conditions presque tous les jours autour du lever du soleil.
Évaluation de la gravité de l'infection
Pour pouvoir évaluer la pression d'infection de Septoria tritici entre le stade 10 (première feuille à travers le coléoptile) et le stade 32 (nœud deux au moins 2 cm au-dessus du nœud 1) et entre 32 et 51 (début de l'épiaison), nous devons évaluer la sévérité des infections en fonction des conditions climatiques. Cette évaluation se fait sur une échelle de 1 à 5. Une sévérité de 1 est donnée si la condition pour une faible infection est remplie et qu'il a plu moins de 5 mm, sinon la valeur de sévérité correspondante sera 2. Une gravité de 3 est attribuée si une infection modérée est remplie et qu'il a plu moins de 5 mm. S'il a plu plus de 5 mm au cours d'une infection modérée ou moins de 5 mm au cours d'une infection sévère, la gravité est de 4.
Une infection sévère avec plus de 5 mm de pluie correspond à une valeur de sévérité de 5.
Septoria tritici évaluation de la pression de la maladie
Le climat n'est qu'un des facteurs qui déterminent la pression de la maladie dans le champ. Les deux autres facteurs sont l'historique du champ et la sensibilité de la variété cultivée. Si nous pouvons accumuler les valeurs de sévérité de la maladie du stade 10 au stade 32 jusqu'à une valeur de 4, nous pouvons nous attendre à une faible pression de la maladie par le climat. Si cette valeur atteint 6, on peut s'attendre à une pression modérée de la maladie et si elle atteint 10, on peut s'attendre à une forte pression de la maladie de la part du climat. La connaissance de la sensibilité de la variété et de l'historique du champ nous amènera à pulvériser ou non en cas de pression faible ou modérée de la maladie dans cette situation. Une valeur cumulée de 10 peut de toute façon conduire à une pulvérisation au stade 32. La décision de pulvériser à un stade plus avancé dépend davantage du climat printanier. Si nous pouvons accumuler les valeurs de sévérité depuis le stade 10 jusqu'à une valeur de 6, nous pouvons nous attendre à une faible pression de la maladie. Si cette valeur atteint 10, on peut s'attendre à une pression modérée de la maladie et si cette valeur atteint 15, on peut s'attendre à une forte pression de la maladie en raison de la situation climatique.
Dans FieldClimate, nous montrons le Septoria tritici Sévérité avec les trois différentes sévérités d'infection dans un graphique (voir ci-dessus). En raison des précipitations et des longues périodes d'humectation des feuilles, les conditions d'une infection sévère par le S. tritici ont été en plein champ les 14 et 16 mai. Les niveaux de gravité atteignent la valeur maximale de 5 le 14 mai, ce qui signifie que le risque d'infection est désormais élevé.
La biologie de l'infection de Stagonospora nodorum diffère dans une certaine mesure de celle de S. tritici, mais cette différence n'est pas suffisamment importante pour justifier un modèle distinct. C'est pourquoi nous suggérons d'utiliser ce modèle pour l'ensemble des maladies de Stagnospora et de Septoria dans les céréales, y compris S. passerinii. S. tritici et S. passerinii ont tendance à avoir besoin de périodes d'humectation plus longues que les S. nodorum. Dans les régions où l'anticyclone de S. nodorum Les infections classées comme faibles, avec une valeur de gravité de 2, doivent être traitées plus sérieusement que dans d'autres domaines.
Pour Septoria nodorum Un modèle de risque est présenté dans le document FieldClimate (voir ci-dessus). Un risque élevé a été déterminé le 17 juin et le 7 juillet (100%). En fonction du stade de la plante sensible à l'infection, des mesures de protection des plantes doivent être prises en compte si le risque atteint 80% (voir également les prévisions météorologiques, la protection des plantes). Si le risque est de 100% et qu'une infection a déjà été détectée, des mesures phytosanitaires systémiques (application curative) doivent être prises pour protéger la plante.
Explosion de riz
Sous les tropiques, les spores de la pyriculariose sont présentes dans l'air tout au long de l'année, ce qui favorise le développement continu de la maladie. L'infection provoquée par le champignon endommage davantage le riz pluvial que le riz irrigué. Il attaque rarement les gaines foliaires. L'infection primaire commence là où les semences sont semées densément dans des boîtes de semis pour le repiquage mécanique.
Dans les pays tempérés, elle se développe dans les résidus de culture infestés ou dans les semences. Un ciel nuageux, des pluies fréquentes et des bruines favorisent le développement et la gravité de la pyriculariose du riz. Des niveaux élevés d'azote, une forte humidité relative et des feuilles humides favorisent l'infection causée par le champignon. Le taux de sporulation est plus élevé lorsque l'humidité relative augmente de 90% ou plus. En ce qui concerne l'humidité des feuilles, la température optimale pour la germination du pathogène est de 25-28 °C. La culture du riz dans un sol aérobie dans les zones humides où le stress de la sécheresse est prédominant favorise également l'infection.
Un champignon responsable de la pyriculariose du riz. Ses conidiophores sont produits en grappes à partir de chaque stoma. Ils sont rarement solitaires avec 2-4 septa. La zone basale des conidiophores est gonflée et se rétrécit vers l'apex plus clair. Les conidies du champignon mesurent 20-22 x 10-12 µm. Les conidies sont bi-septales, translucides et légèrement foncées. Elles sont obclavées et s'effilent à l'apex. Elles sont tronquées ou prolongées par une courte dent à la base.
Outre la plante de riz, le champignon survit également sur Agropyron repens (L.) Gould, Agrostis palustris, A. tenuis, Alopecurus pratensis, Andropogon sp., Anthoxanthum odoratum, Arundo donax L., Avena byzantina, A. sterilis, A. sativa, Brachiaria mutica (Forssk.) Stapf, Bromus catharticus, B. inermis, B. sitchensis, Canna indica, Chikushichloa aquatica, Costus speciosus, Curcuma aromatica, Cynodon dactylon (L.) Pers.., Cyperus rotundus L., C. compressus L., Dactylis glomerata, Digitaria sanguinalis (L.) Scop, Echinochloa crus-galli (L.) P. Beauv.., Eleusine indica (L.) Gaertn., Eragrostis sp., Eremochloa ophiuroides, Eriochloa villosa, Festuca altaica, F. arundinacea, F. elatior, F. rubra, Fluminea sp.., Glyceria leptolepis, Hierochloe odorata, Holcus lanatus, Hordeum vulgare, Hystrix patula, Leersia hexandra Sw., L. japonica, L. oryzoides, Lolium italicum, L. multiflorum, L. perenne, Muhlenbergia sp.., Musa sapientum, Oplismenus undulatifolius (Ard.) Roem. & Schult., Panicum miliaceum L., P. ramosum (L.) Stapf, P. repens L., Pennisetum typhoides (L.) R. Br., Phalaris arundinacea L., P. canariensis, Phleum pratense, Poa annua L., P. trivialis, Saccharum officinarum, Secale cereale, Setaria italica (L.) P. Beauv..., S. viridis (L.) P. Beauv., Sorghum vulgare, Stenotaphrum secundatum, Triticum aestivum, Zea mays L., Zingiber mioga, Z. officinale et Zizania latifolia..
Les conidies sont produites sur les lésions de la plante de riz environ 6 jours après l'inoculation. La production de spores augmente avec l'augmentation de l'humidité relative. La plupart des spores sont produites et libérées pendant la nuit. La germination des spores est suivie d'une infection. Les tubes d'infection se forment à partir des appressoria et plus tard de la pénétration à travers la cuticule et l'épiderme. Après avoir pénétré dans la cellule, le tube infectieux forme une vésicule qui donne naissance aux hyphes. Dans la cellule, les hyphes se développent librement.
La pyriculariose infecte les plants de riz à n'importe quel stade de croissance. Les plantules de riz ou les plantes au stade du tallage sont souvent complètement tuées. De même, les infections importantes sur les panicules entraînent généralement une perte de rendement.
Anthracnose
Le modèle de R. solani dans les champs évalue le risque de cette maladie sur la base de la température, de l'humidité des feuilles et du rayonnement global. Les contrôles durent 120 heures :
- En cas de mouillage consécutif des feuilles, il accumule la température en fonction des valeurs pour chaque minute.
- 12 °C à 15 °C il en accumule 1 par minute
- 16 °C à 17 °C il en accumule 2 par minute
- 18°C et plus il en accumule 4 par minute - À la fin des périodes d'humectation des feuilles, il évalue les valeurs accumulées
- s'ils sont supérieurs à 4096, le risque est augmenté de 64 points et 4096 sont soustraits de la valeur.
- si le résidu est supérieur à 2048, le risque est augmenté de 16 et 2048 est soustrait de la valeur.
- si le résidu est supérieur à 1024, il augmente le risque de 4 et soustrait 1024 de la valeur. - Si le rayonnement global est consécutivement supérieur à 800 W/m², accumuler le temps en minutes et si le rayonnement devient inférieur, évaluer les valeurs :
- Valeur > 512 = Valeur du risque - 32 points , Valeur - 512
- Valeur > 256 = Valeur du risque - 8 points , Valeur - 256
- Valeur >128= RisKValue - 2 Points, Valeur -128
Le modèle aboutit à une valeur de risque comprise entre 0 et 100 indiquant les moments favorables pour R. solani dans les champs.
Système de soutien
Le modèle de lutte contre la brûlure de la gaine met en évidence les périodes à haut risque pour cette maladie. Aucune pulvérisation ne devra être effectuée pendant les périodes où le risque est faible. Dans les périodes à risque modéré, l'intervalle de pulvérisation peut être prolongé et dans les périodes à risque élevé, l'intervalle de pulvérisation peut devoir être réduit ou des composés plus efficaces devront être utilisés.
Littérature
Maladies de la rouille
- Anikster, Y., Bushnell, W.R., Eilam, T., Manisterski, J. & Roelfs, A.P. 1997. Puccinia recondita causant la rouille des feuilles sur les blés cultivés, les blés sauvages et le seigle. Can. J. Bot. 75 : 2082-2096.
- Azbukina, Z. 1980. Importance économique des hôtes spéciaux des champignons de la rouille des céréales dans l'Extrême-Orient soviétique. In Proc. 5th European and Mediterranean Cereal Rusts Conf., p.199-201. Bari, Rome.
- Beresford, R.M. 1982. La rouille striée (Puccinia striiformis), une nouvelle maladie du blé en Nouvelle-Zélande. Cer. Rusts Bull. 10 : 35-41.
- Biffen, R.H. 1905. Les lois de l'hérédité de Mendel et la sélection du blé. J. Agric. Sci., 1 : 4-48.
- Borlaug, N.E. 1954. Mexican wheat production and its role in the epidemiology of stem rust in North America. Phytopathology, 44 : 398-404.
- Buchenauer, H. 1982. Chemical and biological control of cereal rust. In K.J. Scott & A.K. Chakravorty, eds. The rust fungi, p. 247-279. Londres, Academic Press.
- Burdon, J.J., Marshall, D.R. & Luig, N.H. 1981. Isozyme analysis indicates that a virulent cereal rust pathogen is somatic hybrid. Nature, 293 : 565-566.
- Casulli, F. 1988. Overseasoning of wheat leaf rust in southern Italy (sursaisonnement de la rouille des feuilles du blé dans le sud de l'Italie). In Proc. 7ème conférence européenne et méditerranéenne sur les rouilles des céréales, 5-9 septembre, p. 166-168. Vienne.
- Chester, K.S. 1946. La nature et la prévention des rouilles des céréales illustrées par la rouille des feuilles du blé. In Chronica botanica. Walthan, MA, USA. 269 p.
- Craigie, J.H. 1927. Experiments on sex in rust fungi. Nature, 120 : 116-117.
- Cummins, G.B. & Caldwell, R.M. 1956. The validity of binomials in the leaf rust fungus complex of cereals and grasses. Phytopathology, 46 : 81-82.
- Cummins, G.B. & Stevenson, J.A. 1956. Liste de contrôle des champignons de la rouille nord-américaine (Uredinales). Plant Dis. Rep. suppl. 240 : 109-193.
- d'Oliveira, B. & Samborski, D.J. 1966. Stade écidien de Puccinia recondita sur Ranunculaceae et Boraginaceae au Portugal. In Proc. Cereal Rusts Conf., Cambridge, p 133-150.
- DeBary, A. 1866. Neue Untersuchungen uber die Uredineen insbesondere die Entwicklung der Puccinia graminis und den Zusammenhang duselben mit Aecidium berberis. In Monatsber Preuss. Akad. Wiss., Berlin, p. 15-20.
- de Candolle, A. 1815. Uredo rouille des cereales. In Flora francaise, famille des champignons, p. 83.
- Dubin, H.J. & Stubbs, R.W. 1986. Epidemic spread of barley stripe rust in South America. Plant Dis, 70 : 141-144.
- Dubin, H.J. & Torres, E. 1981. Causes et conséquences de l'épidémie de rouille des feuilles du blé de 1976-1977 dans le nord-ouest du Mexique. Ann. Rev. Phytopath. 19 : 41-49.
- Eriksson, J. 1894. Uber die Spezialisierung des Parasitismus bei dem Getreiderostpilzen. Ber. Deut. Bot. Ges. 12 : 292-331.
- Eriksson, J. & Henning, E. 1894. Die Hauptresultate einer neuen Untersuchung uber die Getreideroste. Z. Pflanzenkr. 4 : 66-73, 140-142, 197-203, 257-262.
- Eriksson, J. & Henning, E. 1896. Die Getreideroste. Ihre Geschichte und Natur sowie Massregein gegen dieselben, p. 463. Stockholm, P.A. Norstedt and Soner.
- Ezzahiri, B., Diouri, S. & Roelfs, A.P. 1992. The-Role of the alternate host, Anchusa italica, in the epidemiology of Puccinia recondita f. sp. tritici on durum wheats in Morocco. In F.J. Zeller & G. Fischbeck, eds. Proc. 8th European and Mediterranean Cereal Rusts and Mildews Conf. 1992, p. 69-70. Heft 24 Weihenstephan, Allemagne.
- Fontana, F. 1932. Observations sur la rouille des céréales. P.P. Pirone, trad. Classics No. 2. Washington, DC, Amer. Phytopathol. Society. (Publié à l'origine en 1767).
- Green, G.J. & Campbell, A.B. 1979. Cultivars de blé résistants à Puccinia graminis tritici dans l'ouest du Canada : leur développement, leur performance et leur valeur économique. Can. J. Plant Pathol. 1 : 3-11.
Groth, J.V. & Roelfs, A.P. 1982. The effect of sexual and asexual reproduction on race abundance in cereal rust fungus populations. Phytopathology, 72 : 1503-1507. - Hare, R.A. & McIntosh, R.A. 1979. Etudes génétiques et cytogénétiques de la résistance durable des plantes adultes à la rouille du blé chez 'Hope' et les cultivars apparentés. Z. Pflanzenzüchtg, 83 : 350-367.
- Hart, H. & Becker, H. 1939. Beitrage zur Frage des Zwischenwirts fur Puccinia glumarum Z. Pflanzenkr. (Pflanzenpathol.) Pflanzenschutz, 49 : 559-566.
- Hendrix, J.W., Burleigh, J.R. & Tu, J.C. 1965. Oversummering of stripe rust at high elevations in the Pacific Northwest-1963. Plant Dis. Rep. 49 : 275-278.
- Hermansen, J.E. 1968. Etudes sur la propagation et la survie des maladies de la rouille et du mildiou des céréales au Danemark. Contrib. No. 87. Copenhague, Département de pathologie végétale, Royal Vet. Agriculture College. 206 p.
- Hirst, J.M. & Hurst, G.W. 1967. Long-distance spore transport. In P.H. Gregory & J.L. Monteith, eds. Airborne microbes, p. 307-344. Cambridge University Press.
- Hogg, W.H., Hounam, C.E., Mallik, A.K. & Zadoks, J.C. 1969. Facteurs météorologiques affectant l'épidémiologie des rouilles du blé. WMO Tech. Note No. 99 de l'OMM. 143 pp.
- Huerta-Espino, J. & Roelfs, A.P. 1989. Spécialisation physiologique sur la rouille des feuilles du blé dur. Phytopathology, 79 : 1218 (abstr.).
- Hylander, N., Jorstad, I. & Nannfeldt, J.A. 1953. Enumeratio uredionearum Scandinavicarum. Opera Bot. 1 : 1-102.
- Johnson, R. 1981. Durable disease resistance. In J.F. Jenkyn & R.T. Plumb, eds. Strategies for control of cereal diseases, p. 55-63. Oxford, UK, Blackwell.
- Johnson, T. 1949. Croisements intervariétaux chez Puccinia graminis. Can. J. Res. Sect. C, 27 : 45-63.
- Joshi, L.M. & Palmer, L.T. 1973. Epidémiologie des rouilles des tiges, des feuilles et des stries du blé dans le nord de l'Inde. Plant Dis. Rep. 57 : 8-12.
- Katsuya, K. & Green, G.J. 1967. Potentiel de reproduction des races 15B et 56 de la rouille de la tige du blé. Can. J. Bot. 45 : 1077-1091.
- Kilpatrick, R.A. 1975. Nouveaux cultivars de blé et longévité de la résistance à la rouille, 1971-1975. USDA, Agric. Res. Serv. Northeast Reg (Rep.), ARS-NE 64. 20 pp.
- Le Roux, J. & Rijkenberg, F.H.J. 1987. Pathotypes de Puccinia graminis f. sp. tritici avec virulence accrue pour Sr24. Plant Dis, 71 : 1115-1119.
- Lewellen, R.T., Sharp, E.L. & Hehn, E.R. 1967. Gènes majeurs et mineurs du blé pour la résistance à Puccinia striiformis et leur réponse aux changements de température. Can. J. Bot. 45 : 2155-2172.
- Line, R.F. 1976. Facteurs contribuant à une épidémie de rouille jaune sur blé dans la vallée du Sacramento en Californie en 1974. Plant Dis. Rep. 60 : 312-316.
- Line, R.F., Qayoum, A. & Milus, E. 1983. Durable resistance to stripe rust of wheat. In Proc. 4th Int. Cong. Plant Pathol, p. 204. Melbourne.
- Luig, N.H. 1985. Epidemiology in Australia and New Zealand. In A.P. Roelfs & W.R. Bushnell, eds. Cereal rusts, vol. 2, Diseases, distribution, epidemiology, and control, p. 301-328. Orlando, FL, USA, Academic Press.
- Luig, N.H. & Rajaram, S. 1972. The effect of temperature and genetic background on host gene expression and interaction to Puccinia graminis tritici. Phytopathology, 62 : 1171-1174.
- Luig, N.H. & Watson, I.A. 1972. Le rôle des graminées sauvages et cultivées dans l'hybridation des formes spéciales de Puccinia graminis. Aust. J. Biol. Sci. 25 : 335-342.
- Maddison, A.C. & Manners, J.G. 1972. Sunlight and viability of cereal rust urediospores. Trans. Br. Mycol. Soc. 59 : 429-443.
- Mains, E.B. 1932. Host specialization in the leaf rust of grasses Puccinia rubigovera. Mich. Acad. Sci. 17 : 289-394.
- Mains, E.B. 1933. Etudes sur la rouille hétéroïque. Mycologia, 25 : 407-417.
- Mains, E.B. & Jackson, H.S. 1926. Spécialisation physiologique dans la rouille des feuilles du blé, Puccinia triticina Erikss. Phytopathology, 16 : 89-120.
- Manners, J.G. 1960. Puccinia striiformis Westend. var. dactylidis var. nov. Trans. Br. Mycol. Soc. 43 : 65-68.
- McIntosh, R.A. 1976. Génétique du blé et des rouilles du blé depuis Farrer : Farrer memorial oration 1976. J. Aust. Inst. Agric. Sci. 42 : 203-216.
- McIntosh, R.A. 1992. Close genetic linkage of genes conferring adult-plant resistance to leaf rust and stripe rust in wheat. Plant Pathol, 41 : 523-527.
- McIntosh, R.A., Luig, N.H., Milne, D.L. & Cusick, J. 1983. Vulnérabilité des triticales à la rouille de la tige du blé. Can. J. Plant Pathol. 5 : 61-69.
- McIntosh, R.A., Hart, G.E., Devos, K.M., Gale, M.D. & Rogers, W.J. 1998. Catalogue of gene symbols for wheat. In Proc. 9th Int. Wheat Genetics Symp. 2-7 août 1998. Saskatoon Saskatchewan, Canada.
- Melander, L.W. & Craigie, J.H. 1927. Nature de la résistance de Berberis spp. à Puccinia graminis. Phytopathology, 17 : 95-114.
- Mont, R.M. 1970. Études de la résistance non spécifique à la rouille de la tige chez le blé de printemps. Thèse de maîtrise. St Paul, MN, USA, Université du Minnesota. 61 p.
- Nagarajan, S. et Joshi, L.M. 1985. Epidemiology in the Indian subcontinent. In A.P. Roelfs & W.R. Bushnell, eds. The cereal rusts, vol. 2, Diseases, distribution, epidemiology, and control, p. 371-402. Orlando, FL, USA, Academic Press.
- O'Brien, L., Brown, J.S., Young, R.M. & Pascoe, T. 1980. Présence et répartition de la rouille jaune du blé dans l'Etat de Victoria et sensibilité des cultivars de blé commerciaux. Aust. Plant Pathol. Soc. Newsl. 9 : 14.
- Perez, B. & Roelfs, A.P. 1989. Résistance à la rouille des feuilles du blé des cultivars terrestres et de leurs dérivés. Phytopathology, 79 : 1183 (abstr.).
- Pretorius, Z.A., Singh, R.P., Wagoire, W.W. & Payne, T.S. 2000. Detection of virulence to wheat stem rust resistance gene Sr31 in Puccinia graminis f. sp. tritici in Uganda. Phytopathology, 84 : 203.
- Rajaram, S., Singh, R.P. & van Ginkel, M. 1996. Approaches to breed wheat for wide adaptation, rust resistance and drought. In R.A. Richards, C.W. Wrigley, H.M. Rawson, G.J. Rebetzke, J.L. Davidson & R.I.S. Brettell, eds. Proc. 8th Assembly Wheat Breeding Society of Australia, p. 2-30. Canberra, Université nationale australienne.
- Rapilly, F. 1979. Epidémiologie de la rouille jaune. Ann. Rev. phytopathol. 17 : 5973.
- Robbelen, G. & Sharp, E.L. 1978. Mode d'hérédité, interaction et application des gènes conditionnant la résistance à la rouille jaune. Fortschr. Pflanzenzucht. Beih. Z. Pflanzenzucht. 9 : 1-88.
- Roelfs, A.P. 1978. Estimation des pertes causées par la rouille dans les céréales à petits grains aux Etats-Unis 1918-1976. Misc. Publ. USDA, 1363 : 1-85.
Roelfs, A.P. 1982. Effets de l'éradication de l'épine-vinette sur la rouille des tiges aux Etats-Unis. Plant Dis, 66 : 177-181. - Roelfs, A.P. 1985a. Epidemiology in North America. In A.P. Roelfs & W.R. Bushnell, eds. The cereal rusts, vol. 2, Diseases, distribution, epidemiology, and control, p. 403-434. Orlando, FL, USA, Academic Press.
- Roelfs, A.P. 1985b. Wheat and rye stem rust. In A.P. Roelfs & W.R. Bushnell, eds. The cereal rusts, vol. 2, Diseases, distribution, epidemiology, and control, p. 3-37. Orlando, FL, USA, Academic Press.
- Roelfs, A.P. 1986. Development and impact of regional cereal rust epidemics. In K.J. Leonard & W.E. Fry, eds. Plant disease epidemiology, vol. 1, p. 129-150. New York, NY, USA, MacMillan.
- Roelfs, A.P. 1988. Contrôle génétique des phénotypes de la rouille de la tige du blé. Ann. Rev. Phytopathol. 26 : 351-367.
- Roelfs, A.P. & Groth, J.V. 1980. A comparison of virulence phenotypes in wheat stem rust populations reproducing sexually and asexually. Phytopathology, 70 : 855-862.
- Roelfs, A.P. & Groth, J.V. 1988. Puccinia graminis f. sp. tritici, black stem rust of Triticum spp. In G.S. Sidhu, ed. Advances in plant pathology, vol. 6, Genetics of pathogenic fungi, p. 345-361. Londres, Academic Press.
- Roelfs, A.P. & Long, D.L. 1987. Développement de Puccinia graminis en Amérique du Nord en 1986. Plant Dis, 71 : 1089-1093.
- Roelfs, A.P. & Martell, L.B. 1984. Ure-dospore dispersal from a point source within a wheat canopy. Phytopathology, 74 : 1262-1267.
- Roelfs, A.P., Huerta-Espino, J. & Marshall, D. 1992. Barley stripe rust in Texas. Plant Dis, 76 : 538.
- Rowell, J.B. 1981. Relation entre les événements de postpénétration dans les semis de blé Idaed 59 et la faible réceptivité à l'infection par Puccinia graminis f. sp. tritici. Phytopathology, 71 : 732-736.
- Rowell, J.B. 1982. Control of wheat stem rust by low receptivity to infection conditioned by a single dominant gene. Phytopathology, 72 : 297-299.
- Rowell, J.B. 1984. Infection contrôlée par Puccinia graminis f. sp. tritici en conditions artificielles. In. A.P. Roelfs & W.R. Bushnell, eds. The cereal rusts, vol. 1, Origins, specificity, structure, and physiology, p. 291-332. Orlando, FL, USA, Academic Press.
- Saari, E.E. & Prescott, J.M. 1985. World distribution in relation to economic losses. In A.P. Roelfs & W.R. Bushnell, eds. The cereal rusts, vol. 2, Diseases, distribution, epidemiology, and control, p. 259-298. Orlando, FL, USA, Academic Press.
Saari, E.E., Young, H.C., Jr. & Fernkamp, M.F. 1968. Infection de Thalictrum spp. nord-américaines par Puccinia recondita f. sp. tritici. Phytopathology, 58 : 939-943. - Samborski, D.J. 1985. Wheat leaf rust. In A.P. Roelfs et W.R. Bushnell, eds. The cereal rusts, vol. 2, Diseases, distribution, epidemiology, and control, p. 39-59. Orlando, FL, USA, Academic Press.
- Savile, D.B.O. 1984. Taxonomie des champignons de la rouille des céréales. In W.R. Bushnell & A.P. Roelfs, eds. The cereal rusts, vol. 1, Origins, specificity, structures, and physiology, p. 79-112. Orlando, FL, USA, Academic Press.
- Sharp, E.L. & Volin, R.B. 1970. Additive genes in wheat conditioning resistance to stripe rust. Phytopathology, 601 : 1146-1147.
- Singh, R.P. 1992. Genetic association of leaf rust resistance gene Lr34 with adult plant resistance to stripe rust in bread wheat. Phytopathology, 82 : 835-838.
- Singh, R.P. & Rajaram, S. 1992. Génétique de la résistance de la plante adulte à la rouille des feuilles chez "Frontana" et trois blés CIMMYT. Genome, 35 : 24-31.
- Singh, R.P. & Rajaram, S. 1994. Genetics of adult plant resistance to stripe rust in ten spring bread wheats. Euphytica, 72 : 1-7.
- Singh, R.P., Mujeeb-Kazi, A. & Huerta-Espino, J. 1998. Lr46 : A gene conferring slow-rusting resistance to leaf rust in wheat. Phytopathology, 88 : 890-894.
- Skovmand, B., Fox, P.N. & Villareal, R.L. 1984. Triticale in commercial agriculture : progress and promise. Adv. Agron. 37 : 1-45.
- Spehar, V. 1975. Epidémiologie de la rouille du blé en Europe. In Proc. 2nd Int. Winter Wheat Conf., 9-19 juin, p. 435-440. Zagreb, Yougoslavie.
- Stakman, E.C. 1923. Les maladies du blé. 14. Le problème de la rouille du blé aux Etats-Unis. In Proc. 1st Pan Pac. Sci. Congr. p. 88-96.
- Straib, W. 1937. Untersuchungen uben dasn Vorkommen physiologischen Rassen der Gelbrostes (Puccinia glumarum) in den Jahren 1935-1936 und uber die Agressivitat eninger neuer Formes auf Getreide un Grasern. Arb. Biol. Reichsant. Land. Fortw. Berlin-Dahlem, 22 : 91-119.
- Stubbs, R.W. 1985. Stripe rust. In A.P. Roelfs & W.R. Bushnell, eds. The cereal rusts, vol. 2, Diseases, distribution, epidemiology, and control, p. 61-101. Orlando, FL, USA, Academic Press.
- Stubbs, R.W. & de Bruin, T. 1970. Bestrijding van gele roest met het systemische fungicide oxycaroxin 'Plantvax'. Gewasbescherming, 1 : 99-104.
- Stubbs, R.W., Prescott, J.M., Saari, E.E. & Dubin, H.J. 1986. Manuel de méthodologie des maladies des céréales, p. 46. Mexique, DF, CIMMYT.
- Sunderwirth, S.D. & Roelfs, A.P. 1980. Greenhouse evaluation of the adult plant resistance of Sr2 to wheat stem rust. Phytopathology, 70 : 634-637.
- Tollenaar, H. & Houston, B.R. 1967. Etude de l'épidémiologie de la rouille jaune, Puccinia striiformis West en Californie. Can. J. Bot. 45 : 291-307.
- Tozzetti, G.T. 1952. V. Alimurgia : Nature réelle, causes et tristes effets des rouilles, des bunts, des smuts et autres maladies du blé et de l'avoine dans les champs. In L.R. Tehon, transl. Phytopathological Classics No. 9, p. 139. St Paul, MN, USA, American Phytopathol. Society. (Publié à l'origine en 1767).
- Tranzschel, W. 1934. Promezutocnye chozjaeva rzavwiny chlebov i ich der USSR. (Les hôtes alternatifs des champignons de la rouille des céréales et leur répartition en URSS). In Bull. Plant Prot., Ser. 2, p. 4-40. (En russe avec un résumé en allemand).
- Viennot-Bourgin, G. 1934. La rouille jaune der graminees. Ann. Ec. Natl. Agric. Grignon Ser., 3, 2 : 129-217.
- Wallwork, H. & Johnson, R. 1984. Séparation transgressive pour la résistance à la rouille jaune chez le blé. Euphytica, 33 : 123-132.
- Watson, I.A. & de Sousa, C.N.A. 1983. Long distance transport of spores of Puccinia graminis tritici in the Southern Hemisphere. In Proc. Linn. Soc. N.S.W., 106 : 311-321.
- Wright, R.G. & Lennard, J.H. 1980. Origine d'une nouvelle race de Puccinia striiformis. Trans. Br. Mycol. Soc. 74 : 283-287.
- Zadoks, J.C. 1961. La rouille jaune du blé : étude de l'épidémiologie et de la spécialisation physiologique. Neth. J. Plant Pathol. 67 : 69-256.
- Zadoks, J.C. & Bouwman, J.J. 1985. Epidemiology in Europe. In A.P. Roelfs & W.R. Bushnell, eds. The cereal rusts , vol. 2, Diseases, distribution, epidemiology, and control , p. 329-369. Orlando, FL, USA, Academic Press
Fusariose de l'épi
- Baht, C.V., Beedu, R., Ramakrishna, Y. & Munshi, R.L. 1989. Outbreak of trichothecene toxicosis associated with consumption of mould-damaged wheat products in Kashmir Valley, India. Lancet, p. 35-37.
- Bai, G. 1995. Scab of wheat : epidemiology, inheritance of resistance and molecular markers linked to cultivar resistance. Thèse de doctorat. West Lafayette, IN, USA, Purdue University.
- Chen, P., Liu, D. & Sun, W. 1997. New countermeasures of breeding wheat for scab resistance. In H.J. Dubin, L. Gilchrist, J. Reeves & A. McNab, eds. Fusarium head scab : global status and future prospects. Mexico, DF, CIMMYT.
- Diaz de Ackermann, M. & Kohli, M.M. 1997. Research on fusarium head blight of wheat in Uruguay. In H.J. Dubin, L. Gilchrist, J. Reeves & A. McNab, eds. Fusarium head scab : global status and future prospects. Mexico, DF, CIMMYT.
- Dill-Macky, R. 1997. Fusarium head blight : Recent epidemics and research efforts in the upper midwest of United States. In H.J. Dubin, L. Gilchrist, J. Reeves & A. McNab, eds. Fusarium head scab : global status and future prospects. Mexico, DF, CIMMYT.
- Dubin, H.J., Gilchrist, L., Reeves, J. & McNab ?, A. 1997. Fusarium head scab : global status and future prospects. Mexico, DF, CIMMYT.
- Galich, M.T.V. 1997. Fusarium head blight in Argentina. In H.J. Dubin, L. Gilchrist, J. Reeves & A. McNab, eds. Fusarium head scab : global status and future prospects. Mexico, DF, CIMMYT.
- Gilchrist, L., Rajaram, S., Mujeeb-Kazi ?, A., van Ginkel, M., Vivar, H. & Pfeiffer, W. 1997. In H.J. Dubin, L. Gilchrist, J. Reeves & A. McNab, eds. Fusarium head scab : global status and future prospects. Mexico, DF, CIMMYT.
- Ireta, J. 1989. Seleccion de un modelo de crecimiento para la fusariosis del trigo causada por Fusarium graminearum Schw. In M.M. Kohli, ed. Taller sobre la Fusariosis de la espiga en America del Sur. Mexico, DF, CIMMYT.
- Ireta, M.J. & Gilchrist, L. 1994. Fusarium head scab of wheat (Fusarium graminearum Schwabe). Rapport spécial sur le blé n° 21b. Mexico, DF, CIMMYT.
- Khonga, E.B. & Sutton, J.C. 1988. Production d'inoculum et survie de Giberella zeae dans les résidus de maïs et de blé. Can. J. Plant Pathol. 10(3) : 232-240.
- Luo, X.Y. 1988. Contamination par les toxines de Fusarium en Chine. Proc. Japan Assoc. Mycotoxicology Suppl. 1 : 97-98. Marasas, W.F.O., Jaskiewickz, K., Venter, F.S. & Schalkwyk, D.J. 1988. Fusarium moniliforme contamination of maize in oesophageal cancer areas in Transkei. S. AF. Med. J., 74 : 110-114.
- Mihuta-Grimm, L. & Foster, R.L. 1989. Scab on wheat and barley in southern Idaho and evaluation of seed treatment for eradication of Fusarium spp. Plant Dis, 73 : 769-771.
- Miller, J.D. & Armison, P.G. 1986. Dégradation du déoxynivalénol par des cultures en suspension du cultivar de blé Frontana, résistant à la fusariose de l'épi. Can. J. Plant Pathol. 8 : 147-150.
- Miller, J.D., Young, J.C. & Sampson, D.R. 1985. Deoxynivalenol and Fusarium head blight resistance in spring cereals. J. Phytopathol. 113 : 359-367.
- Reis, E.M. 1985. Doencas do trigo III. Fusariose. Brasil, Merck Sharp Dohme.
- Reis, E.M. 1989. Fusariosis : biologia y epidemiologia de Gibberella zeae en trigo. In M.M. Kohli, ed. Taller sobre la Fusariosis de la espiga en America del Sur. Mexico, DF, CIMMYT.
- Schroeder, H.W. & Christensen, J.J. 1963. Facteurs affectant la résistance du blé à la gale causée par Gibberella zeae. Phytopathology, 53 : 831-838.
- Snidjers, C.H.A. 1989. Situation actuelle de la sélection du blé pour la résistance à la fusariose de l'épi et le problème des mycotoxines aux Pays-Bas. Fondation pour l'amélioration des plantes agricoles, Wageningen. In M.M. Kohli, ed. Taller sobre la Fusariosis de la espiga en America del Sur. Mexico, DF, CIMMYT.
- Snijders, C.H.A. 1990. The inheritance of resistance to head blight caused by Fusarium culmorum in winter wheat Euphytica, 50 : 11-18.
- Teich, A.H. & Nelson, K. 1984. Survey of Fusarium head blight and possible effects of cultural practices in wheats fields in Lambton County in 1983. Can. Plant Dis. Surv. 64(1) : 11-13.
- Trenholm, H.L., Friend, D.H. & Hamilton, R.M.G. 1984. Vomitoxine et zéaralénone dans les aliments pour animaux. Publication d'Agriculture Canada 1745 E.
- Van Egmond, H.P. & Dekker, W.H. 1995. Réglementations mondiales pour les mycotoxines en 1994. Nat. Toxins, 3 : 332.
- Viedma, L. 1989. Importancia y distribucion de la fusariosis de trigo en Paraguay. In M.M. Kohli, ed. Taller sobre la Fusariosis de la espiga en America del Sur. Mexico, DF, CIMMYT.
- Wang, Y.Z. 1997. Epidemiology and management of wheat scab in China In H.J. Dubin, L. Gilchrist, J. Reeves & A. McNab, eds. Fusarium head scab : global status and future prospects. Mexico, DF, CIMMYT.
- Wang, Y.Z. & Miller, J.D. 1988. Effects of metabolites on wheat tissue in relation to Fusarium head blight resistance. J. Phytopathol. 122 : 118-125.
Fusariose de l'épi
- Infestation et élimination de Fusarium spp. dans la bière dans le cadre de l'ensemencement en Rhénanie, Lienemann, K.
- E.-C. Oerke et H.-W. Dehne
Effets de l'activité de l'eau, de la température et du pH sur la croissance des isolats de Fusarium moniliforme et de Fusarium proliferatum du maïs, Sonia Marin, Vicente Sanchis, et Naresh Magan - Interaction du Fusarium graminearum et du F. moniliforme dans les épis de maïs : progression de la maladie, biomasse fongique et accumulation de mycotoxines, L. M. Reid, R. W. Nicol, T. Ouellet, M. Savard, J. D. Miller, J. C. Young, D. W. Stewart, et A. W. Schaafsma
- Evaluierung von Einflussfaktoren auf den Fusarium-Ährenbefall des Weizens, Wolf, P. F. J. ; Schempp, H. ; Verreet, J.-A.
Septoria spp.
- Baker, C.J. 1971. Morphologie de l'infection des plantules par Leptosphaeria nodorum. Trans. Brit. Mycol. Soc. 56:306-309.
- Baker, C.J. 1969. Etudes sur Leptosphaeria nodorum Müller et Septoria tritici Desm. sur blé. Thèse de doctorat. Université d'Exeter.
- Baker E.A., et Smith, I.M. 1978. Développement des réactions résistantes et sensibles chez le blé lors de l'inoculation avec Septoria nodorum. Trans. Brit. Mycol. Soc. 71:475-482.
- Benedict, W.G. 1971. Effet différentiel de l'intensité lumineuse sur l'infection du blé par Septoria tritici Desm. dans des conditions environnementales contrôlées. Physiol. Pl. Pathol. 1:55-56.
- Bird, P.M., et Ride, J.P. 1981. The resistance of wheat to Septoria nodorum : fungal development in relation to host lignification. Physiol. Pl. Pathol. 19:289-299.
- Stagonospora et Septoria pathogènes des céréales : Le processus d'infection 45 Bethenod, O., Bousquet, J., Laffray, D., et Louguet, P. 1982. Reexamen des modalités d'action de l'ochracine sur la conductance stomatique des feuilles de plantules de blé, Triticum aestivum L., cv "Etoile de Choisy".Agronomie 2:99-102.
- Bousquet, J.F., et Kollman, A. 1998. Variation in metabolite production by Septoria nodorum isolates adapted to wheat or to barley. J. Phytopathol. 146:273-277.
- Bousquet, J.F., Belhomme de Franqueville, H., Kollmann, A., et Fritz, R. 1980. Action de la septorine, phytotoxine synthétisée par Septoria nodorum, sur la phosphorylation oxydative dans les mitochondries isolées de coléoptiles de blé. Can. J. Bot. 58:2575-2580.
- Brennan, R.M., Fitt, B.D.L., Colhoun, J., et Taylor, G.S. 1986. Facteurs affectant la germination des pycnidiospores de Septoria nodorum. J. Phytopathol. 117:49-53.
- Brönnimann, A., Sally, B.K., et Sharp, E.L. 1972. Investigations sur Septoria nodorum dans le blé de printemps au Montana. Plant Dis. Reptr. 56:188-191.
- Cohen, L., et Eyal, Z. 1993. The histology of processes associated with the infection of resistant and susceptible wheat cultivars with Septoria tritici. Plant Pathol. 42:737-743.
- Cunfer, B.M. 1983. Epidémiologie et lutte contre Septoria nodorum transmis par les semences. Seed Sci. Tecnol. 11:707- 718.
- Essad, S., et Bousquet, J.F. 1981. Action de l'ochracine, phytotoxine de Septoria nodorum Berk. sur le cycle mitotique de Triticum aestivum L. Agronomie 1:689-694.
- Eyal, Z., Scharen, A.L., Prescott, J.M., et van Ginkel, M. 1987. Les maladies à Septoria du blé : Concepts et méthodes de gestion des maladies. CIMMYT. Mexico D.F. 46 pp.
- Fernandes, J.M.C., et Hendrix, J.W. 1986a. Viabilité des conidies de Septoria nodorum exposées à des conditions naturelles dans l'Etat de Washington. Fitopathol. Bras. 11:705-710.
- Fernandes, J.M.C., et Hendrix, J.W. 1986b. Effets de l'humidité des feuilles et de la température sur la croissance des hyphes et le développement des symptômes sur les feuilles de blé infectées par Septoria nodorum. Fitopathol. Bras. 11:835-845.
- Fournet, J. 1969. Properiétés et rôle du cirrhe du Septoria nodorum Berk. Ann. Phytopathol. 1:87-94. Fournet, J., Pauvert, P., et Rapilly, F. 1970. Propriétés des gelées sporifères de quelques Sphaeropsidales et Melanconiales. Ann. Phytopathol. 2:31-41.
- Gough, F.J., et Lee, T.S. 1985. Moisture effects on the discharge and survival of conidia of Septoria tritici. Phytopathology 75:180-182.
- Green, G.J., et Dickson, J.G. 1957. Pathological histology and varietal reactions in Septoria leaf blotch of barley. Phytopathology 47:73-79.
- Griffiths, E., et Peverett, H. 1980. Effets de l'humidité et de l'extrait de cirrhus sur la survie des spores de Septoria nodorum. Trans. Brit. Mycol. Soc. 75:147-150.
- Harrower, K.M. 1976. Cirrus function in Leptosphaeria nodorum. APPS Newsletter 5:20-21.
- Hilu, H.M., et Bever, W.M. 1957. Inoculation, oversummering, and suscept-pathogen relationship of on Triticum species. Phytopathology 47:474-480.
- Holmes, S.J.I., et Colhoun, J. 1974. Infection du blé par Septoria nodorum et S. tritici. Trans. Brit. Mycol. Soc. 63:329-338.
- Jenkins, P.D. 1978. Interaction in cereal diseases. Thèse de doctorat. Université du Pays de Galles.
- Karjalainen, R., et Lounatmaa, K. 1986. Ultrastructure de la pénétration et de la colonisation des feuilles de blé par Septoria nodorum. Physiol. Mol. Pl. Pathol. 29:263-270.
- Kema, G.H.J., DaZhao, Y., Rijkenberg, F.H.J., Shaw, M.W., et Baayen, R.P. 1996. Histologie de la pathogenèse de Mycosphaerella graminicola dans le blé. Phytopathology 86:777-786.
- Keon, J.P.R., et Hargreaves, J.A. 1984. The response of barley leaf epidermal cells to infection by Septoria nodorum. New Phytol. 98:387-398.
- King, J.E., Cook, R.J., et Melville, S.C. 1983. A review of Septoriadiseases of wheat and barley. Ann.Appl. Biol. 103:345-373.
- Krupinsky, J.M., Scharen, A.L., et Schillinger, J.A. 1973. Variation des pathogènes de Septoria nodorum Berk. en relation avec la spécificité des organes, le taux de photosynthèse apparent et le rendement du blé. Physiol. Pl. Pathol. 3:187-194.
- Lehtinen, U. 1993. Enzymes de Septoria nodorum dégradant les parois cellulaires des plantes. Physiol. Mol. Pl. Pathol. 43:121-134.
- Magro, P. 1984. Production d'enzymes dégradant le polysacchride en culture et pendant la pathogenèse. Plant Sci. Letters 37:63-68.
- Morgan, W.M. 1974. Etudes physiologiques des maladies du blé causées par Septoria spp. et Fusarium culmorum. Thèse de doctorat. Université de Londres.
- O'Reilly, P., et Downes, M.J. 1986. Form of survival of Septoria nodorum on symptomeless winter wheat. Trans. Brit. Mycol. Soc. 86:381-385.
- Rapilly, F., Foucault, B., et Lacazedieux, J. 1973. Études sur l'inoculum de Septoria nodorum Berk. (Leptosphaeria nodorum Müller) agent de la septoriose du blé I. Les ascospores. Ann. Phytopathol. 5:131-141.
- Rasanayagam, M.S., Paul, N.D., Royle, D.J., et Ayres, P.G. 1995. Variation in responses of Septoria tritici and S. nodorum to UV-B irradiation in vitro. Mycol. Res. 99:1371-1377.
- Shipton, W.A., Boyd, W.R.J., Rosielle, A.A., et Shearer, B.L. 1971. The common Septoria diseases of wheat. Bot. Rev. 37:231-262.
- Straley, M. L. 1979. Pathogenèse de Septoria nodorum (Berk.) Berk. sur des cultivars de blé plus ou moins résistants à la tache des glumes. Thèse de doctorat. Montana State University. 99 p.
- Straley, M.L., et Scharen, A.L. 1979. Développement de Septoria nodorum dans des feuilles de blé résistantes et sensibles. Phytopathology 69:920-921.
- Weber, G.F. 1922. Septoria diseases of cereals. Phytopathology 12:537-585.
- Babadoost, M. & Herbert, T.T. 1984. Factors affecting infection of wheat seedlings by Septoria nodorum. Phytopathology, 74 : 592-595.
- Eyal, Z.E. 1981. Lutte intégrée contre les maladies à Septoria du blé. Plant Dis, 65 : 763-768.
- Eyal, Z., Sharen, A.L., Prescott, J.M. & van Ginkel, M. 1987. Les maladies à Septoria du blé : concepts et méthodes de gestion des maladies. Mexico, DF, CIMMYT.
- Polley, R.W. & Thomas, M.R. 1991. Enquêtes sur les maladies du blé en Angleterre et au Pays de Galles, 1976-1988. Ann. Appl. Biol. 119 : 1-20.
- Henze, Mathias : Entwicklung einer anbauparameter- und witterunsabhängigen Befallsprognose von Septoria tritici, CUVILLER VERLAG, Göttingen 2008
- B.M. Cunfer : Stagonospora et Septoria pathogènes des céréales : The Infection Process, in Septoria and Stagonospora Diseases of Cereals : A Compilation of Global Research, M. van Ginkel, A. McNab, et J. Krupinsky editors, Proceedings of the Fifth International Septoria Workshop September 20-24, 1999, CIMMYT, Mexico.
Équipement recommandé
Vérifiez quel jeu de capteurs est nécessaire pour surveiller les maladies potentielles de cette culture.