Tournesol modèles de maladies
Mildiou
Le champignon responsable du mildiou du tournesol est connu sous les noms de Plasmopara halstedii ou Plasmopara helianthi. Le complexe pathogène fongique infecte un large éventail de genres de la famille des Astéracées, y compris des espèces sauvages et cultivées de Helianthus. La maladie est présente partout où l'on cultive des tournesols.
Cycle de vie
À partir d'une seule oospore qui germe et donne naissance à un zoosporangium, la différenciation et la libération des zoospores sont les étapes ultérieures du développement. En présence d'eau libre, les zoospores se déplacent rapidement vers les sites d'infection (racine, hypocotyle) s'ils sont disponibles. Après l'enkystement et l'élongation du tube germinatif (ce dernier se termine généralement par un appressorium contre une cellule hôte), le champignon développe une structure d'infection (cheville d'infection) pour une pénétration directe. Dans des conditions expérimentales, il a été démontré que les tubes germinatifs ne forment généralement pas d'appressoria dans l'eau mais qu'ils le font en présence de cellules hôtes (Gray et al., 1985). Après la pénétration, le champignon se développe de manière intracellulaire puis intercellulaire, et une fois établi dans un hôte sensible (compatible), il commence à coloniser toute la plante de manière systémique en se développant de préférence vers l'apex de la pousse et, dans une moindre mesure, en direction de la racine. Lorsque les conditions sont favorables, une sporulation asexuée a lieu sur les feuilles affectées et occasionnellement sur les tissus souterrains. Les sporanges complètement développés sont disséminés par le vent et, comme ils ont une courte durée de vie et sont sensibles à la sécheresse et à l'ensoleillement direct, leur survie dépend de la situation météorologique du moment. Des oospores sont également produites dans les parties infectées de la plante, principalement dans les tissus des racines et du bas de la tige, alors que les feuilles et les parties supérieures de la plante, à l'exception des graines, sont exemptes de ces spores au repos (Sackston, 1981 ; Virányi, 1988 ; Onan et Onogur, 1991). Le stade le plus sensible du développement de l'hôte se situe entre la germination et l'émergence (Meliala et al. 2000).
Survie et source de l'inoculum
En ce qui concerne l'infection primaire, P. halstedii est un pathogène du sol. Ses oospores servent d'inoculum primaire aux tissus souterrains des jeunes plantules de tournesol. Il peut également être transmis par le vent, provoquant une infection secondaire des feuilles et/ou des inflorescences. Dans ce dernier cas, le champignon peut également être transmis par les semences : les graines affectées portent le mycélium et/ou les oospores à l'intérieur. Les oospores se développent principalement dans les tissus des racines et des tiges inférieures des plantes atteintes de mildiou, avec ou sans symptômes visibles et, avec les résidus végétaux de la culture de tournesol précédente, elles arrivent dans le sol. Les oospores ont une longue durée de vie et sont capables de survivre pendant au moins 6-8 ans (Sackston, 1981 ; Virányi, 1988). On pense généralement que les oospores germent principalement dans des conditions humides. Cependant, seuls quelques résultats sur la dynamique de la germination ont été disponibles jusqu'à présent. On a montré qu'un choc à basse température avant l'humidité et la présence d'exsudats de l'hôte libérés par les racines favorisaient le processus de germination (Delanoe, 1972). Dans un autre rapport (Spring & Zipper, 2000), aucun effet de température n'a pu être observé et les oospores fraîchement développées germent spontanément dans l'eau dans un délai de 10 à 30 jours, mais à un taux très variable (1-17%).
Cependant, l'infection secondaire est considérée comme un facteur important dans la propagation de la maladie dans certaines régions dans des conditions environnementales favorables. Outre le fait que l'infection secondaire de l'inflorescence peut donner lieu à une infection latente des semences par P. halstedii (Sackston, 1981), à partir de lésions foliaires locales, le champignon est capable de progresser et de se développer dans la tige en provoquant une infection systémique (Spring 2001).
Épidémiologie
La nature de l'inoculum (oospore ou zoospore), les variables climatiques (humidité relative, température), le site d'infection (âge des tissus), ainsi que la réaction du cultivar sont des facteurs qui influencent ou déterminent le processus d'infection, l'incidence de la maladie et sa gravité. Les zoospores, issues de la sporulation sexuée ou asexuée, ont besoin d'eau libre pour conserver leur viabilité et leur capacité à se déplacer vers les sites d'infection. Par conséquent, des pluies ou une irrigation intensive sont une condition préalable à l'initiation de l'infection. Plusieurs études ont montré que s'il y avait suffisamment de pluie ou un apport d'eau correspondant pendant les deux premières semaines après le semis, l'incidence de l'infection primaire à partir du sol augmentait. Cependant, la durée qui favorise l'infection est relativement courte et même les tournesols sensibles deviennent résistants avec l'âge (Sackston, 1981). Tourvieille et al. (2008a) ont constaté que le risque d'attaque par le mildiou semblait plus important en cas de fortes pluies lorsque les plantules de tournesol étaient à leur stade le plus sensible, alors que de fortes pluies avant le semis ou après la levée n'avaient aucun effet sur le pourcentage de plantes malades. Göre (2009) que la basse température et les pluies de printemps étendues dans environ 85% perte de rendement et la qualité inférieure de la production de tournesol dans la région de Marmara de Trace. Outre les conditions environnementales, l'intensité de la maladie peut également être influencée par l'agressivité de la population de pathogènes. Sakr et al. (2009) ont pu différencier les deux souches de pathogènes en termes d'agressivité en se basant sur la période de latence de la population et la densité de sporulation.
Aspects liés aux semences
P. halstedii a été trouvé dans des graines de tournesol provenant de plantes naturellement infectées, sous forme de mycélium ou d'oospores (Novotel'nova, 1966). Doken (1989) a signalé que le mycélium ne se trouvait que dans la testa et dans la couche interne du péricarpe ; il était absent de l'embryon. A la suite d'une inoculation artificielle, Cohen et Sackston (1973) ont confirmé que les bourgeons de tournesol inoculés de P. halstedii ont été infectés de manière systémique et ont produit des graines infectées. Des oospores ont été observées dans les semences de plantes inoculées et naturellement infectées au champ. D'autres signalements d'infection des semences sont connus en Iran (Zad, 1978), Turquie (Döken, 1989) et Allemagne (Spring, 2001). Le champignon envahit généralement l'ovaire et le péricarpe mais ne parvient pas à se développer dans l'embryon (Novotel'nova, 1966 ; Döken, 1989). L'infection des semences se produit régulièrement chez les plantes infectées de manière systémique si elles survivent jusqu'au stade de la floraison. Dans ce cas, le développement de l'embryon est souvent retardé ou inhibé. De plus, ces plantes sont naines et ne seront que rarement récoltées. Elles peuvent augmenter le stock local d'oospores dans un champ, mais pour la dispersion du pathogène sur de longues distances à partir des graines, elles semblent moins importantes que les graines de plantes sans symptômes infectées tardivement (Spring, 2001). Ce dernier type d'infection est très dépendant des conditions météorologiques pendant le processus de floraison. Ainsi, lors des années sèches, le nombre de semences contaminées par le pathogène est très faible et peut ne pas dépasser plusieurs sur mille, mais il peut être beaucoup plus élevé après une période fraîche et humide en juin/juillet. Par exemple, Spring (2001) a trouvé que près de 10% de graines provenant d'un champ en Allemagne étaient contaminées et Döken (1989), dans des conditions expérimentales favorables, a observé des structures fongiques dans 28% des graines examinées.
Effet sur la qualité des semences
Les graines de tournesol produites dans des plantes atteintes de mildiou sont soit sous-développées, soit incolores, soit, rarement, d'apparence saine. Même dans ce dernier cas, ces graines infectées sont de mauvaise qualité ; elles produisent des plantules anormales et le taux de germination est faible (Döken, 1989).
Pour de plus amples informations, veuillez consulter la page d'accueil du site de la Commission européenne. CABI.
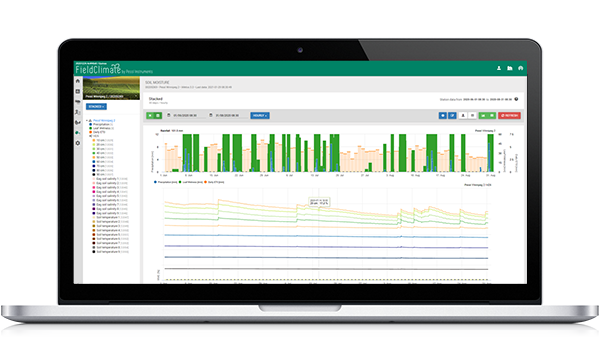
Modèle en FieldClimate
Capteurs utilisés : température du sol, précipitations, humidité des feuilles, température de l'air et humidité relative.
Nous commençons à calculer la progression de l'infection lorsque la température se situe entre 6 et 32°C avec un optimum de 18 à 24°C et que la température du sol est supérieure à 10°C. Plus loin, les conditions humides sont favorables à la maladie (événement pluvieux, humidité relative supérieure à 70%).
Les makrosporanges se forment à des températures du sol supérieures à 10°C et à des précipitations (humidité relative supérieure à 70%). Il y a remise à zéro si l'humidité relative descend en dessous de 50%.
Si les Makrosporangia sont complètement développés - les calculs pour une infection du sol ou une infection de l'air (dans le graphique appelé infection primaire) commencent (dans des conditions d'humidité des feuilles).
Les sporanges se forment dans des conditions humides (plus de 95% h.r.), dans l'obscurité et à des températures supérieures à 12°C. La réinitialisation a lieu pendant la journée et lorsque les sporanges ne sont pas complètement développés.
Si les sporanges sont complètement développés, le calcul de l'infection secondaire commence en fonction de la température de l'air.
Dans le graphique, vous voyez à la fin du mois d'avril une période humide de longue durée, qui a conduit à la formation de macrospores et à une infection du sol (infection primaire des racines). Une infection de l'air (appelée ici infection primaire) n'a pas été déterminée le premier mai, mais les conditions ayant été favorables, elle a été déterminée le 2 mai. Si les semis de tournesol sont à un stade sensible à ce moment-là (juste semés), des mesures de contrôle doivent être prises en compte (fongicides systémiques prophylactiques, principalement des acides phosphoriques).
Références :
- Achbani EH, Lamrhari A, Serrhini MN, Douira A, Tourvieille de Labrouche D, 1999. Evaluation de l'efficacité des traitements de semences contre Plasmopara halstedii. Bulletin OEPP, 29(4):443-449 ; 15 ref.
- Achbani EH, Tourvieille D, 1993. Le tournesol au Maroc. Phytoma, 448:30-32.
- Agrawal SC, Gupta RK, Prasad KVV, 1991. Un cas de mildiou du tournesol dans le Madhya Pradesh. Journal of Oilseeds Research, 8(1):126
- Albourie JM, Tourvieille J, Labrouhe DTde, 1998. Résistance au métalaxyl dans les isolats de l'agent pathogène du tournesol Plasmopara halstedii. European Journal of Plant Pathology, 104(3):235-242 ; 27 ref.
- Albourie JM, Tourvieille J, Tourvieille de Labrouhe D, 1998. Résistance au métalaxyl dans les isolats français du mildiou. In : Gulya T, ed. Vear F, ed. Proc. Third Sunflower Downy Mildew Symposium, Fargo, USA : ISA, 235-242.
- Bán R, Kovács A, Körösi K, Perczel M, Turóczi G, 2014. Premier rapport sur l'occurrence d'un nouveau pathotype, 714, de Plasmopara halstedii (mildiou du tournesol) en Hongrie. Plant Disease, 98(11):1580-1581.
- Bán R, Kovács A, Perczel M, Körösi K, Turóczi G, 2014. Premier rapport sur la distribution accrue du pathotype 704 de Plasmopara halstedii en Hongrie. Plant Disease, 98(6):844.
- Batinica J, Bes A, Dimic N, Numic R, Radman L, Ristanovic M, Vaclav V, 1973. Une contribution à la connaissance de la faune nuisible et des causes des maladies du tournesol dans la zone de sa culture en république de Bosnie-Herzégovine. Radovi Poljoprivrednog Fakulteta Univerziteta u Sarajevu, 21/22(24/25):203-210
- Berlese AN, De-Toni JB, 1888. Phycomycetteae. In : Sylloge fungorum, VII:242.
- Bohár G, Vajna L, 1996. Occurrence of microscopic fungi pathogenic to Ambrosia artemisifolia var. elatior (L.) Descourt. in Hungary. Növényvédelem, 32:527-528.
- Borovkov AY, McClean PE, 1993. Une séquence répétée en tandem du génome de Plasmopara halstedii. Gene, 124(1):127-130
- Borovkova IG, Borovkov AY, McClean PE, Gulya TJ, Vick BA, 1992. Restriction fragment length polymorphisms and RAPD markers in DNA of Plasmopara halstedii, the downy mildew fungus of sunflower. Actes de la 13e Conférence internationale sur le tournesol Volume 2, Pise, Italie, 7-11 septembre 1992, 1420-1425 ; 9 ref.
- Bouterige S, Robert R, Bouchara JP, Marot-Leblond A, Molinero V, Senet JM, 2000. Production et caractérisation de deux anticorps monoclonaux spécifiques de Plasmopara halstedii. Applied and Environmental Microbiology, 66(8):3277-3282 ; 33 ref.
- Bouterige S, Robert S, Marot-Leblond A, Senet JM, 2000. Développement d'un test ELISA pour détecter les antigènes de Plasmopara halstedii dans les semences. In : Proc. 15th Int. Sunflower Conference Toulouse, France : ISA (F):44-49.
- CABI/EPPO, 1998. Cartes de répartition des organismes de quarantaine pour l'Europe (édité par Smith, I. M. et Charles, L. M. F.). Wallingford, UK : CAB International, xviii + 768 pp.
- CABI/EPPO, 2014. Plasmopara halstedii. Carte de distribution. Cartes de distribution des maladies des plantes, n° octobre. Wallingford, UK : CABI, Carte 286 (Edition 6).
- Choi YJ, Park MJ, Shin HD, 2009. First Korean report of downy mildew on Coreopsis lanceolata caused by Plasmopara halstedii. Plant Pathology, 58(6):1171.
- CMI, 1988. Cartes de répartition des maladies des plantes. Carte n° 286. Wallingford, UK : CAB International.
- Cohen Y, Sackson WE, 1974. Infection des semences et infection latente du tournesol par Plasmopara halstedii. Journal canadien de botanique, 52:231-238.
- Delanoë D, 1972. Biologie et épidémiologie du mildiou du tournesol (Plasmopara helianthi Novot.). CETIOM Informations Techniques, 29:1-49.
- Delen N, Onogur E, Yildiz M, 1985. Niveaux de sensibilité au métalaxyl chez six isolats de Plasmopara helianthi Novot. Journal of Turkish Phytopathology, 14(1):31-36.
- Delos M, Penaud A, Lafon S, Walser P, De Guenin MC, Tourvieille J, Molinero V, Tourvieille D, 1997. Le mildiou de tournesol - Une maladie toujours d'actualité. Phytoma, 495á:15-16.
- Doken MT, 1989. Plasmopara halstedii (Farl.) Berl. et de Toni dans les graines de tournesol et le rôle des graines infectées dans la production de plantes présentant des symptômes systémiques. Journal of Phytopathology, 124(1-4):23-26
- Duarte LL, Choi YJ, Barreto RW, 2013. Premier signalement du mildiou causé par Plasmopara halstedii sur Gerbera jamesonii au Brésil. Plant Disease, 97(10):1382.
- OEPP, 2014. Base de données PQR. Paris, France : Organisation européenne et méditerranéenne pour la protection des plantes.
- Organisation européenne et méditerranéenne pour la protection des plantes, 2008. Plasmopara halstedii. Bulletin OEPP/EPPO Bulletin, 38(3):343-348.
- Garcia GM, Gulya TJ, 1991. Distribution des races de mildiou du tournesol dans le Dakota du Nord et le Minnesota. Dans : Proceedings of the 1991 Sunflower Research Workshop, Fargo, USA : National Sunflower Association, 3-5.
- Giresse X, Labrouhe DTDe , Richard-Cervera S, 2007. Douze marqueurs polymorphes dérivés d'étiquettes de séquences exprimées pour Plasmopara halstedii, l'agent causal du mildiou du tournesol, 7:1363-1365.
- Göre ME, 2009. Epidemic outbreaks of downy mildew caused by Plasmopara halstedii on sunflower in Thrace, part of the Marmara region of Turkey. Plant Pathology, 58(2):396.
- Gray AB, Sackston WE, Thauvette L, 1985. Le développement des structures d'infection de Plasmopara halstedii dans des suspensions de cellules de tournesol. Journal canadien de botanique, 63(10):1817-1819
- Gray B, Sackston WE, 1983. Études de cultures de tissus et de cultures cellulaires de tournesol inoculées avec Plasmopara halstedii. Journal canadien de phytopathologie, 5:206.
- Greathead DJ, Greathead AH, 1992. Lutte biologique contre les insectes nuisibles par les insectes parasitoïdes et prédateurs : la base de données BIOCAT. Biocontrol News and Information, 13(4):61N-68N.
- Gullino ML, Garibaldi A, 1988. Maladies cryptogamiques des principales plantes à fleurs cultivées en pot. Panorama Floricolo, 13(5):4-8.
- Gulya TJ, 1995. Une méthode simple pour évaluer la réponse des racines des lignées de tournesol "résistantes" au mildiou. Dans : Proceedings of the 17th Sunflower Research Workshop, Fargo, USA : National Sunflower Association, 63-66.
- Gulya TJ, 1995. Proposition d'un système révisé de classification des races de mildiou du tournesol. In : Proceedings of the 17th Sunflower Research Workshop, Fargo, USA : National Sunflower Association, 76-78.
- Gulya TJ, 1996. Les maladies du tournesol dans les Grandes Plaines du Nord. In : Proceedings of the 18th Sunflower Research Workshop, Fargo, USA : National Sunflower Association, 24-27.
- Gulya TJ, 2000. Résistance au métalaxyl du mildiou du tournesol et lutte par la génétique et les fongicides alternatifs. In : Proc. 15th Int. Sunflower Conference Toulouse, France : ISA (G):16-21.
- Gulya TJ, 2007. Distribution des races de Plasmopara halstedii du tournesol dans le monde, 3:121-134.
- Gulya TJ, Rashid KY, Masirevic SM, 1997. Maladies du tournesol. In : Schneiter AA, ed. Technologie et production du tournesol. Numéro 35 dans la série Agronomy. Wisconsin, USA : Amer. Soc. Agronomy, 263-379.
- Gulya TJ, Sackston WE, Viranyi F, Masirevic S, Rashid KY, 1991. New races of the sunflower downy mildew pathogen (Plasmopara halstedii) in Europe and North and South America. Journal of Phytopathology, 132(4):303-311.
- Gulya TJ, Tourvieille de Labrouhe D, Masirevic S, Penaud A, Rashid K, Viranyi F, 1998. Proposition de nomenclature standardisée et d'identification des races de Plasmopara halstedii (mildiou du tournesol). In : Gulya T, ed. Vear F, ed. Third Sunflower Downy Mildew Symposium. Fargo, USA : ISA, 130-136.
- Gulya TJ, Virányi F, Nowell D, Serrhini MN, Arouay K, 1996. Nouvelles races de mildiou du tournesol en Europe et en Afrique. In : Proceedings of the 18th Sunflower Research Workshop, Fargo, USA : National Sunflower Association, 181-184.
- Gulya TJ, Woods DM, Bell R, Mancl MK, 1991. Maladies du tournesol en Californie. Plant Disease, 75(6):572-574
- Hall G, 1989. Unusual or interesting records of plant pathogenic Oomycetes. Plant Pathology, 38(4):604-611.
- Harmon PF, Dunkle LD, Latin R, 2003. Une méthode rapide basée sur la PCR pour la détection de Magnaporthe oryzae à partir de ray-grass pérennes infectés. Plant Disease, 87(9):1072-1076.
- Heller A, Rozynek B, Spring O, 1997. Raisons cytologiques et physiologiques du type d'infection latente du tournesol causée par Plasmopara halstedii. Journal of Phytopathology, 145(10):441-445 ; 15 ref.
- Henning AA, Franca Neto JB, 1985. Race physiologique et sources de résistance au mildiou (Plasmopara halstedii (Farl.) Berlese et de Toni) au Brésil. Dans : Actes de la 11e Conférence internationale sur le tournesol, Mar del Plata, Argentine : Volume 2, 407-409.
- Hong CX, 2006. Downy mildew of Rudbeckia fulgida cv. Goldsturm by Plasmopara halstedii in Virginia. Plant Disease, 90(11):1461. HTTP://www.apsnet.org
- Hua Z, Ma G, 1996. Une revue de la recherche sur les maladies du tournesol en Chine. In : Actes de la 14e Conférence internationale sur le tournesol, Beijing, Chine : ISC-LAAS, 754-759.
- Intelmann F, Spring O, 2002. Analyse de l'ADN total par des amorces minisatellites et des amorces répétées à séquence simple pour l'utilisation d'études de population chez Plasmopara halstedii. Canadian Journal of Microbiology, 48(6):555-559 ; 25 ref.
- IPPC, 2010. Première découverte de Plasmopara halstedii au Royaume-Uni. Rapport officiel de la CIPV sur les organismes nuisibles, No. GBR-23/1. Rome, Italie : FAO.
- Jardine DJ, Gulya TJ, 1994. Premier rapport sur le mildiou du tournesol causé par Plasmopara halstedii au Kansas. Plant Disease, 78(2):208
- Kinga R, Bíró J, Kovács A, Mihalovics M, Nébli L, Piszker Z, Treitz M, Végh B, Csikász T, 2011. Apparition d'une nouvelle race de mildiou du tournesol dans la région sud-est de la Grande Plaine hongroise. (Újabb napraforgó-peronoszpóra rassz megjelenése Magyarországon, a Dél-kelet Alföldi régióban). Növényvédelem, 47(7):279-286.
- Kola K, 1980. Etude comparative des variétés de tournesol pour évaluer leur résistance aux maladies fongiques dans la région de Zadrima. Buletini i Shkencave Bujqesore, 19:87-94.
- Komjáti H, Walcz I, Virányi F, Zipper R, Thines M, Spring O, 2007. Caractéristiques d'un isolat de Plasmopara angustiterminalis provenant de Xanthium strumarium. European Journal of Plant Pathology, 119(4):421-428.
- Kucmierz J, 1976. Plasmopara helianthi Novot. une nouvelle espèce de champignon pour la Pologne. Fragmenta Floristica et Geobotanica, 22(3):373-375.
- Labrouhe DDe , Walser P, Serre F, Roche S, Vear F, 2008. Relations entre les précipitations printanières et l'infection du tournesol par Plasmopara halstedii (mildiou). Cordoue, Espagne, 8-12 juin 2008. In : Proceedings of the 17th International Sunflower Conference Vol ed. by Velasco, L.. Saville, Espagne : Conseil de l'agriculture et de la pêche, 97-102.
- Lafon S, Penaud A, Walser P, De Guenin M-Ch, Molinero V, Mestres R, Tourvieille D, 1996. Le mildiou du tournesol toujour sous surveillance. Phytoma, 484:35-36.
- Leite RMVBde C, Henning AA, Rodrigues SR, Oliveira MFde, 2007. Detection and variability of Plasmopara halstedii in Brazil and resistance of sunflower genotypes to downy mildew (Detecção e variabilidade de Plasmopara halstedii no Brasil e avaliação da resistência de genótipos de girassol ao míldio). Summa Phytopathologica, 33(4):335-340.
- Leppik EE, 1966. Origine et spécialisation du complexe Plasmopara halstedii dans les Compositae. Bulletin de la protection des végétaux de la FAO, 14:72-76.
- Liese AR, Gotlieb AR, Sackston WE, 1982. Use of enzyme-linked immunosorbent assay (ELISA) for the detection of downy mildew (Plasmopara halstedii) in sunflower. Dans : Proceedings of the 10th International Sunflower Conference, Surfers Paradise, Australia, 173-175.
- Ljubich A, Gulya TJ, 1988. Infection systémique du mildiou limitée au cotylédon. In : Proceedings of the 1988 Sunflower Research Workshop, Bismarck, USA : National Sunflower Association, 9.
- Masirevic S, 1992. Races de mildiou (Plasmopara halstedii) sur tournesol présentes dans notre région et dans le monde. Zbornik Radova, 20:405-408.
- Mayee CD, Patil MA, 1987. Downy mildew of sunflower in India. Gestion des ravageurs tropicaux, 33(1):81-82
- Melero-Vara JM, Garcia-Baudin C, Lopez-Herrera CJ, Jimenez-Diaz RM, 1982. Contrôle du mildiou du tournesol avec le métalaxyl. Plant Disease, 66(2):132-135
- Melero-Vara JM, Molinero Luiz L, Merino A, Dominguez J, 1996. Razas de Plasmopara halstedii presentes en Espana y evaluacion de susceptibilidad en hibridos comerciales. In : Actes du Symposium ISA I, Disease Tolerance in Sunflower, Beijing, Chine : International Sunflower Association, 7-13.
- Meliala C, Vear F, Labrouhe DTde, 2000. Relation entre la date d'infection du mildiou du tournesol (Plasmopara halstedii) et le développement des symptômes. Helia, 23(32):35-44.
- Molinero-Ruiz ML, Domfnguez J, Melero-Vara JM, 2002. Races d'isolats de Plasmopara halstedii d'Espagne et études sur leur virulence. Plant Disease, 86(7):736-740 ; 28 ref.
- Moses GJ, 1989. Nouvelle apparition du mildiou du tournesol dans l'Andhra Pradesh. Journal of Research APAU, 17(1):73
- Nandeeshkumar P, Ramachandra K, Prakash HS, Niranjana SR, Shetty H, 2008. Induction de la résistance au mildiou sur le tournesol par les rhizobactéries, 3(4):255-262.
- Nandeeshkumar P, Sarosh BR, Kini KR, Prakash HS, Shetty HS, 2009. Elicitation de la résistance et des protéines liées à la défense par l'acide bêta-amino butyrique chez le tournesol contre le pathogène du mildiou Plasmopara halstedii. Archives of Phytopathology and Plant Protection, 42(11):1020-1032.
- Nandeeshkumar P, Sudisha J, Ramachandra KK, Prakash HS, Niranjana SR, Shekar SH, 2008. Résistance induite par le chitosan au mildiou du tournesol causé par Plasmopara halstedii. PMPP Physiological and Molecular Plant Pathology, 72(4/6):188-194.
- Nikolov G, 1981. Apron 35 SD, une préparation efficace dans la lutte contre le mildiou du tournesol. Rastitelna Zashchita, 29(3):40-41
- Nishimura M, 1922. Études sur Plasmopara halstedii. J. Coll. Agric, 3(XI):185-210.
- Novotel'nova NS, 1966. Mildiou du tournesol. Moscou, URSS : Nauka.
- Onan E, Onogur E, 1989. Mildiou du tournesol (Plasmopara helianthi Novot.). Ege Universitesi Ziraat Fakultesi Dergisi, 26(1):271-286.
- Onan E, Onogur E, 1991. Etudes sur la relation entre l'hôte et le pathogène du mildiou du tournesol (Plasmopara helianthi Novot.). Journal of Turkish Phytopathology, 20(1):1-10.
- Oros G, Viranyi F, 1987. Évaluation en serre de fongicides pour la lutte contre le mildiou du tournesol (Plasmopara halstedii). Annales de Biologie Appliquée, 110(1):53-63
- Patil MA, Mayee CD, 1988. Investigations sur le mildiou du tournesol en Inde. Dans : Actes de la 12e Conférence internationale sur le tournesol, Novi Sad, Yougoslavie : 2:42.
- Patil MA, Phad HB, Ramtirthkar MS, 1993. Occurrence et distribution du mildiou du tournesol récemment introduit dans le Maharashtra. Journal of Maharashtra Agricultural Universities, 18(1):129-130.
- Rahmani Y, Madjidieh-Ghassemi S, 1975. Recherche sur la résistance relative de différentes variétés et lignées consanguines de tournesol au mildiou Plasmopara helianthi Novt. en serre et dans l'essai expérimental au champ, 1973. Iranian Journal of Plant Pathology, 11(3/4):96-104 ; 42-45.
- Rashid KY, 1991. Le mildiou du tournesol au Manitoba. Dans : Proceedings of the Sunflower Research Workshop, Fargo, USA : National Sunflower Association, 12.
- Rashid KY, 1993. Incidence et virulence de Plasmopara halstedii sur le tournesol dans l'ouest du Canada en 1988-1991. Journal canadien de phytopathologie, 15(3):206-210.
- Rivera Y, Rane K, Crouch JA, 2014. Premier rapport de downy mildw causé par Plasmopara halstedii sur black-eyed Susan (Rudbeckia fulgida cv. 'Goldsturm') dans le Maryland. Plant Disease, 98(7):1005-1006.
- Roeckel-Drevet P, Coelho V, Tourvieille J, Nicolas P, Labrouhe DTde, 1997. Absence de variabilité génétique dans les races françaises identifiées de Plasmopara halstedii, la cause du mildiou du tournesol Helianthus annuus. Canadian Journal of Microbiology, 43(3):260-263 ; 23 ref.
- Roeckel-Drevet P, Tourvieille J, Drevet JR, Says-Lesage V, Nicolas P, Labrouhe DTde, 1999. Développement d'un test de diagnostic par réaction en chaîne par polymérase pour la détection de l'agent pathogène biotrophe Plasmopara halstedii dans le tournesol. Canadian Journal of Microbiology, 45(9):797-803 ; 27 ref.
- Rozynek B, Spring O, 2000. Pathotypes du mildiou du tournesol dans le sud de l'Allemagne. Helia, 23(32):27-34 ; 18 ref.
- Rozynek B, Spring O, 2001. Leaf disc inoculation, a fast and precise test for the screening of metalaxyl tolerance in sunflower downy mildew. Journal of Phytopathology, 149(6):309-312 ; 17 ref.
- Ruiz MLM, Dominguez J, Vara JMM, Gulya TJ, 2000. Tolérance au métalaxyl dans les isolats espagnols de Plasmopara halstedii. In : Proc. 15th Int. Sunflower Conference Toulouse, France : ISA, (G):11-15.
- Sackston WE, 1981. Mildiou du tournesol. Dans : Spencer DE, ed. The Downy Mildews. Londres, UK : Academic Press, 545-575.
- Sackston WE, 1992. On a treadmill : breeding sunflowers for resistance to disease. Annual Review of Phytopathology, 30:529-551 ; 123 ref.
- Sackston WE, Anas O, Paulitz T, 1992. Lutte biologique contre le mildiou du tournesol. In : Abstracts of the American Phytopathological Society North-East Division Meeting, Portland, USA : 33.
- Sakr N, Ducher M, Tourvieille J, Walser P, Vear F, Labrouhe DTde, 2009. Une méthode pour mesurer l'agressivité de Plasmopara halstedii (mildiou du tournesol). Journal of Phytopathology, 157(2):133-136.
- Says-Lesage V, Meliala C, Nicolas P, Roeckel-Drevet P, Tourvieille de Labrouhe D, Archambault D, Billaud F, 2001. Test moléculaire pour mettre en évidence la présence de mildiou (Plasmopara halstedii) dans les graines de tournesol. OCL - Ole^acute~agineux, Corps Gras, Lipides, 8(3):258-260 ; 5 ref.
- Schuck E, Jobim CIP, 1988. Maladies du tournesol (Helianthus annuus L.) à Viamao et Santo Augusto, Rio Grande do Sul. Agronomia Sulriograndense, 24(2):221-232 ; 12 ref.
- Simay EI, 1993. Incidence de microfongi rares observés dans les zones Budateteny et Cinkota de Budapest. Mikologiai Kozlemenyek, 32(1-2):81-89
- Skoric D, 1994. Sélection du tournesol pour la résistance aux maladies dominantes. In : Proceedings of the EUCARPIA Oil and Protein Crops Section, Symposium on Breeding of Oil and Protein Crops, Albena, Bulgaria, 30-48.
- Spring O, 2000. Reproduction sexuelle homothallique chez Plasmopara halstedii, le mildiou du tournesol. Helia, 23(32):19-26 ; 13 ref.
- Spring O, 2001. Nonsystemic infections of sunflower with Plasmopara halstedii and their putative role in the distribution of the pathogen. Journal of Plant Diseases and Protection, 108:329-336.
- Spring O, Benz A, Faust V, 1991. Impact de l'infection par le mildiou (Plasmopara halstedii) sur le développement et le métabolisme du tournesol. Zeitschrift fur Pflanzenkrankheiten und Pflanzenschutz, 98(6):597-604.
- Spring O, Haas K, 2002. La composition en acides gras de Plasmopara halstedii et sa signification taxonomique. European Journal of Plant Pathology, 108(3):263-267 ; 20 ref.
- Spring O, Miltner F, Gulya TJ, 1994. New races of sunflower downy mildew (Plasmopara halstedii) in Germany. Journal of Phytopathology, 142(3-4):241-244.
- Spring O, Rozynek B, Zipper R, 1998. Infections à spore unique par le mildiou du tournesol. Journal of Phytopathology, 146(11/12):577-579 ; 7 ref.
- Spring O, Zipper R, 2000. Isolation des oospores du mildiou du tournesol, Plasmopara halstedii, et études microscopiques sur la germination des oospores. Journal of Phytopathology, 148(4):227-231 ; 15 ref.
- Spring O, Zipper R, 2006. Evidence for asexual genetic recombination in sunflower downy mildew, Plasmopara halstedii. Mycological Research, 110(6):657-663.
- Sudisha J, Niranjana SR, Sukanya SL, Girijamba R, Devi NL, Shetty HS, 2010. Efficacité relative des formulations de strobilurine dans la lutte contre le mildiou du tournesol. Journal of Pest Science, 83(4):461-470.
- Thanassoulopoulos CC, Mappas CB, 1992. Premier signalement du mildiou du tournesol en Grèce. Plant Disease, 76(5):539
- Tourvieille J, Roeckel-Drevet P, Nicolas P, Tourvieille de Labrouhe D, 1996. Caractérisation des races de mildiou du tournesol (Plasmopara halstedii) par RAPD. In : Actes de la 14e conférence internationale sur le tournesol, Beijing, 781-785.
- Vida R, 1966. Le mildiou du tournesol : un retour important. Növényvédelem, 32:533-535.
- Virányi F, 1984. Recherches récentes sur le mildiou du tournesol en Hongrie. Helia, 7:35-38.
- Virányi F, 1988. Factors affecting oospore formation in Plasmopara halstedii. In : Proceedings of the 12th International Sunflower Conference, Novi Sad, Yugoslavia, Vol, 2:32.
- Viranyi F, Gulya TJ, 1995. Inter-isolate variation for virulence in Plasmopara halstedii (sunflower downy mildew) from Hungary. Plant Pathology, 44(4):619-624.
- Virányi F, Gulya TJ, 1995a. Variation pathogène chez Plasmopara halstedii. In : Abstracts of papers of the 1st International Symposium on Downy Mildew Fungi, Gwatt, Switzerland : Fédération des sociétés européennes de microbiologie, Ciba-Geigy.
- Virányi F, Gulya TJ, 1996. Expression de la résistance dans le pathosystème Plasmopara halstedii - tournesol. In : Actes du Symposium ISA I, Disease Tolerance in Sunflower, Beijing, Chine : International Sunflower Association, 14-21.
- Viranyi F, Sziraki I, 1986. Établissement de cultures doubles de Plasmopara halstedii et de tournesol. Transactions de la Société Mycologique Britannique, 87(2):323-325
- Viranyi F, Walcz I, 2000. Études de population sur Plasmopara halstedii : spécificité de l'hôte et tolérance fongique. In : Proceedings of the 15th International Sunflower Conference Toulouse, France : ISA, (I):55-60.
- Walcz I, Bogßr K, Virßnyi F, 2000. Etude sur un isolat d'Ambrosia de Plasmopara halstedii. Helia, 23(33):19-24 ; 8 ref.
- Yang SM, Wei SE, 1988. Maladies du tournesol cultivé dans la province de Liaoning, République populaire de Chine. Plant Disease, 72(6):546
- Yorinori FT, Henning AA, Ferreira LP, Homechin M, 1985. Maladies du tournesol au Brésil. In : Actes de la 11e Conférence internationale sur le tournesol, Mar del Plata, Brésil, 459.
- Zad J, 1978. Transmission du mildiou du tournesol par les semences. Iranian Journal of Plant Pathology, 14(1/4):1-2 ; 1-7.
- Zazzerini A, 1978. La propagation de Plasmopara helianthi Novot en fonction de la pente. Phytopathologia Mediterranea, 17(3):153-156
- Zazzerini A, 1983. La maladie de Peronospora (Plasmopara helianthi Novot.) du tournesol : races physiologiques du parasite et méthodes d'identification du matériel infecté. Informatore Fitopatologico, 33(2):117-119
- Zimmer DE, 1974. Spécialisation physiologique entre les races de Plasmopara halstedii en Amérique et en Europe. Phytopathology, 64(11):1465-1467
Pourriture sclérotique
La germination carpogène des sclérotes est stimulée par des périodes d'humidité continue du sol. Des apothécies se forment à la surface du sol, d'où les ascospores sont libérées dans l'air. L'infection de la plupart des espèces cultivées est principalement associée aux ascospores, mais l'infection directe des tissus végétaux sains et intacts par les ascospores en germination ne se produit généralement pas. Au contraire, l'infection des tissus des feuilles et des tiges des plantes saines ne se produit que lorsque les ascospores en germination colonisent des tissus morts ou sénescents, généralement des parties de fleurs telles que les pétales abscrits, avant la formation des structures d'infection et la pénétration. La germination mycélienne des sclérotes à la surface du sol peut également entraîner la colonisation de la matière organique morte et l'infection ultérieure des plantes vivantes adjacentes. Cependant, dans certaines cultures, par exemple le tournesol, la germination mycéliogène des sclérotes peut directement initier le processus d'infection des racines et de la tige basale, entraînant le flétrissement. Le stimulus de la germination mycélienne et de l'infection du tournesol n'est pas connu mais dépend probablement des signaux nutritionnels dans la rhizosphère provenant des plantes hôtes.
Le processus d'infection
L'infection des tissus sains dépend de la formation d'un appressorium, dont la structure peut être simple ou complexe selon la surface de l'hôte. Dans la plupart des cas, la pénétration se fait directement à travers la cuticule et non par les stomates. Les appressoria se développent à partir de la ramification dichotomique terminale d'hyphes poussant sur la surface de l'hôte et consistent en un coussinet d'hyphes larges, multi-septés, courts et orientés perpendiculairement à la surface de l'hôte à laquelle ils sont attachés par du mucilage. Les appressoria complexes sont souvent appelés coussins d'infection. Bien que les premiers chercheurs aient considéré la pénétration de la cuticule comme un processus purement mécanique, des études ultrastructurales ont démontré que la digestion enzymatique de la cuticule joue également un rôle dans le processus de pénétration. On sait peu de choses sur S. sclerotiorum Cependant, le génome code pour au moins quatre enzymes de type cutinase (Hegedus, non publié). Une grande vésicule, formée à l'extrémité de l'appressorium avant la pénétration, semble être libérée dans la cuticule de l'hôte pendant la pénétration. Après la pénétration de la cuticule, une vésicule subcuticulaire se forme, à partir de laquelle de grandes hyphes se développent en éventail, recouvrant et dissolvant la paroi subcuticulaire de l'épiderme.
Infection par dégradation enzymatique des cellules épidémiques : L'acide oxalique agit en relation avec les enzymes de dégradation de la paroi cellulaire, comme la polygalacturonase (PG), pour provoquer la destruction du tissu hôte en créant un environnement propice à l'attaque par la PG de la pectine dans la lamelle moyenne. Celle-ci, à son tour, libère des dérivés de faible poids moléculaire qui induisent l'expression d'autres gènes de PG. En effet, l'activité PG globale est induite par la pectine ou les monosaccharides dérivés de la pectine, comme l'acide galacturonique, et est réprimée par la présence de glucose. L'examen des modèles d'expression des gènes Sspg individuels a révélé que l'interaction entre les PG et avec l'hôte au cours des différentes étapes de l'infection est finement coordonnée. (Dwayne D. Hegedus *, S. Roger Rimmer : Sclerotinia sclerotiorum : Quand " être ou ne pas être " un pathogène ? FEMS Microbiology Letters 251 (2005) 177-184)
Recherche des conditions climatiques pour l'infection des S. sclerotiorum doit prendre en compte la formation d'apothécies, la sporulation, l'infection directe par les apothécies (même si elle n'est pas très fréquente) et l'infection à partir de mycéliums établis par dégradation encymatique des cellules épidémiques. Formation des apothécies et sporulation a lieu si une pluie de plus de 8 mm est suivie d'une période d'humidité relative élevée de plus de 20 heures à une température optimale de 21°C à 26°C.
Infection directe par les apothécies peut être attendue après une période d'humectation des feuilles suivie de 16 heures d'humidité relative supérieure à 90% dans des conditions optimales de 21°C à 26°C ("infection par les appressoria"). Alors que croissance saprophyte suivie d'une dégration encymatique des cellules épidermiques ("infection hydrolytique") peut être attendue sous une humidité relative légèrement inférieure de 80% pendant une période de 24 heures dans des conditions optimales de 21°C à 26°C.
La littérature :
- Lumsden, R.D. (1976) Enzymes pectolytiques de Sclerotinia sclerotiorum et leur localisation sur le haricot infecté. Can. J. Bot. 54,2630-2641.
- Tariq, V.N. et Jeffries, P. (1984) Appressorium formation by Sclerotinia sclerotiorum : scanning electron microscopy. Trans. Brit. Mycol. Soc. 82, 645-651.
- Boyle, C. (1921) Études sur la physiologie du parasitisme. VI. Infection par Sclerotinia libertiana. Ann. Bot. 35, 337-347.
- Abawi, G.S., Polach, F.J. et Molin, W.T. (1975) Infection du haricot par les ascospores de Whetzelinia sclerotiorum. Phytopathologie 65, 673-678.
- Tariq, V.N. et Jeffries, P. (1986) Ultrastructure de la pénétration de Phaseolus spp. par Sclerotinia sclerotiorum. Can. J. Bot. 64, 2909- 2915.
- Marciano, P., Di Lenna, P. et Magro, P. (1983) Oxalic acid, cell wall degrading enzymes and pH in pathogenesis and their significance in the virulence of two Sclerotinia sclerotiorum isolates on sunflower. Physiol. Plant Pathol. 22, 339-345.
- Fraissinet-Tachet, L. et Fevre, M. (1996) Regulation by galacturonic acid of ppectinolytic enzyme production by Sclerotinia sclerotiorum. Curr. Microbiol. 33, 49-53.
Utilisation pratique du modèle Sclerotinia
Le modèle d'infection de la jambe blanche indique les périodes où la formation d'apothécies est attendue. Si ces périodes coïncident avec la période de floraison du colza ou du canola, nous devons nous attendre à ce que S. sclerotiorum infections pendant une période humide. Les spores formées dans les apothécies peuvent être disponibles pendant un à plusieurs jours. L'opportunité des infections est indiquée par le calcul de la progression de l'infection pour les infections directes ou indirectes par les appressoria ou la dégradation enzymatique de la paroi cellulaire. Si la ligne de progression de l'infection atteint 100%, une infection doit être supposée. Ces infections doivent être couvertes par un traitement préventif ou un fongicide à action curative contre S. sclerotiorum doit être utilisé.
Moisissure grise
Moule gris (Botrytis cinerea) est une maladie dévastatrice ayant un impact économique élevé en production. B. cinerea infecte les fleurs et les fruits proches de la maturité.
Ce champignon pathogène a une très large gamme d'hôtes, infectant plus de 200 hôtes différents. La croissance fongique existe de manière saprophyte et parasitaire.
Symptômes
Sur les tournesols, le pathogène provoque une moisissure grise sur la tête et la tige. Pendant ce temps, les feuilles commencent à se dessécher. Ces symptômes apparaissent pendant la maturation des grains sur la tête. On observe des taches brunes sur la face arrière. Ces taches sont recouvertes par le mycélium et les spores du champignon, donnant l'aspect d'une poudreuse. Les spores peuvent être disséminées lors de conditions météorologiques humides.
Les sclérotes noirs dépourvus de médulle apparaissent sur les débris de la culture après la récolte ou directement sur les plantes si elles sont récoltées trop tard.
Le champignon passe l'hiver à la surface du sol ou dans le sol sous forme de mycélium ou de sclérotes. Au printemps, la forme hivernante commence à germer et à produire des conidies. Ces conidies sont propagées par le vent et la pluie et infectent les nouveaux tissus végétaux.
La germination est possible à une humidité relative supérieure à 85%. La température optimale de germination est de 18°C. Le champignon pathogène peut se reproduire plusieurs fois.
Options de contrôle : Le contrôle des semences peut protéger les plantes de la fonte des semis. La lutte chimique est difficile en raison de la résistance de l'agent pathogène. C'est pourquoi on tente de mettre en place des stratégies de lutte naturelle avec Trichoderma harzianum.
Conditions de modélisation de l'infection
B. cinerea Les infections sont liées à l'humidité libre. C'est pourquoi, dans la production en plein champ, on détermine l'humidité des feuilles, qui est un bon indicateur.
Bulger et al. (1987) ont étudié la corrélation entre les périodes d'humidité des feuilles pendant la floraison et l'apparition de la pourriture grise sur les fruits. Ils ont constaté que pour un risque d'infection plus élevé à 20°C, une période de mouillage des feuilles de plus de 32 heures est nécessaire. A des températures plus basses, les périodes d'humectation des feuilles doivent être plus longues pour l'infection de la maladie.
FieldClimate indique un risque de Botrytis cinerea sur la base des périodes d'humidité des feuilles et de la température pendant ces périodes.
Le graphique ci-dessous montre la durée des feuilles mouillées en fonction de la température réelle nécessaire pour une Botrytis l'infection. Si le risque est supérieur à 0, toute période de mouillage des feuilles supérieure à 4 heures augmentera le risque dans les mêmes proportions.
Un jour où la période d'humidité des feuilles est inférieure à 4 heures est considéré comme un jour sec et réduit le risque de 20% par rapport à la valeur réelle.
Utilisation pratique du modèle du moule gris : Le modèle indique les périodes présentant un risque de Botrytis l'infection. Cette période de risque pendant la floraison des fraises conduira à des fruits infectés. Plus la période de risque est longue et plus le risque est élevé, plus la probabilité et le nombre de fruits infectés sont élevés. Le risque, qui peut être pris en considération, dépend du marché. Les producteurs qui vendent leurs fruits aux supermarchés ne prendront aucun risque, sachant qu'ils ne sont pas en mesure de vendre des fruits infectés. En revanche, les producteurs qui vendent leurs fruits directement à la population peuvent prendre un risque plus élevé.
La littérature :
- Bulger M.A., Ellis M. A., Madden L. V. (1987) : Influence de la température et de l'humidité sur l'infection des fleurs de fraisiers par Botrytis cinerea et l'incidence de la maladie sur les fruits provenant de fleurs infectées. Ecology and Epidemiology ; Vol 77 (8) : 1225-1230.
- Sosa-Alvarez M., Madden L.V., Ellis M.A. (1995) : Effects of temperature and wetness duration on sporulation of Botrytis cinerea on strawberry leaf residues. Plant disease 79, 609-615.
TomCast
TOMCAST (TOMato disease foreCASTing) est un modèle informatique basé sur des données de terrain qui tente de prévoir le développement de maladies fongiques, à savoir le mildiou, la tache septorienne et l'anthracnose sur les tomates. Des enregistreurs de données placés sur le terrain enregistrent toutes les heures l'humidité et la température des feuilles. Ces données sont analysées sur une période de 24 heures et peuvent aboutir à la formation d'un modèle de prévision de la maladie. Valeur de gravité de la maladie (DSV); essentiellement un accroissement du développement de la maladie. Au fur et à mesure que les DSV s'accumulent, la pression de la maladie continue de s'exercer sur la culture. Lorsque le nombre de DSV accumulés dépasse l'intervalle de pulvérisation, une application de fongicide est recommandée pour soulager la pression de la maladie.
TOMCAST est dérivé du modèle original F.A.S.T. (Forecasting Alternaria solani on Tomatoes) développé par les docteurs Madden, Pennypacker et MacNab ? de la Pennsylvania State University (PSU). Le modèle F.A.S.T. de la PSU a ensuite été modifié par le Dr Pitblado au Ridgetown College en Ontario pour devenir le modèle TOMCAST utilisé par Ohio State University Extension. Les DSV sont : Une valeur de gravité de la maladie (DSV) est l'unité de mesure donnée à un incrément spécifique de développement de la maladie (mildiou). En d'autres termes, une valeur de gravité de la maladie est une représentation numérique de la rapidité ou de la lenteur de l'accumulation de la maladie (mildiou) dans un champ de tomates. Le DSV est déterminé par deux facteurs : l'humidité des feuilles et la température pendant les heures d'humidité des feuilles. Plus le nombre d'heures de mouillage des feuilles et la température augmentent, plus la DSV s'accumule rapidement. Voir le tableau des valeurs de gravité des maladies ci-dessous.
À l'inverse, lorsqu'il y a moins d'heures de mouillage des feuilles et que la température est plus basse, les DSV s'accumulent lentement, voire pas du tout. Lorsque le nombre total de DSV accumulés dépasse une limite prédéfinie, appelée intervalle ou seuil de pulvérisation, une pulvérisation de fongicide est recommandée pour protéger le feuillage et les fruits du développement de la maladie.
L'intervalle de pulvérisation (qui détermine quand vous devez pulvériser) peut varier entre 15 et 20 DSV. Le DSV exact qu'un producteur doit utiliser est généralement fourni par le transformateur et dépend de la qualité du fruit. Suivre un intervalle de pulvérisation de 15 DSV est une utilisation conservatrice du système TOMCAST, ce qui signifie que vous pulvériserez plus souvent qu'un producteur qui utilise un intervalle de pulvérisation de 19 DSV avec le système TOMCAST. Le compromis se situe au niveau du nombre de pulvérisations appliquées pendant la saison et de la différence potentielle de qualité des fruits.
Des études ont été lancées à la Michigan Staate University pour tester le système de prévision des maladies, TomCast, dans le cadre de la gestion des maladies foliaires de la carotte. TomCast a été utilisé commercialement dans la production de tomates, et a récemment été adapté pour être utilisé dans la gestion des maladies de l'asperge. Les carottes de transformation 'Early Gold' ont été plantées à l'aide d'un semoir à vide de précision à la ferme de recherche sur les sols de MSU Muck, en trois rangées espacées de 18 pouces sur un lit surélevé de 50 pieds de long. Les lits de carottes étaient espacés de 64 pouces et l'espacement des graines dans le rang était de 1 pouce. Chacune des quatre répétitions de l'expérience était située dans des blocs distincts de carottes qui comprenaient 36 lits. Dix-sept planches de traitement de 20 pieds de long ont été placées au hasard en damier dans chaque réplication. Les traitements ont été appliqués à l'aide d'un pulvérisateur à dos CO2 calibré pour délivrer 50 gallons par acre de solution de pulvérisation avec des buses à jet plat 8002. Les traitements ont consisté en une application de Bravo Ultrex 82.5WDG (22.4 oz/A) sans traitement et en différents programmes d'application alternés avec Quadris 2.08SC (6.2 fl oz/A). Le programme chimique a été appliqué selon un programme calendaire de 10 jours ainsi que selon les prévisions du système TomCast de prévision des maladies. Trois différents seuils de prédiction de 15, 20 et 25 DSV ont été utilisés pour planifier les applications de fongicides. Lorsque les valeurs quotidiennes cumulées des DSV atteignaient le seuil déterminé, une pulvérisation était appliquée. Chaque régime de traitement a été initié à quatre niveaux différents de pression de la maladie (0%, trace, 5%, et 10% brûlure foliaire). Les premiers traitements ont été appliqués le 2 juillet et la dernière application de tout traitement a été faite le 21 septembre. Dix pieds de chaque rang central des blocs de pulvérisation ont été marqués avant la première application et ont été utilisés pour les évaluations hebdomadaires des maladies (voir les graphiques ci-dessous). Les rendements ont été mesurés sur la même section de dix pieds de rang en récoltant les carottes à la main, en les étêtant et en les pesant.
Cela indique que le premier traitement de la carotte doit être effectué dès que nous pouvons trouver la première incidence de la maladie dans le champ. A partir de maintenant, l'utilisation du modèle TomCast avec un seuil de 20 DSV accumulés depuis la dernière pulvérisation a bien fonctionné.
Fieldclimate détermine la gravité d'une infection par l'Alternaria selon deux modèles différents :
Source : Jim Jasinski, coordinateur de TOMCAST pour l'OHIO, l'INDIANA et le MICHIGAN
Modèle TomCast Alternaria
Les valeurs de gravité d'une infection (de 0 à 4, voir le tableau ci-dessus) sont déterminées en fonction des conditions climatiques (heures d'humidité des feuilles et température de l'air).
Équipement recommandé
Vérifiez quel jeu de capteurs est nécessaire pour surveiller les maladies potentielles de cette culture.