Oliva modelos de enfermedad
La aceituna (Olea europaea L.), cultivado en más de 8 millones de hectáreas, es el segundo cultivo de árboles frutales oleaginosos más importante del mundo después de la palma de aceite y su cultivo se concentra tradicionalmente en la zona mediterránea. La producción total de aceite de oliva en la campaña 2006-2007 fue de 2.859.500 toneladas (datos del Consejo Oleícola Internacional (COI)). Los países del sur de Europa representan alrededor del 74,9% de la producción mundial, siendo España el principal productor (38,7%), seguido de Italia (21%) y Grecia (12,9%). Otros productores importantes de aceite de oliva son Turquía, Túnez y Siria (17,1%), así como Jordania, Marruecos y Argelia.
La mancha del pavo real también se conoce como sarna del olivo y mancha foliar y está extendida por las principales regiones olivareras del mundo (Obanor et al. 2005). Se ha observado que los síntomas aparecen principalmente en las hojas y se manifiestan como manchas de color verde oscuro a negro rodeadas de un halo amarillo similar a la mancha ocular de las plumas del pavo real; de ahí el nombre de mancha del pavo real (Graniti 1993; Shabi et al. 1994). La mancha del pavo real se considera la enfermedad más importante del olivar en España (Trapero y Blanco, 2008). Las pérdidas en los cultivos se deben principalmente a la defoliación de los árboles infectados, al escaso crecimiento y muerte de las ramas defoliadas y a la reducción de la producción de frutos (Graniti 1993; Viruega et al. 1997). En Italia (Graniti 1993) y Nueva Zelanda (MacDonald et al. 2000) se ha reportado que la defoliación fuerte causa un retraso en la maduración y una disminución en el rendimiento de aceite.
Sarna del olivo
Sarna del olivo o mancha foliar, causada por el hongo Spilocaea oleaginaestá muy extendida en la región mediterránea. Las pérdidas se deben principalmente a la defoliación de árboles gravemente infectados, con la consiguiente reducción de la producción.
Síntomas
Los síntomas se limitan principalmente a las hojas y aparecen como manchas zonadas circulares de color marrón oscuro rodeadas de halos amarillos ("ojo de pavo real"). S. oleagina muestra un crecimiento subcuticular típico, formando colonias planas dentro de la capa cutinizada de la gruesa pared celular epidérmica. Este hábito se ha asociado a una reacción de defensa del huésped que implica la movilización y descomposición del glucósido fenólico oleuropina y la inhibición de las enzimas pectolíticas producidas por el patógeno. La enfermedad es particularmente grave en olivares densamente plantados de variedades susceptibles y en viveros. Las infecciones pueden producirse durante todo el año, excepto durante los veranos calurosos y secos, cuando se dan temperaturas favorables (op. 16-21°C) y lluvias. Los conidios, formados en el ápice de conidióforos ampulliformes cortos, suelen ser transportados por las gotas de lluvia, pero datos recientes muestran que las corrientes de aire húmedo y los insectos también contribuyen a una diseminación aérea limitada. Normalmente, el periodo de incubación es de unas 2 semanas; sin embargo, si la infección va seguida de una estación cálida, puede durar varias semanas. Las manchas ya formadas en primavera pueden dejar de crecer en verano y reanudar su crecimiento y esporulación en otoño. Los programas de control químico incluyen tratamientos con fungicidas (especialmente cobre) durante las principales temporadas de infección (primavera y otoño).
Ciclo de vida de la enfermedad
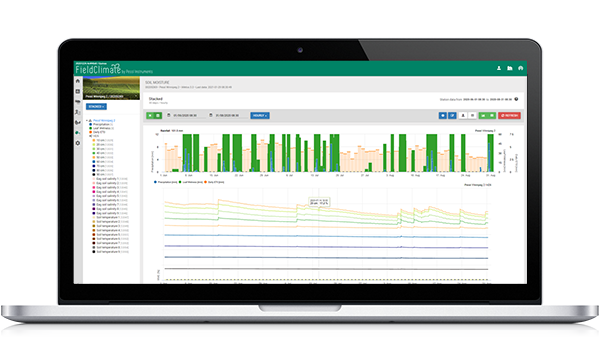
Las hojas y frutos fuertemente infectados en el suelo, así como en los que permanecieron en el árbol, son una fuente de inóculo para la temporada en curso o permitir la hibernación del hongo. En general, se sabe que el patógeno sobrevive a condiciones desfavorables, por ejemplo, tiempo seco y caluroso, tanto en las hojas caídas como en las hojas infectadas del árbol. Las conidias formadas en las hojas del árbol pueden sobrevivir varios meses, aunque una vez separadas de los conidióforos pierden su capacidad germinativa en menos de una semana (Viruega y Trapero 1999). Tras un periodo de clima cálido y húmedo En las manchas foliares se producen fácilmente nuevos lotes de conidios. También se producen conidios viables en las hojas caídas. Sin embargo, su papel como inóculo para producir nuevas infecciones se considera insignificante (Trapero y Blanco 2008). Este estudio ha demostrado que la enfermedad generalmente es favorecido por el clima frescoSin embargo, también se observó que el clima cálido y húmedo durante el verano de 2009 favoreció la aparición de la enfermedad. Estas observaciones apoyan las de Viruega y Trapero (1999), quienes encontraron que en España las infecciones foliares pueden permanecer latentes durante el verano sin causar caída de hojas y son la principal fuente de inóculo para la infección de otoño-invierno. Las observaciones también indicaron que hojas jóvenes eran muy susceptibles a la infección en primavera, y que el follaje de las partes bajas de los árboles se infectaba con mayor frecuencia. Esto es coherente con la necesidad que tiene el patógeno de una humedad elevada para desarrollarse. La germinación requiere 98% humedad, con temperaturas en el rango de 0-27°C (Trapero Cassas 1994). En Australia, la enfermedad puede estar inactiva durante los veranos calurosos y secos. La germinación de las esporas está restringida a temperaturas superiores a 30°C. El el porcentaje de conidios germinados disminuye linealmente en proporción a la edad de la hoja, siendo de 58% a las 2 semanas y de 35% a las 10 semanas. La temperatura afecta significativamente a las frecuencias de germinación de conidios en hojas húmedas de 5°C a 25°C. El porcentaje la germinación aumenta de 16,1, 23,9, 38,8 a 47,8 y vuelve a disminuir a 35,5% después de 24 h. La formación de apresorios se produjo 6 h después de los primeros signos de germinación. El porcentaje de germinados con apresorios aumenta con el incremento de la temperatura hasta un máximo de 43% a 15°C. No se forman apresorios a 25°C tras 48 h de incubación. Al aumentar duración de la humedad hace que germine un número creciente de conidios a todas las temperaturas probadas (5-25°C). Los periodos mínimos de humectación de las hojas necesarios para la germinación a 5, 10, 15, 20 y 25°C fueron de 24, 12, 9, 9 y 12 h, respectivamente. A 20°C, un periodo de humectación más corto (6 h) es suficiente si las conidias germinadas se colocan después en 100% RH, pero no a 80 o 60%. Sin embargo, ninguna conidia germina sin agua libre incluso tras 48 h de incubación a 20°C y 100% HR. La presentación gráfica del modelo de mancha de Peacock muestra la humedad de las hojas, humedad relativa y temperatura del aire junto con los resultados de infección progreso y gravedad de la infección. El gráfico siguiente indica una infección que comienza el 17 de diciembre a las 19:00 y termina en 100% el 18 de diciembre a las 11:00. La gravedad de la infección se calcula después de un periodo húmedo más largo y aumenta en pasos de 4lo que significa que el mayor gravedad calculada para este periodo de infección.
Literatura:
- Graniti A (1993) Sarna del olivo: una revisión. Boletín OEPP/EPPO 23, 377-384.
- MacDonald AJ, Walter M, Trought M, Frampton CM, Burnip G (2000) Survey of olive leaf spot in New Zealand. New Zealand Plant Protection 53, 126-132.
- Obanor EO, Walter M, Jones EE, Jaspers MV (2005) In vitro effects of fungicides on conidium germination of Spilocaea oleagina, the cause of olive leaf spot. Patología vegetal de Nueva Zelanda 58, 278-282.
- Schubert K, Ritschel A, Braun U (2003) A monograph of Fusicladium s.lat. (Hyphomycetes). Schlechtendalia 9, 71-132.
- Shabi E, Birger R, Lavee S, Klein I (1994) Leaf spot (Spilocaea oleaginea) on olive in Israel and its control. Acta Horticulturae 356, 390-394.
- Trapero Cassas A (1994) El repilo del olivo. Agricultura 746, 788-790.
- Trapero A, Blanco MA (2008) Enfermedades. pp. 557-614. En 'El cultivo de olivo. 6ª edición". (Eds D Barranco, R Fernández-Escobar, L Rallo) 846 pp. (Coedición Junta de Andalucía/Mundi-Prensa: Madrid, España)
- Viruega JR, Lique F, Trapero A (1997) Caída de aceituhas debida a infectciones del pedúnculo por Spilocaea oleagina, agente del Repilo del olivo. Fruticultura Profesional 88, 48-54.
- Viruega JR, Trapero A (1999) Epidemiología de la mancha foliar del olivo causada por Spilocaea oleagina en el sur de España. Acta Horticulturae 474, 531-534.
Equipamiento recomendado
Compruebe qué conjunto de sensores se necesita para vigilar las posibles enfermedades de este cultivo.