Weizen Krankheitsmodelle
Weizen (Triticum spp.) ist die zweitwichtigste Serienpflanze. Weizen wird in den unterschiedlichsten Klimazonen angebaut, vom subtropischen Winteranbau bis zum schottischen 11 Monate lang gewachsenen kühlen Klima mit seiner enormen Produktivität. Wie bei allen Pflanzenkrankheiten gibt es Aspekte, die eher historisch bedingt sind, und andere, die hauptsächlich durch das Klima bedingt sind.
Klimabedingte Krankheiten sind: Die Rostkrankheitendie in den wärmeren Klimazonen eine größere Rolle spielen, sind hauptsächlich klimabedingte Krankheiten. Fusarium-Krankheit und seine Fähigkeit, Toxine zu bilden, wird auch von der Geschichte des Feldes und von den klimatischen Bedingungen beeinflusst; sie wird nicht auftreten, wenn das Klima für eine Infektion während der Blütezeit nicht günstig ist. Auch Septoria tritici ist auf spritzende Regenfälle und lang anhaltende Blattnässe angewiesen, um die Rohrkolben und weiter den Mais zu infizieren.
Krankheiten mit historischen Aspekten: Echter Mehltau Blumeria graminisdie in einem weiten klimatischen Bereich vorkommt, wird hauptsächlich durch die Geschichte eines Feldes beeinflusst. Pseudocercosporella herpotrichoides (Augenfleckenkrankheit), Gaeumannomyces graminis (Take- all, Schwarzbeinigkeit) und Rhizoctonia cerealis (Gelbe Charge) sind meist von der Geschichte des Standorts abhängig und werden vom Klima kaum beeinflusst.
Die Krankheit Pyricularia grisea wird in Rice Diseases ausführlich beschrieben und hier Magnaporthe grisea genannt.
Brauner Rost
Der Erreger Puccinia triticina braucht die gleichen Umweltbedingungen wie das Weizenblatt. Der Pilz ist in der Lage, innerhalb von Tauperioden von drei Stunden oder weniger bei Temperaturen von etwa 20°C das Pflanzengewebe zu infizieren; bei längeren Tauperioden treten jedoch mehr Infektionen auf. Bei kühleren Temperaturen sind längere Tauperioden erforderlich, z. B. ist bei 10 °C eine 12-stündige Tauperiode notwendig. Wenn überhaupt, treten nur wenige Infektionen auf, wenn die Tauperiode über 32°C (Stubbs et al., 1986) oder unter 2°C liegt.
Die meisten schweren Epidemien treten auf, wenn Uredinia und/oder latente Infektionen den Winter in der Weizenernte bis zu einem gewissen Schwellenwert überleben oder wenn der im Frühjahr gesäte Weizen zu einem frühen Zeitpunkt, in der Regel vor dem Blattaustrieb, mit exogenem Inokulum infiziert wird. Schwere Epidemien und Verluste können auftreten, wenn das Fahnenblatt vor der Anthese infiziert wird (Chester, 1946). Puccinia triticina ist in erster Linie ein Krankheitserreger des Weizens, seiner unmittelbaren Vorfahren und der Kulturpflanze Triticale.
Stellvertretende Gastgeber
Der Pilz produziert seine sexuellen Gameten (Pyknosporen und rezeptive Hyphen) auf dem Zwischenwirt. Die meisten Rostforscher gehen davon aus, dass Thalictrum speciosissimum (aus der Familie der Hahnenfußgewächse) ist der primäre Zwischenwirt für P. recondita f. sp. tritici in Europa. Der Zwischenwirt wird infiziert, wenn die Teliosporen in Gegenwart von freier Feuchtigkeit keimen. Es werden Basidiosporen (1n) produziert, die über eine kurze Distanz (einige Meter) getragen werden können, um die Zwischenwirte zu infizieren. Ungefähr sieben bis zehn Tage nach der Infektion erscheinen Pyknien mit Pyknosporen und rezeptiven Hyphen. Diese dienen als Gameten, und die Befruchtung findet statt, wenn der Nektar, der die Pyknosporen enthält, von Insekten, durch Regenspritzer oder durch Kohäsion zu den rezeptiven Hyphen des anderen Paarungstyps getragen wird. Sieben bis zehn Tage später erscheinen auf der Unterseite des Blattes die Äskarienbecher, aus denen die vom Wind getragenen Äskiensporen hervorgehen, die durch das Eindringen in die Spaltöffnungen der Weizenblätter eine Infektion verursachen. Die von den Eziensporen zurückgelegten Strecken scheinen relativ kurz zu sein.
Lebenszyklus (Braunrost)
Die nebenstehende Abbildung zeigt den Lebenszyklus für P. triticina und P. triticiduri und der Krankheitszyklus des Weizenblattrostes. Der Zeitpunkt der einzelnen Ereignisse und die Häufigkeit einiger Ereignisse (Sexualzyklus, Weizenanbausaison und Green-Bridge) können in verschiedenen Gebieten und Regionen der Welt unterschiedlich sein.
Der Zwischenwirt liefert derzeit nur wenig direktes Inokulum von P. triticina für Weizen, könnte aber ein Mechanismus für den genetischen Austausch zwischen Rassen und möglicherweise Populationen sein. Der Erreger überlebt die Zeit zwischen den Weizenernten in vielen Gebieten auf einer grünen Brücke aus Durchwuchsweizen (Selbstaussaat) (siehe Abschnitt "Epidemiologie"). Das Inokulum in Form von Urediniosporen kann durch Winde von einer Region in eine andere geweht werden. Der Sexualzyklus ist entscheidend für P. triticiduri. Teliosporen können kurz nach der Entwicklung keimen, und die Infektion mit Basidiosporen kann während des gesamten Weizenanbauzyklus erfolgen.
Die Urediniosporen beginnen 30 Minuten nach dem Kontakt mit freiem Wasser bei Temperaturen von 15° bis 25°C mit der Keimung. Der Keimschlauch wächst an der Blattoberfläche entlang, bis er ein Stoma erreicht; dann bildet sich ein Appressorium, unmittelbar gefolgt von der Entwicklung eines Penetrationszapfens und eines substomatären Vesikels, aus dem sich Primärhyphen entwickeln. Eine haustorielle Mutterzelle entwickelt sich gegen die Mesophyllzelle, und es kommt zur direkten Penetration. Das Haustorium wird im Inneren der lebenden Wirtszelle in einer kompatiblen Wirt-Pathogen-Interaktion gebildet. Es entwickeln sich sekundäre Hyphen, die zu weiteren haustoriellen Mutterzellen und Haustorien führen. Bei einer inkompatiblen Wirt-Pathogen-Reaktion entwickeln sich die Haustorien nicht oder langsamer. Wenn die Wirtszelle abstirbt, stirbt auch das Haustorium des Pilzes. Je nachdem, wann oder wie viele Zellen beteiligt sind, führt die Wirt-Pathogen-Interaktion zu einer sichtbaren Resistenzreaktion (Rowell, 1981, 1982).
Die Sporenkeimung bis zur Sporulation kann bei optimalen und konstanten Temperaturen innerhalb von sieben bis zehn Tagen erfolgen. Bei niedrigen Temperaturen (10° bis 15°C) oder tageszeitlichen Schwankungen sind längere Zeiträume erforderlich. Bei Temperaturen nahe oder unter dem Gefrierpunkt kann der Pilz als fades Myzel einen Monat oder länger überleben. Die maximale Sporenbildung wird etwa vier Tage nach der ersten Sporenbildung (bei etwa 20 °C) erreicht. Obwohl die Anzahl stark schwanken kann, werden pro Uredinium und Tag etwa 3 000 Sporen produziert. Dieses Produktionsniveau kann drei Wochen oder länger anhalten, wenn das Weizenblatt so lange am Leben bleibt (Chester, 1946; Stubbs et al., 1986). Die Uredinien (Pusteln) sind rot, oval und verstreut und durchbrechen die Epidermis (Tafel 12). Die Urediniosporen sind orangerot bis dunkelrot, echinulär, kugelförmig und haben gewöhnlich einen Durchmesser von 20 bis 28 µm (Tafel 13). Die Teliosporen (Tafel 14) sind dunkelbraun, zweizellig, dickwandig und am Apex abgerundet oder abgeflacht (Tafel 15). Puccinia triticiduri unterscheidet sich von P. triticina dadurch, dass es 10 bis 12 Tage dauert, bis die Urediniosporen erscheinen, und die erste Teliosporenproduktion erfolgt oft innerhalb von 14 Tagen nach der Erstinfektion. Die Uredinien sind gelblich-braun und produzieren viel weniger Urediosporen pro Uredinie, und innerhalb weniger Tage produziert die Läsion hauptsächlich Teliosporen. Auch P. triticiduri Die Infektionen sind wahrscheinlich auf der unteren Blattoberfläche zu finden.
Die Teliosporen von P. triticina werden unter der Epidermis bei ungünstigen Bedingungen oder Seneszenz gebildet und verbleiben auf den Blättern. Blattgewebe kann durch Wind, Tiere oder Menschen über beträchtliche Entfernungen verstreut oder verschleppt werden. Basidiosporen werden unter feuchten Bedingungen gebildet und freigesetzt, was ihre Verbreitung einschränkt. Basidiosporen sind außerdem hyalin und lichtempfindlich, was ihre Ausbreitung auf einige Dutzend Meter begrenzen dürfte. Aeciosporen ähneln in ihrer Fähigkeit, durch Windströmungen transportiert zu werden, eher den Urediniosporen, doch wurde aus irgendeinem Grund kein Langstreckentransport festgestellt. Puccinia triticiduri produziert innerhalb von Wochen nach der Erstinfektion reichlich Teliosporen, die um jede Infektionsstelle einen dunklen Telienring bilden.
Quelle: Die Weizenroste: R.P. Singh, J. Huerta-Espino, A.P. Roelfs
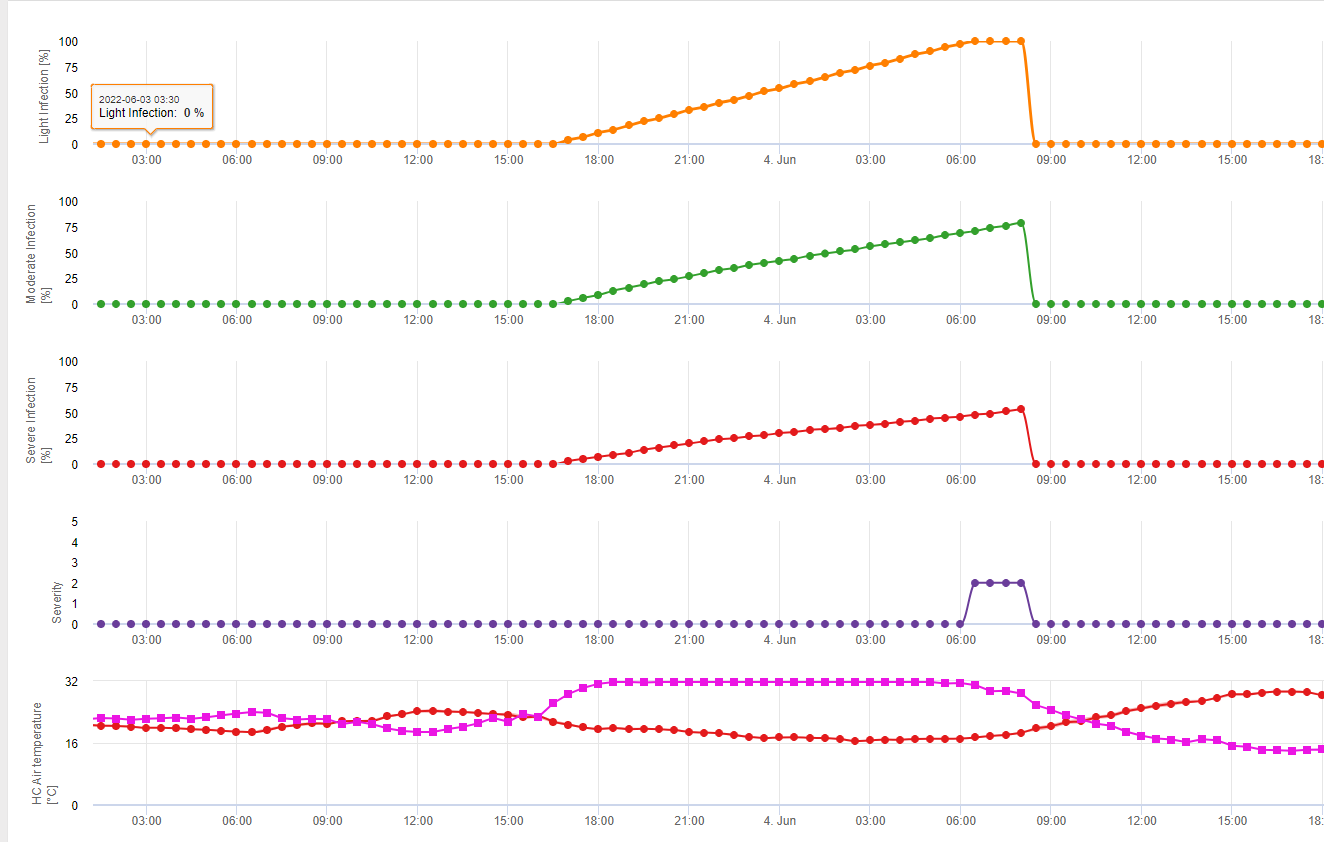
Puccinia tritici-Infektionsmodell
Puccinia tritici Infektionen erfolgen nach:
- Einige Stunden Blattnässe bei optimalen Temperaturbedingungen. Der Pilz kann in einem breiten Temperaturbereich infizieren.
- Das Modell geht davon aus, dass eine Infektion eine akkumulierte stündliche Lufttemperatur von 90°C Blattfeuchte in einem Lufttemperaturbereich von 5°C bis 30°C benötigt.
Blattnässe für akkumulierte stündliche Durchschnittstemperaturen für 90°C
- (wenn T <= 22,5°C dann ∑(Th) sonst ∑ (22,5-(Th-22,5))
- 5°C < Temp. < 30°C
In FieldClimate wird die Puccinia tritici Die Infektion wird durch die gelbe Linie dargestellt (siehe oben). Die Bedingungen sind ähnlich wie P. graminis, jedoch mit einer niedrigeren Temperaturschwelle von 5°C. Wird eine 100%-Infektion festgestellt, muss eine kurative Pflanzenschutzmaßnahme in Betracht gezogen werden (systemische Anwendung). Wenn das Risiko bei 80% liegt und die Wettervorhersage mehr Blattnässeperioden vorhersagt, könnten Blattschutzanwendungen durchgeführt werden.
Schwarzer Rost
Der Stängel- oder Schwarzrost von Weizen wird verursacht durch P. graminis f. sp. tritici. Einst war er in den meisten Weizenregionen der Welt eine gefürchtete Krankheit. Die Furcht vor dem Stängelrost war verständlich, denn eine scheinbar gesunde Pflanze konnte drei Wochen vor der Ernte zu einem schwarzen Gewirr aus gebrochenen Stängeln und verschrumpelten Körnern werden. In Europa und Nordamerika verringerte sich durch den Wegfall des Zwischenwirts die Zahl der Virulenzkombinationen und die Menge des lokal produzierten Inokulums (Aeciosporen). Darüber hinaus wurden in einigen Gebieten früh reifende Sorten eingeführt, um eine zweite Ernte zu ermöglichen oder um die Blüte und das Füllen der Körner bei heißem Wetter zu vermeiden. Früh reifende Sorten entgehen einem Großteil der durch den Stängelrost verursachten Schäden, indem sie die Wachstumsperiode des Pilzes umgehen. Durch den weit verbreiteten Einsatz resistenter Sorten weltweit ist die Krankheit zu einem bedeutenden Produktionsfaktor geworden. Obwohl Veränderungen in der Virulenz des Erregers einige Resistenzen unwirksam gemacht haben, wurden resistente Sorten im Allgemeinen vor dem Erreger entwickelt. Die spektakulären Epidemien, die in den 1940er Jahren auf Eureka (Sr6 in Australien) und Mitte der 1950er Jahre auf Lee (Sr9g, Sr11, Sr16), Langdon (Sr9e, +) und Yuma (Sr9e, +) in den Vereinigten Staaten auftraten, waren in der Vergangenheit eher die Ausnahme. Die Erfahrungen in anderen Teilen der Welt waren ähnlich (Luig und Watson, 1972; Roelfs, 1986; Saari und Prescott, 1985). Heute ist der Stängelrost weltweit weitgehend unter Kontrolle.
Epidemiologie
Die Epidemiologie der P. graminis ist vergleichbar mit P. triticina. Die Mindest-, Optimal- und Höchsttemperaturen für die Sporenkeimung liegen bei 2°, 15° bis 24° bzw. 30°C (Hogg et al., 1969) und für die Sporenbildung bei 5°, 30° bzw. 40°C, was in jeder Kategorie etwa 5,5°C höher ist als für P. triticina. Der Stängelrost ist in der späten Wachstumsperiode, bei spät gesäten und reifenden Weizensorten und in niedrigeren Höhenlagen von größerer Bedeutung. Frühjahrsaussaatweizen ist in höheren Breitengraden besonders anfällig, wenn die Inokulumquellen windabwärts gelegen sind. In den südlichen Great Plains Nordamerikas gibt es große Flächen mit Herbstweizen, die das Inokulum für den nördlichen Frühjahrsweizen liefern. In feuchtwarmen Klimazonen kann der Stängelrost besonders schwerwiegend sein, da die Bedingungen für die Krankheitsentwicklung über einen langen Zeitraum hinweg günstig sind, wenn eine lokale Inokulumquelle vorhanden ist.
Der Stängelrost unterscheidet sich vom Blattrost dadurch, dass er eine längere Tauperiode benötigt (sechs bis acht Stunden sind notwendig). Außerdem entwickeln sich viele Eindringlinge nicht aus dem Appressorium, wenn sie nicht durch mindestens 10 000 Lux Licht während einer dreistündigen Periode stimuliert werden, während die Pflanze nach der Tauperiode langsam abtrocknet. Die maximale Infektion wird bei 8 bis 12 Stunden Tau bei 18 °C erreicht, gefolgt von 10 000+ Lux Licht, während der Tau langsam abtrocknet und die Temperatur auf 30 °C ansteigt (Rowell, 1984). Auf dem Feld ist die Lichtmenge selten begrenzt, da der Tau oft am Morgen auftritt. Es kommt jedoch kaum zu Infektionen, wenn auf abendlichen Tau und/oder Regen Winde folgen, die vor Sonnenaufgang zu einer Austrocknung führen. Im Gewächshaus ist weniger Licht oft der Grund für schlechte Infektionsraten. Die Wirkung des Lichts ist wahrscheinlich eher eine Wirkung auf die Pflanze als auf das Pilzsystem, da die in den Blattwirbel injizierten Uredinosporen zu einem erfolgreichen Eindringen des Pilzes führen, ohne dass Licht auf den Pilz trifft. Die Uredinien des Stängelrostes kommen sowohl auf den Blatt- und Stängeloberflächen als auch auf den Blattscheiden, Ähren, Spelzen, Grannen und sogar Körnern vor.
Eine Stängelrostpustel (Uredinium) kann 10 000 Urediniosporen pro Tag produzieren (Katsuya und Green, 1967; Mont, 1970). Das ist mehr als beim Blattrost, aber die Ansteckungsfähigkeit ist geringer, denn nur etwa einer von zehn Keimen führt zu einer erfolgreichen Infektion. Die Uredinia des Stängelrostes, die sich hauptsächlich auf dem Gewebe des Stängels und der Blattscheide befinden, überleben oft länger als die des Blattrostes, der sich häufiger auf die Blattspreiten beschränkt. Die Vermehrungsrate der beiden Krankheiten ist sehr ähnlich.
Die Urediniosporen des Stängelrostes sind ziemlich resistent gegen atmosphärische Bedingungen, wenn ihr Feuchtigkeitsgehalt moderat ist (20 bis 30 %). Der Ferntransport erfolgt jährlich (800 km) über die nordamerikanischen Great Plains (Roelfs, 1985a), fast jährlich (2000 km) von Australien nach Neuseeland (Luig, 1985) und mindestens dreimal in den letzten 75 Jahren (8 000 km) von Ostafrika nach Australien (Watson und de Sousa, 1983).
Aeciosporen können auch eine Quelle für das Inokulum des Weizenstängelrostes sein. In der Vergangenheit war dies in Nordamerika sowie Nord- und Osteuropa von Bedeutung. Diese Inokulumquelle wurde im Allgemeinen durch die Beseitigung der Gewöhnlichen oder Europäischen Berberitze (Berberitze vulgaris) in der Nähe von Weizenfeldern. Die Aeciosporen infizieren den Weizen ähnlich wie die Urediniosporen.
Hosts
Weizen, Gerste, Triticale und ein paar verwandte Arten sind die Hauptwirte für P. graminis f. sp. tritici. Allerdings ist der eng verwandte Erreger, P. graminis f. sp. secalisist auf den meisten Gersten und einigen Weizenarten (z. B. Linie E) virulent. Puccinia graminis f. sp. secalis kann Sr6 und Sr11 in einem Wirtshintergrund der Linie E angreifen (Luig, 1985). Der primäre Alternativwirt in der Natur ist B. vulgaris L.eine in Europa beheimatete Art, obwohl andere Arten in Gewächshaustests anfällig waren. Die alternativen Wirte sind in der Regel für alle oder keine der formae speciales von P. graminis.
Stellvertretende Gastgeber
Der wichtigste alternative Host für P. graminis ist B. vulgarisdie vom Menschen in den nördlichen Breitengraden der Nordhalbkugel verbreitet wurde. Wegen ihres aufrechten, buschigen Wuchses mit vielen scharfen Dornen eignete sie sich hervorragend als Hecke entlang von Feldrändern. Das Holz diente zur Herstellung von Werkzeuggriffen, die Rinde lieferte ein Färbemittel und die Früchte wurden zur Herstellung von Marmeladen verwendet. Die Siedler, die aus Europa nach Nordamerika kamen, brachten die Berberitze mit. Die Berberitze verbreitete sich mit dem Menschen nach Westen und wurde von Pennsylvania über die östlichen Dakotas und südwärts bis ins nordöstliche Kansas eingebürgert. Viele Arten von Berberis, Mahonia und Mahoberberis sind anfällig für P. graminis (Roelfs, 1985b). Die Kanadische oder Allegheny Berberitze, B. canadensissollte in diese Liste aufgenommen werden.
Der alternative Wirt war eine wichtige Quelle für neue Kombinationen von Genen für Virulenz und Aggressivität des Erregers (Groth und Roelfs, 1982). Die große Variationsbreite des Erregers machte die Züchtung auf Resistenz schwierig, wenn nicht gar unmöglich. Von den Virulenzkombinationen, die in einem Jahr vorhanden waren, traten viele im folgenden Jahr nicht wieder auf, dafür aber viele neue (Roelfs, 1982). Die Berberitze war die Quelle des Inokulums (Aeciosporen) zu Beginn der Saison. Im Allgemeinen befanden sich die infizierten Sträucher in der Nähe der Getreidefelder der vorangegangenen Saison, so dass das Inokulum kurze Entfernungen zurücklegen konnte, ohne den Verlust an Anzahl und Lebensfähigkeit zu erleiden, der mit dem Transport über große Entfernungen verbunden ist. Ein einziger großer Berberitzenstrauch kann innerhalb weniger Wochen etwa 64 x 109 Aeciosporen produzieren (Stakman, 1923). Dies entspricht der täglichen Produktion von 20 Millionen Uredinien auf einer Fläche von 400 m2.
Die Berberitze war in Dänemark (Hermansen, 1968) und Nordamerika (Roelfs, 1982) eine wichtige Quelle für das Inokulum des Stängelrostes. Der Erfolg bei der Eindämmung von Stammrostepidemien in Nordeuropa und Nordamerika nach der Entfernung der Berberitze in der Nähe von Weizenfeldern hat wahrscheinlich dazu geführt, dass die Rolle dieses alternativen Wirts bei der Entstehung jährlicher Epidemien anderswo überbewertet wird.
Widerstand gegen P. graminis in Berberis ist angeblich darauf zurückzuführen, dass der Erreger die zähe Kutikula nicht direkt durchdringen kann (Melander und Craigie, 1927). Berberis vulgaris wird etwa 14 Tage nach der Entfaltung der Blätter resistent gegen Infektionen. Allerdings treten Infektionen an den Beeren, Dornen und Stängeln auf, was darauf schließen lässt, dass die Verhärtung der Kutikula nicht so wichtig ist, wie ursprünglich angenommen. Bei neueren Tests mit alternativen Wirtssorten wurde eine überempfindliche Reaktion beobachtet, insbesondere bei Berberis spp. (Mahonie).
Lebenszyklus
In den meisten Gebieten der Welt ist der Lebenszyklus von P. graminis f. sp. tritici besteht aus kontinuierlichen Uredinialgenerationen. Der Pilz verbreitet sich durch luftgetragene Urediniosporen von einer Weizenpflanze zur anderen und von Feld zu Feld. Das Primärinokulum kann lokal (endemisch) von Durchwuchspflanzen stammen oder durch den Wind über weite Entfernungen (exodemisch) getragen und durch Regen abgelagert werden. In Nordamerika wandert P. graminis jährlich in 90 Tagen oder weniger 2 000 km von den südlichen Winterweizen zu den nördlichsten Frühjahrsweizen und kann im Uredinialzyklus den Winter auf Meereshöhe bis mindestens 35°N überleben. Schnee kann eine Deckung bieten, die es gelegentlich ermöglicht P. graminis selbst bei strengen Minustemperaturen, wie sie bei 45°N herrschen, als Infektionen auf Winterweizen zu überleben (Roelfs und Long, 1987). Der sexuelle Zyklus kommt nur selten vor, außer im pazifischen Nordwesten der Vereinigten Staaten (Roelfs und Groth, 1980) und in lokalen Gebieten Europas (Spehar, 1975; Zadoks und Bouwman, 1985). Der sexuelle Zyklus führt zwar zu einer großen genetischen Vielfalt (Roelfs und Groth, 1980), aber auch zu einer großen Anzahl von Individuen, die aufgrund häufiger rezessiver Virulenzgene (Roelfs und Groth, 1988) und einer Neuordnung der Aggressivitätsgene weniger fit sind. Puccinia graminis hat erfolgreich eine ungeschlechtliche Vermehrungsstrategie entwickelt, die es dem Pilz offenbar ermöglicht, notwendige Gene in Blöcken zu erhalten, die gelegentlich durch Mutation und Selektion verändert werden.
Die Keimung der Urediniosporen beginnt bei optimalen Temperaturen (Tabelle 13.2) in Gegenwart von freiem Wasser innerhalb von ein bis drei Stunden. Die Feuchtigkeits- oder Tauperiode muss bei günstigen Temperaturen sechs bis acht Stunden dauern, damit die Sporen keimen und einen Keimschlauch und ein Appressorium bilden können. Die sichtbare Entwicklung stoppt im Appressoriumstadium, wenn nicht mindestens 10 000 Lux (optimal sind 16 000) Licht vorhanden sind. Das Licht stimuliert die Bildung eines Penetrationsstifts, der in ein geschlossenes Stoma eindringt. Wenn der Keimling während der Keimzeit austrocknet, wird der Prozess unwiderruflich gestoppt. Der Penetrationsprozess dauert etwa drei Stunden, wenn die Temperatur von 18° auf 30°C ansteigt (Rowell, 1984). Der Lichtbedarf für die Infektion macht die Arbeit mit P. graminis im Gewächshaus viel schwieriger als mit P. recondita. Wahrscheinlich hat das Licht auf dem Feld nur selten eine Wirkung, es sei denn, die Tauperioden lösen sich vor Tagesanbruch auf.
Die Urediniosporen entwickeln sich in Pusteln (Uredinia), die die Epidermis aufreißen und Massen von rötlich-braunen Sporen freilegen. Die Uredinien sind größer als die des Blattrostes, oval oder länglich, mit losem oder zerrissenem Epidermisgewebe an den Rändern (Tafel 16). Die Urediniosporen sind rötlich-braune, elliptische bis eiförmige, echinuläre Strukturen mit einer Größe von 24 bis 32 µm x 18 bis 22 µm (Tafel 17).
Wenn der Wirt heranreift, werden Telien (Tafel 18) direkt aus der Infektion mit Urediniosporen gebildet oder Teliosporen können in einer reifen Uredinialpustel gebildet werden. Die Teliosporen sind dunkelbraun, zweizellig und etwas keilförmig. Sie haben dicke Wände und messen 40 bis 60 µm x 18 bis 26 µm. Die apikale Zelle ist abgerundet oder leicht spitz (Tafel 19). Die Teliosporen sind dikaryotisch (n + n) und verbleiben bis zum Frühjahr im Stroh. In dieser Zeit findet die Karyogamie statt und die Telosporen werden diploid (2n). Wenn es im Frühjahr regnet und die Temperaturen günstig sind, keimt die Teliospore, löst die Meiose auf und bildet ein vierzelliges Basidium. Jede Zelle produziert eine Narbe mit einer einzigen haploiden Basidiospore (1n). Die hyaline Basidiospore wird vom Wind über kurze Distanzen (Meter) zum Berberitzenstrauch getragen. Die Basidiosporen keimen und dringen direkt ein. Um eine maximale Infektion zu erreichen, sollte das Blattgewebe der Berberitze weniger als zwei Wochen alt sein. Die Infektion durch eine Basidiospore führt zur Bildung eines Pykniums (1n). Das Pyknium produziert rezeptive Hyphen und Pyknosporen eines einzigen Paarungstyps (+ oder -), die als weibliche und männliche Gameten für den Pilz dienen. Die Pyknosporen eines Paarungstyps müssen auf die rezeptiven Hyphen des anderen Paarungstyps übertragen werden, um die Entwicklung der Ekosporen einzuleiten. Die Übertragung der Pyknosporen erfolgt häufig durch Insekten, die von dem aus dem Pyknium austretenden Nektar angezogen werden. Die Paarung von + und - Typen kann auch durch spritzenden Regen, das Abstreifen von Blättern, größere Tiere und benachbarte Infektionen, die zusammenwachsen, erleichtert werden. Die Aeciosporen sind dikaryotisch (n + n) und werden sieben bis zehn Tage nach der Befruchtung in Aecien gebildet, die sich im Allgemeinen auf der Unterseite der Berberitzenblätter befinden. Die Aeciosporen sind das Produkt einer genetischen Rekombination und können sich in ihrer Virulenz und Aggressivität unterscheiden. Das Ausmaß der Variation hängt von den Unterschieden zwischen den Elternisolaten ab. Puccinia graminis f. sp. tritici wurde mit anderen formae speciales gekreuzt, und Kreuzungen mit P. graminis f. sp. secalis waren relativ fruchtbar (Johnson, 1949). In Australien gibt es Hinweise auf eine Rekombination von Weizenstammrost und Scabrum-Rost (P. graminis f. sp. secalis) (Burdon et al., 1981; Luig und Watson, 1972).
Aeciosporen werden hydroskopisch aus den Aecien freigesetzt und werden über Entfernungen von einigen Metern bis hin zu einigen Kilometern über die Luft auf den Weizen übertragen. Die Aeciosporen benötigen ähnliche Infektionsbedingungen wie die Urediniosporen. Die Infektion durch Aeciosporen führt zur Bildung von dikaryotischen (n + n) Uredinien mit Urediniosporen. Der sich wiederholende asexuelle Zyklus umfasst dann Urediosporen, die unter optimalen Bedingungen in einem Zyklus von etwa 14 Tagen Uredinia produzieren. Unter Feldbedingungen, wo die Temperaturen stark schwanken, kann der Zyklus entweder verlängert oder verkürzt werden. Im Allgemeinen verlängern niedrigere Temperaturen auf dem Feld, zumindest in den frühen Stadien des Erntezyklus, die Latenzzeit. In Nordindien wurde für den Stängelrost eine Latenzzeit von 31 Tagen festgestellt (Joshi und Palmer, 1973).
Quelle: Die Weizenroste: R.P. Singh, J. Huerta-Espino, A.P. Roelfs
Puccinia gramnis-Infektionsmodell
Puccinia graminis Infektionen erfolgen nach:
- Einige Stunden Blattnässe bei optimalen Temperaturbedingungen. Der Pilz kann in einem breiten Temperaturbereich infizieren.
- Das Modell geht davon aus, dass die Infektion eine akkumulierte stündliche Lufttemperatur von 80°C an Blattnässe in einem Lufttemperaturbereich von 10°C bis 35°C benötigt. Sie bevorzugt etwas höhere Temperaturen als P. tritici und auf die Infektion muss Sonnenlicht folgen.
Blattnässe für akkumulierte stündliche Durchschnittstemperaturen von 80°C, gefolgt von einer leichten Geriode (150 W/m²) für akkumulierte stündliche Durchschnittstemperaturen von 30°C
- (wenn T <= 24°C dann ∑(Th) sonst ∑ Th-24
- 10°C < Temp. < 35°C
In FieldClimate P. graminis Infektion wird unter den oben beschriebenen Bedingungen berechnet (grüne Linie). Wenn eine Infektion mit 100% angezeigt wird, waren die Bedingungen für den Pilz günstig, und es muss eine Pflanzenschutzmaßnahme (kurativ) in Betracht gezogen werden.
Gelber Rost
Streifen- oder Gelbrost bei Weizen, verursacht durch P. striiformis f. sp. tritici kann ebenso schädlich sein wie der Stängelrost. Der Streifenrost hat jedoch ein niedrigeres Temperaturoptimum für seine Entwicklung, was seine Bedeutung als Krankheit in vielen Gebieten der Welt einschränkt. Der Streifenrost ist vor allem eine wichtige Weizenkrankheit, die im Winter oder im zeitigen Frühjahr oder in höheren Lagen auftritt.
Der Streifenrost des Weizens kann die Ursache für den Streifenrost der Gerste sein (Stubbs, 1985). In Europa ist eine forma specialis von P. striiformis entwickelt, der häufig auf Gerste und nur selten auf den anfälligsten Weizenarten vorkommt (Zadoks, 1961). Puccinia striiformis f. sp. hordei wurde in Südamerika eingeschleppt, wo sie sich über den gesamten Kontinent ausbreitete (Dubin und Stubbs, 1986) und später in Mexiko und den Vereinigten Staaten nachgewiesen wurde (Roelfs et al., 1992).
Epidemiologie
Puccinia striiformis hat von den drei Weizenrost-Erregern die geringsten Temperaturanforderungen. Die Mindest-, Optimal- und Höchsttemperaturen für die Infektion mit Streifenrost liegen bei 0°, 11° bzw. 23°C (Hogg et al., 1969). Puccinia striiformis kann häufig aktiv auf im Herbst gesätem Weizen überwintern. Die meisten epidemiologischen Arbeiten wurden in Europa durchgeführt und kürzlich von Zadoks und Bouwman (1985) und Rapilly (1979) überprüft.
In Europa, P. striiformis Übersommerer auf Weizen (Zadoks, 1961). Die Menge des Übersommerungsrostes hängt von der Menge des Durchwuchses im Weizen ab, der wiederum von der Feuchtigkeit in der Nebensaison abhängt. Die Harnstoff-Iniosporen werden dann auf den im Herbst gesäten Weizen geblasen. In Nordwesteuropa ist die Überwinterung auf Urediniomyzelien in lebendem Blattgewebe beschränkt, da Temperaturen von -4°C die freiliegenden Sporenläsionen abtöten. Latente Läsionen können überleben, wenn das Blatt überlebt. In anderen Gebieten der Welt kann Schnee die sporulierenden Läsionen gegen die kalten Temperaturen isolieren, so dass Lufttemperaturen unter -4°C die Rostläsionen nicht abtöten. Die Latenzzeit für den Streifenrost kann im Winter bis zu 118 Tage betragen, und es wird vermutet, dass sie unter einer Schneedecke bis zu 150 Tage beträgt (Zadoks, 1961).
In Gebieten in Äquatornähe neigt der Streifenrost dazu, endemisch von niedrigeren zu höheren Lagen zu wandern und entsprechend der Phänologie der Ernte zurückzukehren (Saari und Prescott, 1985). In nördlicheren Breitengraden wird der Zyklus länger und der Streifenrost wandert von den Bergregionen in die Vorgebirge und Ebenen.
Aufgrund ihrer Empfindlichkeit gegenüber ultraviolettem Licht werden die Urediniosporen des Streifenrostes wahrscheinlich nicht so weit transportiert wie die des Blatt- und Stängelrostes. Maddison und Manners (1972) stellten fest, dass die Urediosporen des Streifenrosts dreimal so empfindlich auf ultraviolettes Licht reagieren wie die des Stielrosts. Dennoch berichtet Zadoks (1961), dass der Streifenrost in lebensfähigem Zustand durch den Wind mehr als 800 km weit transportiert wurde. Die Einschleppung des Weizen-Streifenrostes nach Australien und Südafrika und des Gersten-Streifenrostes nach Kolumbien wurde wahrscheinlich durch den Menschen mit Hilfe von Düsenflugzeugen unterstützt (Dubin und Stubbs, 1986; O'Brien? et al., 1980). Die Ausbreitung des Streifenrostes von Australien nach Neuseeland, einer Entfernung von 2 000 km, erfolgte jedoch wahrscheinlich durch aus der Luft übertragene Urediniospora (Beresford, 1982). Vielleicht hat eine durchschnittliche Spore des Streifenrostes eine geringere Wahrscheinlichkeit, in lebensfähigem Zustand über weite Entfernungen in der Luft übertragen zu werden, als die der anderen Weizenroste, aber sicherlich müssen einige Sporen in der Lage sein, den Transport über weite Entfernungen unter besonderen und günstigen Bedingungen zu überleben. Es gibt mehrere Beispiele für die sequenzielle Wanderung des Streifenrostes. Die Virulenz des Gens Yr2 (Sorten Siete Cerros, Kalyansona und Mexipak) wurde erstmals in der Türkei festgestellt und im Laufe der Zeit bis auf den indischen und pakistanischen Subkontinent verfolgt (Saari und Prescott, 1985), was möglicherweise mit den als "Western Disturbance" bezeichneten Wettersystemen zusammenhängt. Wie bereits erwähnt, wanderte der Gerstenstreifenrost in Südamerika innerhalb weniger Jahre von seinem Einführungsort in Kolumbien nach Chile (Dubin und Stubbs, 1986).
In den meisten untersuchten Gebieten der Welt scheint es eine lokale oder nahe gelegene Quelle für Inokulum aus Durchwuchsweizen zu geben (Line, 1976; Stubbs, 1985; Zadoks und Bouwman, 1985). Einige Hinweise deuten jedoch darauf hin, dass das Inokulum von Nicht-Getreidegräsern stammt (Hendrix et al., 1965; Tollenaar und Houston, 1967). Künftige Studien zur Epidemiologie des Streifenrostes müssen nicht nur das Vorhandensein von Rost auf nahe gelegenen Gräsern berücksichtigen, sondern auch die Tatsache, dass der Rost auf den Gräsern auftreten muss, bevor er auf dem Getreide erscheint. Es muss nachgewiesen werden, dass der Virulenzphänotyp auf beiden Wirten derselbe ist und dass er während der Anbausaison vom Gras auf den Weizen übergeht.
In den Niederlanden können Streifenepidemien durch ein einziges Uredinium pro Hektar ausgelöst werden, das den Winter überlebt, wenn die Frühjahrssaison für die Rostentwicklung günstig ist (Zadoks und Bouwman, 1985). Es ist unwahrscheinlich, dass ein einzelnes Uredinium pro Hektar visuell erkannt wird, aber wenn sich um das anfängliche Uredinium herum Herde entwickeln, wird es immer leichter zu erkennen.
Hosts
Puccinia striiformis ist ein Krankheitserreger von Gräsern und Getreidepflanzen: Weizen, Gerste, Triticale und Roggen. Der Streifenrost ist der einzige Rost bei Weizen, der sich konsequent über den ersten Infektionspunkt in der Pflanze hinaus ausbreitet.
Stellvertretende Gastgeber
Es sind nur die Telial- und Uredinialstadien des Streifenrostes bekannt. Eriksson und Henning (1894) suchten den Zwischenwirt unter den Arten der Boraginaceae. Tranzschel (1934) schlug vor, dass Aecidium valerianellaein Rost von Baldrianella, könnte verwandt sein mit P. striiformis. Mains (1933) meinte, dass P. koeleriae Arth., P. arrhenatheri Eriks. und P. montanensis Ellisdie auf Berberis und Mahonia spp. aecidial vorkommen, könnten verwandt sein mit P. striiformis.
Straib (1937) und Hart und Becker (1939) hatten keinen Erfolg bei ihren Versuchen, die Berberis, Mahonie und Valerianella spp.. Der alternative Wirt des Rostes, P. agropyri Ell. & Ev., ist Klematis vitalba. Dieser Rost ähnelt stark P. striiformis So schlug Viennot-Bourgin (1934) vor, dass der Alternativwirt des Streifenrostes in der Familie der Clematis vorkommen könnte. Teliosporen keimen leicht und bilden sofort Basidiosporen (Wright und Lennard, 1980), und die Teliosporen dienen dem Pilz wahrscheinlich nicht als Überlebensmechanismus im Winter. Ein epidemiologischer Faktor, der berücksichtigt werden muss, ist die Möglichkeit einer Infektion des Zwischenwirts im Spätsommer, so dass Aeciosporen den frisch gesäten Weizen oder die späten Gräser der kühlen Jahreszeit infizieren könnten. In einigen hochgelegenen Gebieten Westasiens kann es 13 Monate dauern, bis die Weizenernte reif ist. In solchen Fällen wäre eine Infektion des Zwischenwirts zu Beginn der Frühjahrssaison möglich.
Lebenszyklus
Puccinia striiformis ist höchstwahrscheinlich ein hemiformer Rost, da der Lebenszyklus nur aus dem Uredienstadium und dem Telienstadium zu bestehen scheint. Die Uredien entwickeln sich in Form von schmalen, gelben, linearen Streifen hauptsächlich auf Blättern und Ährchen (Tafel 20). Wenn die Köpfe infiziert sind, erscheinen die Pusteln auf den Innenflächen der Spelzen und Deckspelzen (Tafel 21). Die Urediniosporen sind gelb bis orangefarben, mehr oder weniger kugelförmig, echinulär und 28 bis 34 µm im Durchmesser (Tafel 22). Während der Telialentwicklung bilden sich auf den Blättern schmale schwarze Streifen. Die Teliosporen sind dunkelbraun, zweizellig und ähneln in Größe und Form denjenigen von P. triticina (Tafel 23). Streifenrostpopulationen können existieren, ihre Virulenz verändern und zu Epidemien führen, unabhängig von einem alternativen Wirt. Urediniosporen sind die einzige bekannte Quelle für das Inokulum von Weizen, und sie keimen und infizieren bei kühleren Temperaturen.
Quelle: Die Weizenroste: R.P. Singh, J. Huerta-Espino, A.P. Roelfs
Puccinia striiformis Infektionsmodell
Puccinia striiformis ist der Weizenrost der kühlen Klimazonen, der sein Temperaturoptimum bereits ab 15°C hat. Seine Infektionen finden nach einigen Stunden Blattnässe bei optimalen Temperaturbedingungen statt. Der Pilz kann über einen weiten Temperaturbereich infizieren. Das Modell geht davon aus, dass eine Infektion eine akkumulierte stündliche Lufttemperatur von 80°C Blattnässe in einem Lufttemperaturbereich von 5°C bis 20°C benötigt. In Perioden mit geringer Lichtintensität kommt es zu keinen Infektionen.
Blattnässe und Licht für akkumulierte stündliche Durchschnittstemperaturen für 80°C
- (wenn T
- 5°C < Temp. < 20°C
Bei FieldClimate wurde eine Infektion mit P. striiformis ist am 23. August nach einer langen Periode der Blattnässe bei Temperaturen um 15°C zu sehen (rote Linie). Nach dieser Infektion müssen kurative Pflanzenschutzstrategien in Betracht gezogen werden (systemisch), während vor Erreichen einer Infektion von 100% Schutzmaßnahmen ergriffen werden können.
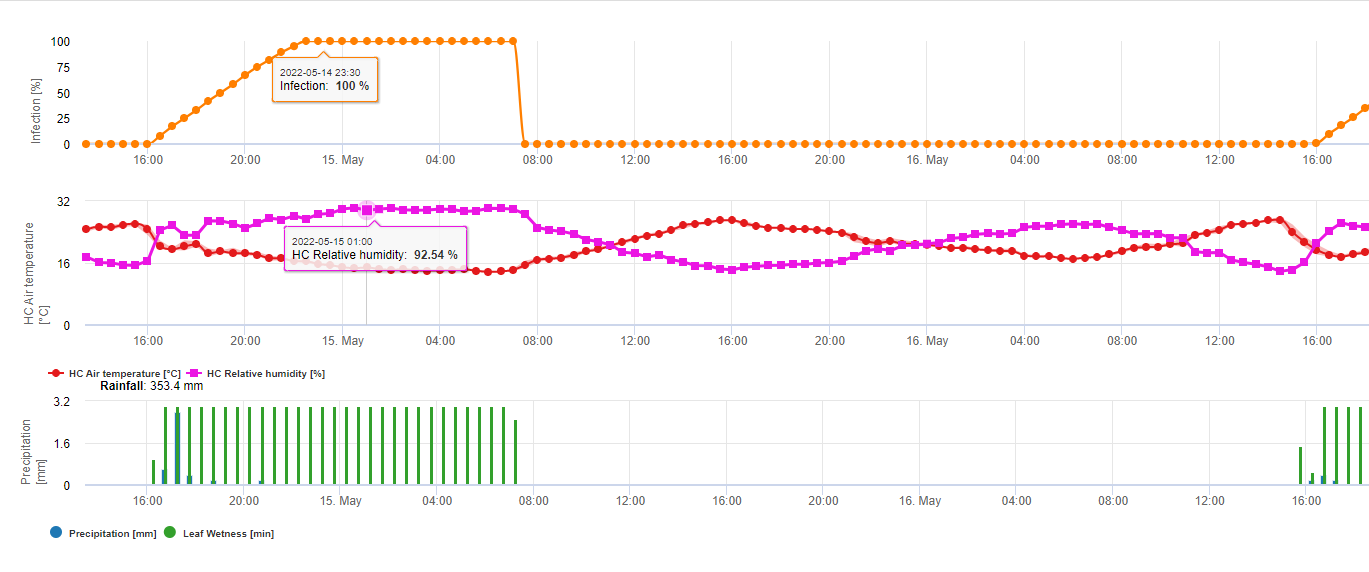
Fusarium-Krankheit
Fusarium-Kopffäule oder Schorf bei kleinen Körnern wird verursacht durch den Pilz Fusarium graminearum (Schwabe), obwohl die Niederlande und andere Gebiete in Mitteleuropa F. culmorum als die am weitesten verbreitete Art (Snidjers, 1989). In Polen, F. culmorum, F. graminearum und F. nivale haben ähnliche mäßige bis schwere Virulenzwerte gezeigt, während F. avenaceum hat sich als mittel bis mäßig virulent erwiesen. In mehreren Studien zur Identifizierung des verursachenden Organismus wurden jedoch bis zu 18 Fusarium spp.. wurden isoliert und identifiziert (Mihuta-Grimm und Foster, 1989; Reis, 1985).
Artikel von L. GilchristH.J. Dubin Der Schorf tritt vor allem in feuchtwarmen Regionen auf, in denen die Blütezeit mit Regenperioden zusammenfällt. Das Auftreten dieser Krankheit hat in den letzten zehn Jahren aus verschiedenen Gründen zugenommen. Der vielleicht wichtigste Grund ist die Ausweitung der Anbauflächen, auf denen Weizen im Wechsel mit Mais oder anderen Getreidesorten angebaut wird. Weitere Gründe sind Änderungen des Anbausystems zum Schutz des Bodens und die Verlagerung des Weizenanbaus von traditionellen in feuchtere, nicht-traditionelle Gebiete (Gilchrist et al., 1997).
Fusarienschorf verursacht weltweit schwere Produktionsverluste, die bis zu 50 % betragen können. Auch in Paraguay begünstigten die Witterungsbedingungen in den Jahren 1972 und 1975 Fusarium- und Septoria-Epidemien, die zusammen zu Verlusten von bis zu 70 % führten (Viedma, 1989). Polen, die Niederlande, das Vereinigte Königreich, die ehemalige Tschechoslowakei, die Russische Föderation, Frankreich und Österreich sind einige der europäischen Länder, die das Auftreten von Schorf melden. Auf dem amerikanischen Kontinent sind Gebiete in Kanada, den Vereinigten Staaten, Mexiko, Guatemala, Brasilien, Ecuador, Uruguay und Argentinien stark von Fusarium betroffen (Ireta und Gilchrist, 1994).
Schorf kann zu erheblichen Ertrags- und Qualitätseinbußen sowie zu Vergiftungen bei Tieren und Menschen führen (Ireta und Gilchrist, 1994; Baht et al., 1989; Luo, 1988; Snidjers, 1989; Marasas et al., 1988). Der durch Schorf verursachte Schaden in den Vereinigten Staaten wurde 1993 auf mehr als $1 Milliarde US und 1994 auf $500 Millionen US geschätzt. In China schätzt man, dass in Epidemiejahren bis zu 7 Mio. ha von Schorf befallen werden können und 2,5 Mio. t Getreide verloren gehen können. Krankheiten im Zusammenhang mit Fusarienmykotoxinen wurden beim Menschen in China, Indien und Japan festgestellt, während bei Tieren in zahlreichen Teilen der Welt Krankheiten festgestellt wurden (Dubin et al., 1997).
Heute gibt es weltweit Vorschriften für Mykotoxine (Van Egmond und Dekker, 1995). In vielen Ländern werden die Vorschriften jedoch nicht angewandt, und viele Menschen, vor allem in ländlichen Gebieten, verzehren das Getreide ohne jegliche Kontrolle, entweder als Getreidekörner oder in indirekter Form als Fleisch von Tieren, die mit kontaminiertem Getreide gefüttert wurden. Tabelle 16.1 zeigt die wichtigsten Auswirkungen auf Schweine und Geflügel durch die wichtigsten Toxine, die von einigen Fusarium Arten.
Feuchte und warme Witterungsbedingungen zwischen dem Ährenschieben und der Reife erhöhen den Schorfbefall. Der Eintrittspunkt von F. graminearum ist die Ähre, insbesondere die Blütenorgane. Dies beeinträchtigt den Samenansatz und die Kornfüllung. Befallene Ährchen verlieren schnell Chlorophyll und werden blass. Später färben sie sich rosa oder pfirsichfarben, vor allem an der Basis und den Rändern der Hüllspelzen (Tafel 41). Wenn die Umweltbedingungen weiterhin günstig sind, breitet sich die Infektion auf die benachbarten Ährchen aus und kann in einigen Fällen die gesamte Ähre einschließlich der Spindel und des Stiels befallen. Bei schwerem Befall sind die beschädigten Körner mit Myzelien bedeckt und sehen aus wie eine rosafarbene, watteartige Masse. Bei mäßigem Befall können die Körner schrumpelig sein, ein geringes Gewicht aufweisen und weißlich gefärbt sein (Grabsteinkörner).
Die wichtigsten toxischen Wirkungen der wichtigsten Toxine einiger Fusarium-Arten auf Schweine und Geflügel
| Mykotoxin | Klinische Anzeichen |
| Zearalenon | Geschwollene rote Vulva; Vaginalprolaps bei Schweinen; Saugferkel können vergrößerte Vulva aufweisen; Fruchtbarkeitsstörungen |
| Vomitoxin (Desoxynivalenol, DON) | Verminderte Futteraufnahme und Gewichtszunahme bei Schweinen mit DON >2 mg/kg Futter; Erbrechen; Futterverweigerung bei sehr hohen DON-Konzentrationen (>20 mg/kg Futter)a |
| Andere Trichothecene T-2-Toxin HT-2-Toxin Diacetoxyescirpenol> | Giftiger als DON; verringerte Futteraufnahme; Erbrechen; Haut- und Magen-Darm-Reizung; Neurotoxizität; abnorme Nachkommen; erhöhte Krankheitsanfälligkeit; Hämorrhagie |
| Ocharatoxin | Befall vor allem der proximalen Tubuli der Nieren bei Schweinen und Geflügel; die Nieren sind stark vergrößert und blass; Fettleber bei Geflügel |
amg/kg = Teile pro Million (ppm).
Quelle: Trenholm et al., 1984.
Fusarium graminearum (Tafel 42) kann Weizenpflanzen in allen Wachstumsstadien befallen und Sämlings-, Stengel- und Wurzelfäule verursachen. Primärinfektionen können entweder von Ascosporen oder Makrokonidien ausgehen, die auf Spelzen und ausgefahrenen Staubbeuteln abgelagert werden. Temperaturen von 10° bis 30°C und eine relative Luftfeuchtigkeit von über 95 % für 40 bis 60 Stunden reichen in der Regel aus, damit die Makrokonidien die Ähren erfolgreich infizieren können (Ireta, 1989).
Fusarium graminearum ist eine der wenigen Fusarium Art, die unter Feldbedingungen Perithecien produziert (Tafel 43, Tafel 44). Perithecien stellen das sexuelle Stadium des Pilzes Gibberella zeae dar und werden auf Weizenspelzen gebildet. Perithezien spielen eine wichtige Rolle für das Überleben des Erregers von Jahr zu Jahr (Khonga und Sutton, 1988) und koexistieren mit Myzelien in den Rückständen der vorherigen Ernte, um die anfängliche Inokulumquelle für Schorf zu bilden. In China durchgeführte Untersuchungen haben gezeigt, dass die niedrigste Temperatur für die Bildung von Perithecien 7° bis 10°C und die günstigste 15° bis 20°C beträgt. Der niedrigste Feuchtigkeitsgehalt des Bodens für die Bildung von Perithecien lag bei 50 bis 60 %, der geeignetste bei 70 bis 80 % (Wang, 1997).
Zu den Faktoren, die die Krankheitsentwicklung bestimmen, gehören Klima, Inokulummenge und Wachstumsstadium des Weizens. Weizenschorfepidemien hängen hauptsächlich von der Menge des primären Inokulums und weniger vom sekundären Inokulum ab. Die Invasion erfolgt meist während der Blütezeit. Die Sekundärinfektion mit Konidien (Tafel 45) erfolgt nach dem Erscheinen der kranken Ähren auf dem Feld.
Ernterückstände und kulturelle Praktiken spielen eine wichtige Rolle bei der Erhaltung von F. graminearum und infolgedessen Epidemien. Infektionen auf Weizen, der in ein Feld mit Maisrückständen gesät wurde, können zwei- bis dreimal so schwerwiegend sein (Teich und Nelson, 1984). Im Allgemeinen war der Erreger nur saprophytisch auf Reisstoppeln in den Reis-Weizen-Rotationsgebieten und auf Maisstängeln in den Trockenanbaugebieten Chinas (Wang, 1997). Wenn die Rückstände untergepflügt werden, sinkt die Überlebensrate der Perithecien und reduziert die primäre Inokulumquelle (Reis, 1989).
Fusarium graminearum ist ein fakultativer Parasit und pathogen für viele andere Gräser, einschließlich gängiger Unkräuter und Getreidekulturen (Roggen, Reis, Gerste und Triticale). Wenn Praktiken wie die Fruchtfolge mit Nicht-Wirtspflanzen oder die Bewirtschaftung von Ernterückständen allein nicht wirksam sind, können sie in Kombination die Quelle des primären Inokulums reduzieren. Die wirksame Krankheitsbekämpfung basiert auf einem integrierten Management, das angemessene agronomische Praktiken, die Verwendung resistenter oder toleranter Sorten und den Einsatz von Chemikalien umfasst.
Biologie der Fusarium-Kopffäule
Gelegentliche Krankheitserreger
FHB wird durch Pilzarten der Gattung Fusarium verursacht. Die häufigste Art, die FHB verursacht, ist Fusarium graminearum (sexuelles Stadium - Gibberella zeae). Dieser Pilz ist derselbe, der häufig mit der Stängelfäule von Mais in Verbindung gebracht wird. Eine weitere Fusarium Art, die FHB verursacht, ist Fusarium culmorum. Beide F. graminearum und F. culmorum kann auch Wurzelfäule bei kleinen Körnern verursachen. Bei Gerste sind zwei weitere Fusarium Arten, F. poae und F. avenaceumkann auch die Kernfäule verursachen.
Überleben und Ausbreitung
Der Pilz überdauert und vermehrt sich auf infizierten Ernterückständen von Kleingetreide und Mais. Bei feuchtem Wetter werden die Sporen des Pilzes vom Wind verweht oder auf die Köpfe der Getreidepflanzen gespritzt. Die Sporen können aus dem Inneren einer Kultur stammen oder von umliegenden Kulturen, manchmal über große Entfernungen, verweht werden. Weizen- und Hartweizenkulturen sind von der Blüte (Bestäubung) bis zum Hartteigstadium der Kornentwicklung anfällig für Infektionen. Die Sporen des verursachenden Pilzes können zur Blütezeit auf den freiliegenden Staubbeuteln landen und dann in die Körner, Spelzen oder andere Teile des Kopfes einwachsen. Bei Sommergerste, die blüht, wenn sich der Kopf im Stiefel befindet, ist die Infektion nach der Blütezeit am häufigsten, sobald der Kopf die Blattscheide durchbricht. Die Infektion kann in beiden Kulturen bis kurz vor der Kornreife andauern, wenn die Umweltbedingungen für den Organismus/die Organismen günstig sind.
Die günstigsten Bedingungen für eine Infektion sind längere Perioden (48 bis 72 Stunden) mit hoher Luftfeuchtigkeit und warmen Temperaturen (75 bis 85 Grad Fahrenheit (24°C bis 30°C)). Die Infektion erfolgt jedoch auch bei kühleren Temperaturen, wenn die hohe Luftfeuchtigkeit länger als 72 Stunden anhält. Bei frühen Infektionen können Sporen in der Luft entstehen, die für die sekundäre Ausbreitung der Krankheit verantwortlich sind, vor allem, wenn die Kultur aufgrund von Spätaustrieben eine ungleichmäßige Blüte aufweist.
Da die Entwicklung von FHB von der Blüte (Kopfaufgang bei Gerste) bis zur Kornentwicklung von günstigen Umweltbedingungen abhängt, variieren das Auftreten und die Schwere der Krankheit von Jahr zu Jahr. Eine Kombination von Faktoren, die zu den schwersten Ertrags- und Qualitätseinbußen führen können, sind: reichlich Inokulum, längere oder wiederholte Perioden von Nässe und hoher Luftfeuchtigkeit während der Blüte (Kopfaufgang bei Gerste) bis zur Kornentwicklung und die Verwendung einer sehr anfälligen Sorte.
Fusarium Head Blight Infektionsmodell
Es ist bekannt, dass die Pilzerreger des Fusarium Head Blight-Komplexes auf Weizen durch warme Temperaturen von 20 °C bis 30 °C und lange Feuchteperioden begünstigt werden. Mehrtägige Blattnässeperioden führen zu früh sichtbaren Syptomen. Symptome können aber auch nach einer längeren Latenzzeit auftreten, wenn auf die Infektion eine Blattnässeperiode von 18 Stunden oder noch kürzer folgt. Symptome können auch nach künstlicher Inokulation bei Temperaturen von 15°C auftreten.
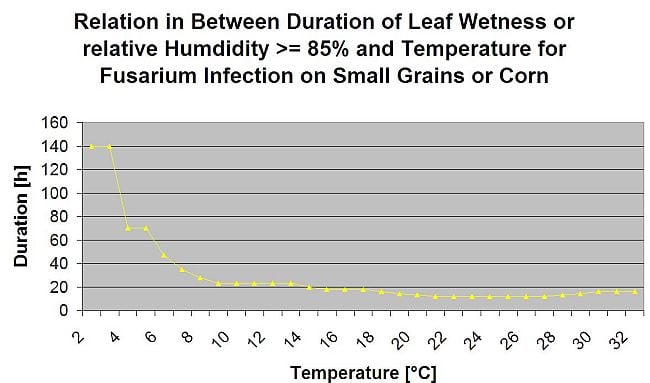


Bei der Zusammenfassung der verschiedenen Temperatur- und Feuchtigkeitskombinationen, die wir in der Literatur gefunden haben, sind wir zu dem Schluss gekommen, dass Fusarium-Kopfschimmel-Infektionen auftreten, wenn die Temperatur- und Blattnässeperioden oder Perioden mit einer relativen Luftfeuchtigkeit von mehr als 85% die in der folgenden Grafik dargestellten Werte überschreiten.
Die Infektionen werden durch einen Regen von 2 mm ausgelöst. Von einer Fusarium-Kopffieber-Infektion kann ausgegangen werden, wenn der Wert für den Infektionsfortschritt 100% erreicht. Die Berechnung dieses Fortschrittswertes folgt der Beziehung zwischen der Dauer der feuchten Bedingungen und der Temperatur, die in der obigen Grafik dargestellt ist.
Dieses Modell dient zur Visualisierung der Infektionstage und der Klimabedingungen während des Klimas. Das Wissen der Landwirte über das Entwicklungsstadium der verschiedenen Weizensorten gibt ihnen die Möglichkeit, unmittelbar nach der Infektion eine kurative Spritzung vorzunehmen.
Fusarium-Mykotoxin-Alarm
Infektionsversuche mit längeren Blattnässeperioden von Fusarium-Kopffäule führen zu hohen Mykotoxingehalten. Aus diesen Informationen geht hervor, dass eine Blattnässeperiode von 48 Stunden oder mehr während der Stadien 61 und 69 ein hohes Risiko für Mykotoxine darstellt. Die Erfahrungen bei der Analyse von DON in kommerziell angebautem Weizen haben gezeigt, dass ausreichend lange Blattnässeperioden für eine Infektion nach einer Erstinfektion in den Stadien 61 bis 69 auch die DON-Werte erhöhen können. Bei längeren Blattnässeperioden können Mykotoxine bis zum Stadium 85 ansteigen. FieldClimate akkumuliert einen Risikowert proportional zum Infektionsfortschritt für jede erfolgreiche Infektionsperiode über den Zeitraum, der für diese Berechnungen als geeignet ausgewählt wurde. 6 gerade abgeschlossene Infektionsperioden würden zu einem Risiko von 100% führen. Normalerweise ist die Blattnässeperiode, die zu einer Fusarieninfektion führt, länger als im Minimum erforderlich. Daher führen die meisten Fusarieninfektionen zu einer Risikoerhöhung von mehr als 17%. Der Risikowert, der auf eine problematische Mykotoxinsituation hinweist, hängt von der Feldgeschichte ab. Weizen, der nach Mais ohne Bodenbearbeitung oder Weizen ohne Bodenbearbeitung nach Mais ohne Bodenbearbeitung angebaut wird, kann nur ein geringes Risiko bergen, wenn er nicht zum optimalen Zeitpunkt gespritzt wird. Bei ungespritztem Weizen muss man bereits nach 35% mit erhöhten DON-Werten rechnen. Weizen nach unbestelltem Weizen, der auf eine andere Kultur als Mais oder Weizen folgt, kann ein höheres Risiko von 50% bergen. Bei Weizen nach Mais oder Weizen mit Bodenbearbeitung kann sich das Risiko auf 70% erhöhen. Weizen im ersten Jahr sollte auf DON getestet werden, wenn das Risiko über 100% liegt.
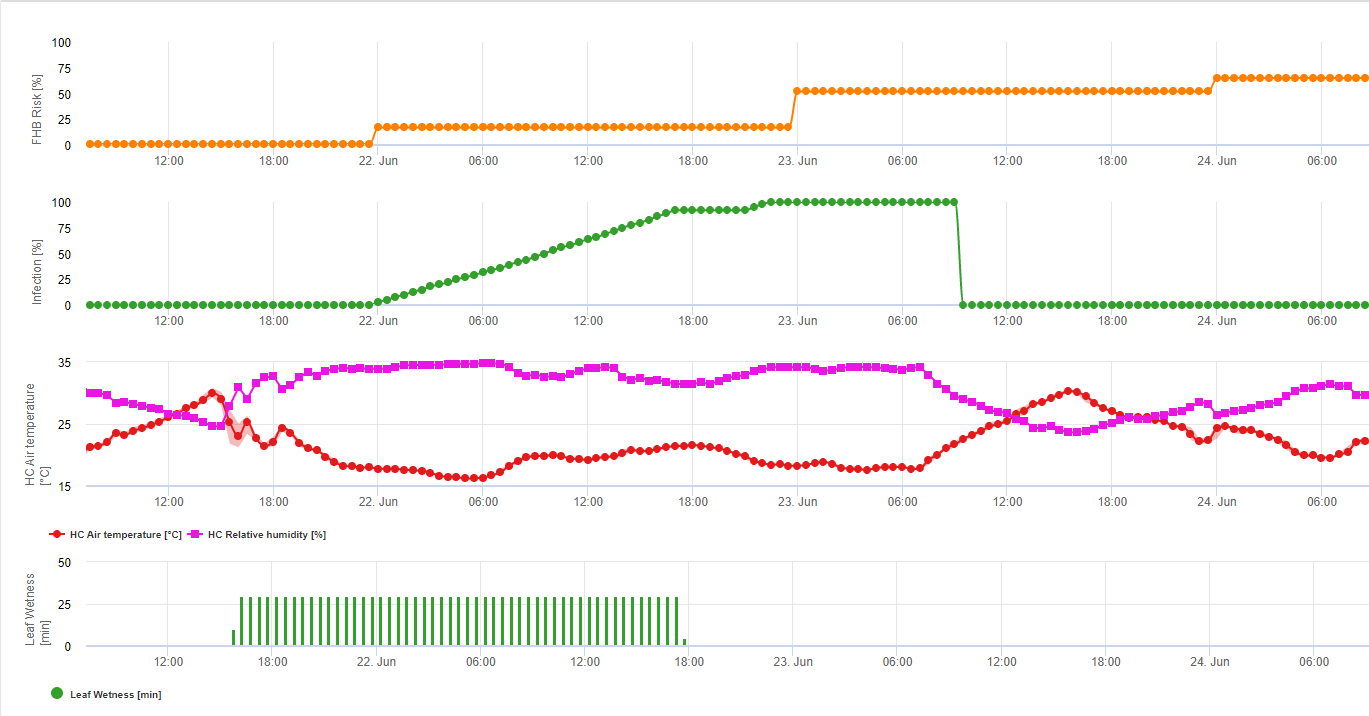
1) Fusarium Head Blight Risikomodell die die risikoreichen Zeiträume für eine Infektion angibt. Immer dann, wenn 100%-Infektionen (grüne Linie) erreicht werden, ist das Risiko (blaue Linie) sehr hoch und die Bedingungen für den Pilz waren günstig für eine Infektion. In Abhängigkeit von der Anwendungsmethode (kurativ, präventiv) wird der risikoreiche Zeitraum durch die blaue Linie dargestellt.
2) Fusarium Head Blight: In diesem Modell wird die Infektion des FHB durch Niederschlag (2 mm erforderlich), relative Luftfeuchtigkeit (über 85%) oder Blattnässe, Temperatur während des Prozesses berechnet. Wenn die Infektion 100% erreicht, sind optimale Bedingungen für den Pilzerreger gegeben. Des Weiteren berechnet das Modell das FHB-Mykotoxinrisiko.
Gefleckte Blattfleckenkrankheit
Es gibt zwei wichtige Septoria-Krankheiten bei Weizen. Es handelt sich um die Septoria tritici-Fleckenkrankheit, die durch den Pilz ausgelöst wird Septoria tritici (Teleomorph: Mycophaerella graminicola), und Septoria nodorum Fleckenkrankheit, verursacht durch den Pilz Septoria nodorum (Teleomorph: Leptosphaeria nodorum). Beide Krankheiten verursachen schwere Ertragseinbußen, die Berichten zufolge zwischen 31 und 53 Prozent liegen (Eyal, 1981; Babadoost und Herbert, 1984; Polley und Thomas, 1991). Weltweit sind mehr als 50 Millionen Hektar Weizen betroffen, die hauptsächlich in niederschlagsreichen Gebieten wachsen. In den letzten 25 Jahren haben diese Krankheiten zugenommen und sind in bestimmten Gebieten zu einem wichtigen limitierenden Faktor für die Weizenproduktion geworden. Bei schweren Epidemien schrumpfen die Körner anfälliger Weizensorten und sind nicht mehr mahlfähig. Epidemien der Septoria tritici-Fleckenkrankheit und der Septoria nodorum-Fleckenkrankheit des Weizens stehen in Zusammenhang mit günstigen Witterungsbedingungen (häufige Regenfälle und gemäßigte Temperaturen), bestimmten Anbaumethoden, der Verfügbarkeit von Inokulum und dem Vorhandensein anfälliger Weizensorten (Eyal et al., 1987).
Septoria spp. Biologie
Nach Erick De Wolf, Septoria Tritici Blotch, Kansas State University, April 2008 Septoria tritici Fleck, der als gefleckter Blattfleck bekannt ist, wird durch den Pilz Septoria tritici. Sie ist in allen Weizenanbaugebieten der Welt verbreitet und stellt in vielen Regionen ein ernstes Problem dar. Der Septoria tritici-Fleck ist am schädlichsten, wenn die Krankheit die oberen Blätter und Köpfe anfälliger Sorten spät in der Saison befällt.
Symptome
Septoria tritici Die Fleckensymptome treten erstmals im Herbst auf. Die ersten Symptome sind kleine gelbe Flecken auf den Blättern. Diese Läsionen werden mit zunehmendem Alter oft hellbraun, und die Pilzfruchtkörper sind in den Läsionen an den Grannen eingebettet zu sehen. Die Läsionen sind unregelmäßig geformt und reichen von elliptisch bis lang und schmal (Abbildung 1). Die Läsionen enthalten kleine, runde, schwarze Sprenkel, die die Fruchtkörper des Pilzes darstellen. Die schwarzen Fruchtkörper sehen aus wie schwarze Pfefferkörner und sind in der Regel auch ohne Lupe zu erkennen. Die Krankheit beginnt an den unteren Blättern und breitet sich allmählich auf das Fahnenblatt aus. Auch die Blattscheiden sind anfällig für den Befall. In feuchten Jahren kann der gesprenkelte Blattfleckenpilz auf die Köpfe übergehen und braune Läsionen auf den Hüllspelzen und Grannen verursachen, die als Hüllspelzenfleck bekannt sind. Diese Läsionen werden mit zunehmendem Alter oft hellbraun, und die Pilzfruchtkörper sind oft in den Läsionen an den Grannen eingebettet.
Die Spelzenfäule kann zu erheblichen Ertragseinbußen führen, aber der Zusammenhang zwischen der Schwere der Krankheit und den Ertragseinbußen ist nicht genau bekannt. Septoria tritici Flecken können mit anderen Blattkrankheiten verwechselt werden, die sehr ähnliche Symptome aufweisen: Bräunungsflecken und Stagonspora nodorum Fleckenkrankheit, zum Beispiel. In der Regel sind die Pflanzen von mehr als einer dieser Blattkrankheiten befallen, und es kann eine Laboruntersuchung erforderlich sein, um genau zu bestimmen, welche Krankheiten am häufigsten vorkommen. Eine Laboruntersuchung ist fast immer erforderlich, um die Ursache der Spelzenfleckenkrankheit zu bestimmen. Die Kenntnis der Art ist für Spritzentscheidungen nicht wichtig, da alle drei Krankheiten ähnlich auf Fungizide ansprechen. Für die Sortenwahl ist es jedoch wichtig zu wissen, welche Krankheiten am häufigsten vorkommen, da die Resistenz gegen die Krankheiten von verschiedenen Genen gesteuert wird.
Die zuverlässigste Methode, den Septoria tritici-Fleck von den anderen Krankheiten zu unterscheiden, ist das Vorhandensein der schwarzen Pilzfruchtkörper. Der Pilz, der die Bräunungsfleckenkrankheit verursacht, bildet diese Art von Fortpflanzungsorganen nicht aus. Der Pilz, der den Stagonospora nodorum-Fleck verursacht, bildet jedoch unter feuchten Bedingungen hellbraune Fruchtkörper aus. Abgesehen von dem Farbunterschied sind diese Strukturen auch kleiner als die von Septoria tritici.
Lebenszyklus
Septoria tritici überlebt den Sommer über auf den Rückständen einer früheren Weizenernte und beginnt im Herbst mit der Infektion. Es gibt einige Hinweise darauf, dass der Pilz in Verbindung mit anderen Graswirten und Weizensamen überleben kann. Diese Quellen für den Pilz sind wahrscheinlich am wichtigsten, wenn keine Weizenrückstände vorhanden sind. Unabhängig von der Fruchtfolge oder der Rückstandsbewirtschaftung ist in der Regel genügend Inokulum vorhanden, um Herbstinfektionen auszulösen. Septoria tritici Fleckenkrankheit wird durch kühles, feuchtes Wetter begünstigt. Der optimale Temperaturbereich liegt bei 16 bis 21 °C; Infektionen können jedoch auch in den Wintermonaten bei Temperaturen von bis zu 5 °C auftreten. Die Infektion erfordert mindestens 6 Stunden Blattnässe, für eine maximale Infektion sind bis zu 48 Stunden Nässe erforderlich. Nach der Infektion benötigt der Pilz 21 bis 28 Tage, um die charakteristischen schwarzen Fruchtkörper zu entwickeln und eine neue Generation von Sporen zu produzieren. Die in diesen Fruchtkörpern produzierten Sporen werden in klebrigen Massen ausgeschieden und benötigen Regen, um sie auf die oberen Blätter und Köpfe zu spritzen.
Infektion durch Septoria tritici
Pyknidiensporen von S. tritici keimen in freiem Wasser aus beiden Enden der Spore oder aus Zwischenzellen (Weber, 1922). Die Sporenkeimung beginnt erst etwa 12 Stunden nach dem Kontakt mit dem Blatt. Die Keimschläuche wachsen willkürlich über die Blattoberfläche. Weber (1922) beobachtete nur die direkte Penetration zwischen den Epidermiszellen, andere Forscher kamen jedoch zu dem Schluss, dass die Penetration durch offene und geschlossene Spaltöffnungen das wichtigste Mittel für das Eindringen in den Wirt ist (Benedict, 1971; Cohen und Eyal, 1993; Hilu und Bever, 1957). Kema et al. (1996) beobachteten nur die Stomata-Penetration. Hyphen, die durch Spaltöffnungen wachsen, verengen sich auf einen Durchmesser von etwa 1 μm und werden dann breiter, wenn sie die substomatäre Höhle erreichen.
Die Hyphen wachsen parallel zur Blattoberfläche unter den Epidermiszellen, dann durch das Mesophyll zu den Zellen der unteren Epidermis, aber nicht in die Epidermis. Es werden keine Haustorien gebildet, und das Hyphenwachstum wird durch Sklerenchymzellen um die Gefäßbündel herum begrenzt, außer wenn die Hyphen sehr dicht sind. Gefäßbündel werden nicht durchdrungen. Die Hyphen wachsen interzellulär entlang der Zellwände durch das Mesophyll und verzweigen sich an einem Septum oder in der Mitte einer Zelle. Etwa 9 Tage lang treten keine makroskopischen Symptome auf, abgesehen von einer gelegentlichen toten Zelle, aber nach 11 Tagen sterben die Mesophyllzellen rasch ab. Die Pyknidien entwickeln sich in substomatalen Kammern. Die Hyphen wachsen nur selten in die Wirtszellen ein (Hilu und Bever, 1957; Kema et al, 1996; Weber, 1922).
Eine erfolgreiche Infektion erfolgt erst nach mindestens 20 Stunden hoher Luftfeuchtigkeit. Nur wenige braune Flecken entstanden, wenn die Blätter 5-10 Stunden nach der Sporenablage feucht blieben (Holmes und Colhoun, 1974) oder bis zu 24 Stunden (Kema et al., 1996). Die Wirt-Parasit-Beziehungen sind bei resistenten und anfälligen Weizenarten gleich. Die Sporenkeimung auf der Blattoberfläche ist unabhängig von der Anfälligkeit die gleiche. Die Zahl der erfolgreichen Penetrationen ist ungefähr gleich, aber das Hyphenwachstum ist bei den anfälligen Sorten schneller, was zu mehr Läsionen führt. Die Hyphen reichen bei allen Sorten über den nekrotischen Bereich hinaus. 44 Sitzung 2 - B.M. Cunfer Ein Toxin könnte bei der Pathogenese eine Rolle spielen (Cohen und Eyal, 1993; Hilu und Bever, 1957). Im Gegensatz dazu war die Kolonisierung bei einer resistenten Linie stark reduziert (Kema et al., 1996).
Stagonospora (Septoria) und Septoria-Pathogene des Getreides: Der Infektionsprozess
B.M. Cunfer, Abteilung für Pflanzenpathologie, Universität von Georgia, Griffin, GA
Der Infektionsprozess wurde am intensivsten für Stagonospora (Septoria) nodorum und Septoria tritici. Eine eingehende Studie über Septoria passerinii verfügbar ist. Fast alle Informationen beziehen sich auf die Infektion durch Pyknidiensporen. Der Infektionsprozess für andere Sporenformen ist jedoch recht ähnlich. Die vorliegenden Informationen beziehen sich meist auf die Infektion von Blättern unter optimalen Bedingungen. Einige Studien wurden an intakten Sämlingspflanzen durchgeführt, andere an abgetrennten Blättern. Infektion der Weizenkoleoptile und des Keimlings durch S. nodorum wurde von Baker (1971) ausführlich beschrieben und von Cunfer (1983) überprüft. Obwohl keine genauen Vergleiche angestellt wurden, hat es den Anschein, dass der Infektionsprozess in jedem Wirt-Parasit-System viele Ähnlichkeiten aufweist und typisch für viele nekrotrophe Krankheitserreger ist. Informationen über Faktoren, die die Entwicklung von Symptomen und die Ausprägung der Krankheit beeinflussen, sind nicht vorhanden, wurden aber von anderen Autoren geprüft (Eyal et al., 1987; King et al., 1983; Shipton et al., 1971). Eine Zusammenfassung der Faktoren, die die Langlebigkeit der Sporen auf der Blattoberfläche beeinflussen, ist enthalten.
Die Rolle des Cirrus und das Überleben der Sporen auf der Blattoberfläche Die detailliertesten Informationen über die Funktion der Zirren, die die aus dem Pyknidium ausgeschiedenen Pyknidiensporen umhüllen, sind für S. nodorum. Der Zirrus ist ein Gel, das aus Protein- und Saccharidverbindungen besteht. Seine Zusammensetzung und Funktion sind ähnlich wie bei anderen Pilzen der Sphaeropsidales (Fournet, 1969; Fournet et al., 1970; Griffiths und Peverett, 1980). Die Hauptaufgaben der Zirruskomponenten sind der Schutz der Pyknidiensporen vor Austrocknung und die Verhinderung einer vorzeitigen Keimung.
Die Zirruslösung schützt die Pyknidiosporen, so dass einige von ihnen mindestens 28 Tage lang lebensfähig bleiben (Fournet, 1969). Wurde der Cirrus mit Wasser verdünnt, keimten bei einer Konzentration der Cirruslösung von >20% weniger als 10% der Pyknidiensporen. Bei einer niedrigeren Konzentration liefern die Komponenten Nährstoffe, die die Keimung der Sporen und die Verlängerung der Keimschläuche stimulieren. Die Länge der Keimschläuche nahm bis zu einer Zirruskonzentration von 15% zu und ging dann bei höheren Konzentrationen mäßig zurück (Harrower, 1976). Brennan et al. (1986) berichteten über eine stärkere Keimung in verdünnter Zirrusflüssigkeit. Zirruskomponenten verringerten die Keimung bei einer relativen Luftfeuchtigkeit von 10-60%. Sobald die Sporen verteilt sind, ist die stimulierende Wirkung der Zirrusflüssigkeit wahrscheinlich vernachlässigbar (Griffiths und Peverett, 1980).
Bei einer relativen Luftfeuchtigkeit von 35-45% werden Sporen von S. tritici in Zirren mindestens 60 Tage lang lebensfähig blieben (Gough und Lee, 1985). Die Bestandteile der Zirren können die Keimung der Sporen hemmen, oder das hohe osmotische Potential der Zirren kann die Keimung verhindern. Pyknidiensporen von S. nodorum überlebten keine 24 Stunden bei einer relativen Luftfeuchtigkeit von über 80% bei 20 C. Sporen überlebten zwei Wochen oder länger bei einer relativen Luftfeuchtigkeit von <10% (Griffiths und Peverett, 1980). Wenn die Zirrusflüssigkeit von S. nodorum mit Wasser verdünnt wurde, verloren etwa zwei Drittel der Pyknidiensporen innerhalb von 8 Stunden ihre Lebensfähigkeit, und nach 30 Stunden bei Tageslicht keimten nur 5%. Wurden die Sporen im Dunkeln gelagert, blieben 40% nach 30 Stunden lebensfähig (Brennan et al., 1986).
Trockene Konidien von S. nodorumim Schatten und bei direkter Sonneneinstrahlung mindestens 56 Stunden im Freien überlebten (Fernandes und Hendrix, 1986a). Die Keimung der Pyknidiensporen von S. nodorum wurde durch kontinuierliche UV-B-Bestrahlung (280-320 nm) gehemmt, während die Keimung von S. tritici war es nicht. Die Ausdehnung der Keimschläuche unter kontinuierlicher UV-B-Strahlung wurde bei beiden Pilzen im Vergleich zur Dunkelheit gehemmt (Rasanayagam et al., 1995).
Infektion durch Septoria nodorum
Der Prozess des Eindringens in den Wirt und die Entwicklung von S. nodorum innerhalb des Blattes wurde von mehreren Forschern eingehend untersucht (Baker und Smith, 1978, Bird und Ride 1981, Karjalainen und Lounatmaa, 1986; Keon und Hargreaves, 1984; Straley, 1979; Weber, 1922). Die Pyknidiensporen setzen sich in der Regel in den Vertiefungen zwischen zwei Epidermiszellen fest, und viele Versuche, in das Blatt einzudringen, beginnen dort. Die Sporen keimen auf der Blattoberfläche als Reaktion auf freie Feuchtigkeit (Fernandes und Hendrix, 1986b). Sie beginnen 2-3 Stunden nach der Ablagerung zu keimen, und nach 8 Stunden kann die Keimung 90% erreichen. Das Eindringen in die Blätter beginnt etwa 10 Stunden nach der Ablagerung der Sporen (Bird und Ride, 1981; Brönnimann et al., 1972; Holmes und Colhoun, 1974).
Zu Beginn der Keimung ist der Keimschlauch von einem amorphen Material umgeben, das mit dem Blatt verwachsen ist. Keimschläuche, die aus beiden Enden einer Spore und aus Zwischenzellen wachsen, neigen dazu, entlang der Vertiefungen zwischen den Zellen zu wachsen und sind oft entlang der Längsachse des Blattes ausgerichtet (O'Reilly und Downes, 1986). Die Hyphen von Sporen, die sich nicht in Vertiefungen befinden, wachsen willkürlich und verzweigen sich gelegentlich (Straley, 1979). Es bildet sich ein Appressorium mit einem Infektionszapfen, der die Kutikula und die periklinen Wände der Epidermiszellen direkt in das Zelllumen durchdringt, was zu einem schnellen Zelltod führt.
Viele Penetrationen erfolgen zunächst subkutikulär oder durch seitliches Wachstum der Hyphen innerhalb der Zellwand, bevor sie in das Zytoplasma eindringen (Bird und Ride, 1981; O'Reilly und Downes, 1986). Das Eindringen durch offene und geschlossene Spaltöffnungen erfolgt ebenfalls und kann schneller sein als das direkte Eindringen (Harrower, 1976; Jenkins, 1978; O'Reilly und Downes, 1986; Straley, 1979). Die Keimschläuche verzweigen sich an den Spaltöffnungen und den Verbindungsstellen der Epidermiszellen. Das Eindringen eines Keimschlauches in eine Spaltöffnung kann ohne Bildung eines Appressoriums erfolgen. Manchmal erfolgt das Eindringen durch Trichome (Straley, 1979). Offenbar scheitern die meisten Penetrationsversuche, wobei sich in den Zellen an der Stelle des versuchten Eindringens dichte Papillen bilden (Karjalainen und Lounatmaa, 1986; Bird und Ride, 1981).
Nach dem Eindringen sterben die Epidermiszellen schnell ab und verholzen, und die Hyphen wachsen in das Mesophyll. Die Mesophyllzellen verformen sich, und verholztes Material lagert sich außerhalb einiger Zellen ab, die dann kollabieren. Die Verholzung erfolgt, bevor die Hyphen die Zelle erreichen. Der Prozess ist bei allen Sorten gleich, entwickelt sich aber bei resistenten Sorten langsamer. Die Hyphen wachsen interzellulär zwischen den Epidermiszellen und dann in das Mesophyll. Wenn das Mesophyll durchdrungen ist, beginnt die Zerstörung der Chloroplasten innerhalb von 6-9 Tagen (Karjalainen und Lounatmaa, 1986).
Die Photosyntheserate beginnt jedoch innerhalb eines Tages nach der Infektion und vor dem Auftreten von Symptomen zu sinken (Krupinsky et al., 1973). Sklerenchymgewebe um die Gefäßbündel verhindert eine Infektion des Gefäßgewebes. Die Gefäßbündel blockieren die Ausbreitung der Hyphen durch das Mesophyll, es sei denn, das Sklerenchymgewebe ist noch jung und nicht vollständig ausgebildet (Baker und Smith, 1978).
Stagonospora nodorum setzt in vitro und während der Infektion von Weizenblättern ein breites Spektrum an zellwandabbauenden Enzymen frei, darunter Amylase, Pektinmethylesterase, Polygalacturonasen, Xylanasen und Cellulase (Baker, 1969; Lehtinen, 1993; Magro, 1984). Die Informationen über den Zellwandabbau durch Enzyme stimmen mit histologischen Beobachtungen überein, wobei diese Enzyme in Verbindung mit Toxinen wirken können. Die Enzymempfindlichkeit kann mit der Resistenz und der Geschwindigkeit der Pilzbesiedlung zusammenhängen (Magro, 1984). Wie viele Nekrotrophen produzieren auch Septoria- und Stagonospora-Pilze in vitro phytotoxische Verbindungen. Das Absterben und der Tod von Zellen vor dem Wachstum der Hyphen in das Mesophyllgewebe (Bird und Ride, 1981) steht im Einklang mit der Toxinproduktion. Eine endgültige Rolle der Toxine im Infektionsprozess und ihr Zusammenhang mit der Wirtsresistenz ist jedoch noch nicht nachgewiesen (Bethenod et al., 1982; Bousquet et al., 1980; Essad und Bousquet, 1981; King et al., 1983). Unterschiede im Wirtsspektrum zwischen weizen- und gerstenadaptierten Stämmen von S. nodorum kann mit der Toxinproduktion zusammenhängen (Bousquet und Kollmann, 1998). Der Beginn der Sporenkeimung und der prozentuale Anteil der gekeimten Sporen werden durch die Wirtsanfälligkeit nicht beeinflusst (Bird und Ride, 1981; Morgan 1974; Straley, 1979; Straley und Scharen, 1979; Baker und Smith, 1978).
Bird und Ride (1981) berichteten, dass die Ausdehnung der Keimschläuche auf der Blattoberfläche bei resistenten Sorten langsamer war als bei anfälligen Sorten. Dieser Mechanismus, der mindestens 48 Stunden nach der Sporenablage zum Tragen kommt, deutet auf eine Resistenz gegen die Ausdehnung der Keimschläuche vor dem Eindringen hin. Bei resistenten Sorten gab es weniger erfolgreiche Penetrationen, und die Penetration verlief bei resistenten Sorten langsamer (Baker und Smith, 1978; Bird und Ride, 1981). Es wurde angenommen, dass die Lignifizierung die Infektion sowohl bei resistenten als auch bei anfälligen Sorten einschränkt, aber andere Faktoren verlangsamten die Entwicklung des Pilzes bei resistenten Linien. Bei anfälligen Linien können schneller wachsende Hyphen der Lignifizierung der Wirtszellen entgehen. Vier Tage nach der Inokulation von Gerste mit einem Weizenbiotyp-Isolat von S. nodorumDie Hyphen wuchsen durch die Kutikula und manchmal durch die äußeren Zelluloseschichten der epidermalen Zellwände. Unter den Penetrationshyphen lagerten sich dicke Papillen ab, und die Zellen wurden nicht durchdrungen (Keon und Hargreaves, 1984).
Infektion durch Septoria passerinii
Green und Dickson (1957) legen eine detaillierte Beschreibung des Infektionsprozesses von S. passerinii auf Gerste. Der Infektionsprozess ist ähnlich wie bei S. tritici. Wie bei S. tritici ist die Zeitspanne, die für die Durchdringung der Blätter erforderlich ist, wesentlich länger als bei S. nodorum. Die Keimschläuche verzweigen sich und wachsen wahllos über die Blattoberfläche, manchmal aber auch entlang der Vertiefungen zwischen den Epidermiszellen. Das Eindringen in das Blatt erfolgt fast ausschließlich über die Spaltöffnungen. Die Keimhyphen schwellen an, und wenn die Penetration erfolglos bleibt, dehnen sich die Hyphen weiter aus. 48 Stunden nach der Sporenablage findet keine Penetration mehr statt. Nach 72 Stunden verdicken sich die Keimschläuche über den Spaltöffnungen, wachsen zwischen den Wächterzellen und auf den Stirnflächen der Nebenzellen sowie in die substomatären Hohlräume. Ein direktes Eindringen zwischen Epidermiszellen ist nur selten zu beobachten.
Die Sporenkeimung und das Eindringen in den Wirt sind bei resistenten und anfälligen Sorten gleich. Die Ausdehnung der Hyphen innerhalb der Blätter ist bei resistenten Sorten viel geringer, und Papillen werden auf vielen, aber nicht auf allen Zellwänden beobachtet. Die Hyphen wachsen unter der Epidermis von einem Stoma zum anderen, dringen aber nicht zwischen die Epidermiszellen ein. Das Mesophyll ist kolonisiert, aber es bilden sich keine Haustorien. Nachdem die Mesophyllzellen nekrotisch geworden sind, kollabieren die Epidermiszellen. Die Myzelentwicklung im Blatt ist spärlich und wird in der Regel durch Gefäßbündel blockiert. In jüngeren Blättern, wenn die Gefäßscheide weniger entwickelt ist, dringen die Hyphen zwischen dem Bündel und der Epidermis hindurch. Pyknidien bilden sich in substomatalen Hohlräumen, meist auf der Blattoberseite (Green und Dickson, 1957).
Faktoren, die die Langlebigkeit von Sporen beeinflussen auf der Blattoberfläche Von den Stagonospora- und Septoria-Erregern des Getreides sind endgültige Informationen über den Infektionsprozess nur für folgende Arten bekannt S. nodorum, S. triticiund S. passerinii. Wie viele andere nekrotrophe Krankheitserreger lösen auch diese beiden Erregergruppen keine Überempfindlichkeitsreaktion aus. Ein wesentlicher Unterschied im Infektionsprozess zwischen Septoria- und Stagonospora-Erregern besteht darin, dass die Sporenauskeimung und -penetration bei S. nodorum als für S. tritici und S. passerinii. Dies hat einen erheblichen Einfluss auf die Epidemiologie von Krankheiten.
Die Septoria-Erreger dringen hauptsächlich über die Spaltöffnungen in die Pflanze ein, während S. nodorum dringt sowohl direkt als auch über die Spaltöffnungen ein. S. nodorum dringt in die Epidermiszellen ein und tötet sie schnell ab, aber S. tritici und S. passerinii töten die Epidermiszellen erst ab, wenn sich die Hyphen durch das Blattmesophyll verzweigt haben und eine schnelle Nekrose einsetzt. Histologische Untersuchungen des Pilzwachstums nach dem Eindringen in den Wirt stimmen mit den Daten überein, die aus epidemiologischen Studien zur Wirtsresistenz gewonnen wurden. Die Resistenz verlangsamt die Geschwindigkeit der Wirtskolonisierung, hat aber keine nennenswerten Auswirkungen auf die Entwicklung der Läsionen.
Die Mechanismen, die die Reaktion des Wirts steuern, ob sie nun mit Enzymen und Toxinen oder anderen Stoffwechselprodukten zusammenhängen, die von den Erregern während der Infektion freigesetzt werden, sind noch unklar. Es gibt nur wenige Informationen über die Infektion durch Ascosporen. Der Infektionsprozess ist wahrscheinlich dem der Pyknidiensporen sehr ähnlich. Die Ascosporen von Phaeosphaeria nodorum keimen in einem breiten Temperaturbereich, und ihre Keimschläuche dringen direkt in das Blatt ein. Nach Rapilly et al. (1973) keimen die Ascosporen jedoch im Gegensatz zu den Pyknidiensporen nicht in freiem Wasser.
Septoria spp. Infektionsmodell
Septoria-Infektionen sind bei niedrigen Temperaturen möglich, wobei Temperaturen unter 7°C nicht unbedingt innerhalb von 2 Tagen zu einer Infektion führen. Das Temperaturoptimum der Krankheit wird im Bereich von 16 bis 21°C erreicht. Infektionen sind bei einer hohen relativen Luftfeuchtigkeit oder Blattnässe von 14 Stunden oder länger möglich. Um den Bedingungen gerecht zu werden, haben wir uns entschlossen, in Modelle für schwache, mittlere und schwere Infektionen zu unterteilen. Schwache Infektionen können gegeben sein, wenn es dem Erreger möglich ist, das Wirtsgewebe zu infizieren. Das bedeutet, dass eine schwache Infektion stattfinden kann, wenn die Temperaturen im Minimalbereich liegen und die Blattnässeperioden von kritischer Dauer sind. Eine mäßige Infektion findet unter Bedingungen statt, bei denen die meisten Infektionsversuche zu vernünftigen Ergebnissen führen, und eine schwere Infektion findet unter Bedingungen statt, bei denen der Erreger optimale Infektionsbedingungen vorfindet.
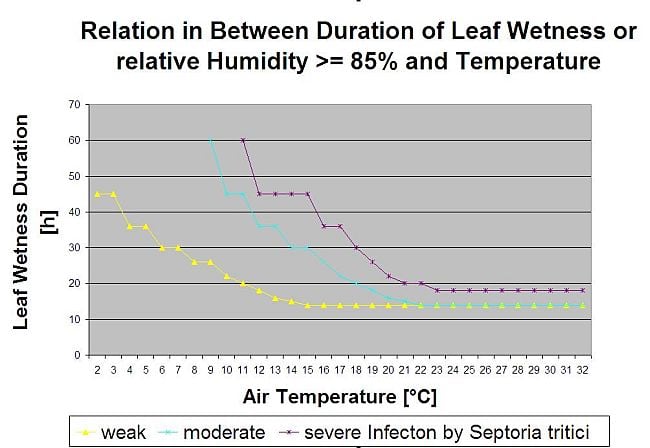


Die Infektion beginnt nach einem Regen von 0,5 mm. Wir haben beschlossen, kein Modell für die Pyknidienbildung zu verwenden. Als Voraussetzung für die Pyknidienbildung wird ein Zeitraum mit einer relativen Luftfeuchtigkeit von mehr als 85% angenommen. Die Lebensdauer der Pyknidien wird auf 24 Stunden geschätzt. In allen Klimazonen, in denen Septoria tritici eine Chance hat, sich zu infizieren, werden wir 2 Stunden finden, die diese Bedingungen an fast jedem Tag um den Sonnenaufgang herum erfüllen.
Bewertung des Schweregrads der Infektion
Um den Infektionsdruck durch Septoria tritici zwischen dem Stadium 10 (erstes Blatt durch die Koleoptile) und dem Stadium 32 (zweiter Knoten mindestens 2 cm über dem ersten Knoten) sowie zwischen 32 und 51 (Beginn des Blattaustriebs) beurteilen zu können, müssen wir den Schweregrad der Infektionen anhand der klimatischen Bedingungen bewerten. Diese Bewertung erfolgt auf einer Skala von 1 bis 5. Ein Schweregrad von 1 wird vergeben, wenn die Bedingungen für eine schwache Infektion erfüllt sind und es weniger als 5 mm geregnet hat, andernfalls ist der entsprechende Schweregrad 2. Ein Schweregrad von 3 wird vergeben, wenn eine mäßige Infektion erfüllt ist und es weniger als 5 mm geregnet hat. Wenn es bei einer mäßigen Infektion mehr als 5 mm oder bei einer schweren Infektion weniger als 5 mm geregnet hat, wird ein Schweregrad von 4 vergeben.
Eine schwere Infektion mit mehr als 5 mm Regen entspricht einem Schweregrad von 5.
Septoria tritici Bewertung des Krankheitsdrucks
Das Klima ist nur ein Faktor, der über den Krankheitsdruck im Feld entscheidet. Die beiden anderen Faktoren sind die Geschichte des Feldes und die Anfälligkeit der angebauten Sorte. Wenn wir die Krankheitsschwerewerte von Stadium 10 bis Stadium 32 auf einen Wert von 4 akkumulieren können, können wir einen schwachen Krankheitsdruck durch das Klima erwarten. Erreicht dieser Wert den Wert 6, ist mit einem mäßigen Krankheitsdruck zu rechnen, und wenn er den Wert 10 erreicht, ist mit einem hohen Krankheitsdruck durch das Klima zu rechnen. Wenn wir die Anfälligkeit der Sorte und die Vorgeschichte des Feldes kennen, können wir in dieser Situation bei schwachem oder mittlerem Krankheitsdruck spritzen oder nicht. Ein akkumulierter Wert von 10 kann in jedem Fall zu einer Spritzung im Stadium 32 führen. Die Entscheidung für eine Spritzung in einem späteren Stadium hängt eher vom Frühjahrsklima ab. Wenn es uns gelingt, die Schweregrade seit Stadium 10 auf einen Wert von 6 zu akkumulieren, können wir mit einem schwachen Krankheitsdruck rechnen. Erreicht dieser Wert 10, so ist mit einem mittleren Krankheitsdruck zu rechnen und erreicht dieser Wert 15, so ist aufgrund der klimatischen Situation mit einem hohen Krankheitsdruck zu rechnen.
In FieldClimate zeigen wir die Septoria tritici Schweregrad zusammen mit den drei verschiedenen Infektionsschweregraden in einer Grafik (siehe oben). Aufgrund der Niederschläge und der langen Blattnässeperioden sind die Bedingungen für eine schwere Infektion durch S. tritici wurden am 14. und 16. Mai voll erfasst. Die Schweregrade erreichen am 14. Mai den höchsten Wert von 5, was bedeutet, dass jetzt ein hohes Infektionsrisiko besteht.
Die Infektionsbiologie von Stagonospora nodorum unterscheidet sich in gewissem Maße von der von S. tritici, aber dieser Unterschied ist nicht groß genug für ein eigenes Modell. Daher schlagen wir vor, dieses Modell für den gesamten Komplex der Stagnospora- und Septoria-Krankheiten bei Getreide zu verwenden, einschließlich S. passerinii. S. tritici und S. passerinii benötigen in der Regel längere Blattnässeperioden als S. nodorum. In Gebieten mit einem hohen Druck von S. nodorum Infektionen, die als schwach eingestuft werden und einen Schweregrad von 2 aufweisen, sollten ernster behandelt werden als in anderen Bereichen.
Für Septoria nodorum ein Risikomodell ist in FieldClimate dargestellt (siehe oben). Ein hohes Risiko wurde am 17. Juni und 7. Juli (100%) festgestellt. Je nach dem Stadium der anfälligen Pflanzen für eine Infektion müssen Pflanzenschutzmaßnahmen in Betracht gezogen werden, wenn das Risiko 80% erreicht (siehe auch Wettervorhersage, Pflanzenschutz). Liegt das Risiko bei 100% und wurde bereits eine Infektion festgestellt, müssen systemische Pflanzenschutzmaßnahmen (kurative Anwendung) ergriffen werden, um die Pflanze zu schützen.
Reissprengung
In den Tropen sind die Pilzsporen das ganze Jahr über in der Luft vorhanden, was eine kontinuierliche Entwicklung der Krankheit begünstigt. Die durch den Pilz hervorgerufene Infektion schädigt den Hochlandreis stärker als den bewässerten Reis. Er befällt selten die Blattscheiden. Die Primärinfektion beginnt dort, wo das Saatgut dicht in Setzlingskisten für die mechanische Verpflanzung ausgesät wird.
In den Ländern mit gemäßigtem Klima übersiedelt er in befallenen Ernterückständen oder im Saatgut. Bewölkter Himmel, häufiger Regen und Nieselregen begünstigen die Entwicklung und den Schweregrad der Reisbräune. Ein hoher Stickstoffgehalt, eine hohe relative Luftfeuchtigkeit und feuchte Blätter begünstigen die durch den Pilz verursachte Infektion. Die Sporulationsrate ist mit zunehmender relativer Luftfeuchtigkeit von 90% oder höher am höchsten. Bei Blattnässe liegt die optimale Temperatur für die Keimung des Erregers bei 25-28 °C. Der Anbau von Reis in aeroben Böden in Feuchtgebieten, in denen Trockenstress vorherrscht, begünstigt ebenfalls die Infektion.
Ein Pilz verursacht die Reisbräune. Seine Konidiophoren werden in Büscheln aus jedem Stoma gebildet. Selten sind sie einzeln mit 2-4 Septen. Der basale Bereich der Konidiophoren ist geschwollen und verjüngt sich zum helleren Apex hin. Die Konidien des Pilzes sind 20-22 x 10-12 µm groß. Die Konidien sind 2-septatig, durchscheinend und leicht verdunkelt. Sie sind verkehrt eiförmig und verjüngen sich am Apex. An der Basis sind sie abgestumpft oder zu einem kurzen Zahn verlängert.
Außer auf der Reispflanze überlebt der Pilz auch auf Agropyron repens (L.) Gould, Agrostis palustris, A. tenuis, Alopecurus pratensis, Andropogon sp., Anthoxanthum odoratum, Arundo donax L., Avena byzantina, A. sterilis, A. sativa, Brachiaria mutica (Forssk.) Stapf, Bromus catharticus, B. inermis, B. sitchensis, Canna indica, Chikushichloa aquatica, Costus speciosus, Curcuma aromatica, Cynodon dactylon (L.) Pers, Cyperus rotundus L., C. compressus L., Dactylis glomerata, Digitaria sanguinalis (L.) Scop, Echinochloa crus-galli (L.) P. Beauv, Eleusine indica (L.) Gaertn., Eragrostis sp., Eremochloa ophiuroides, Eriochloa villosa, Festuca altaica, F. arundinacea, F. elatior, F. rubra, Fluminea sp, Glyceria leptolepis, Hierochloe odorata, Holcus lanatus, Hordeum vulgare, Hystrix patula, Leersia hexandra Sw., L. japonica, L. oryzoides, Lolium italicum, L. multiflorum, L. perenne, Muhlenbergia sp, Musa sapientum, Oplismenus undulatifolius (Ard.) Roem. & Schult., Panicum miliaceum L., P. ramosum (L.) Stapf, P. repens L., Pennisetum typhoides (L.) R. Br., Phalaris arundinacea L., P. canariensis, Phleum pratense, Poa annua L., P. trivialis, Saccharum officinarum, Secale cereale, Setaria italica (L.) P. Beauv, S. viridis (L.) P. Beauv., Sorghum vulgare, Stenotaphrum secundatum, Triticum aestivum, Zea mays L., Zingiber mioga, Z. officinale, und Zizania latifolia.
Die Konidien werden etwa 6 Tage nach der Inokulation auf den Läsionen der Reispflanze gebildet. Die Sporenproduktion steigt mit zunehmender relativer Luftfeuchtigkeit. Die meisten Sporen werden in der Nacht produziert und freigesetzt. Nach der Keimung der Sporen folgt die Infektion. Aus den Appressorien bilden sich Infektionsschläuche, die später durch die Kutikula und die Epidermis dringen. Nach dem Eindringen in die Zelle bildet der Infektionsschlauch ein Vesikel, aus dem sich Hyphen bilden. In der Zelle wachsen die Hyphen frei.
Die Reisbräune befällt die Reispflanze in jedem Wachstumsstadium. Reissetzlinge oder Pflanzen im Bestockungsstadium werden oft vollständig abgetötet. Ebenso führen schwere Infektionen an den Rispen in der Regel zu Ertragseinbußen bei Reis.
Anthraknose
Das Modell der R. solani in den Feldern bewertet das Risiko für diese Krankheit auf der Grundlage von Temperatur, Blattnässe und Globalstrahlung. Die Kontrollen dauern 120 Stunden:
- Bei fortlaufender Blattnässe akkumuliert es die Temperatur in Abhängigkeit von den Werten für jede Minute.
- 12 °C bis 15 °C fällt 1 pro Minute an
- 16 °C bis 17 °C werden 2 pro Minute angesammelt
- 18°C und mehr akkumuliert er 4 pro Minute - Am Ende der Blattnässeperioden wertet sie die kumulierten Werte aus
- wenn sie größer als 4096 sind, wird das Risiko um 64 Punkte erhöht und 4096 von dem Wert abgezogen>
- wenn der Restwert größer als 2048 ist, wird das Risiko um 16 erhöht und 2048 vom Wert abgezogen
- wenn der Restwert größer als 1024 ist, wird das Risiko um 4 erhöht und 1024 vom Wert abgezogen - Wenn die Globalstrahlung konsekutiv höher als 800 W/m² ist, akkumulieren Sie die Zeit in Minuten, und wenn die Strahlung niedriger wird, bewerten Sie die Werte:
- Wert > 512 = RiskValue - 32 Punkte , Wert - 512
- Wert > 256 = RiskValue - 8 Punkte , Wert - 256
- Wert >128= RisKValue - 2 Punkte, Wert -128
Das Modell ergibt einen Risikowert zwischen 0 und 100, der die Zeiten angibt, die günstig sind für R. solani auf den Feldern.
Unterstützungssystem
Das Modell für die Kraut- und Knollenfäule weist auf Zeiträume mit einem hohen Risiko für diese Krankheit hin. In Zeiträumen mit geringem Risiko müssen keine Spritzungen durchgeführt werden. In Zeiträumen mit mäßigem Risiko kann das Spritzintervall verlängert werden, und in Zeiträumen mit hohem Risiko muss das Spritzintervall möglicherweise verkürzt werden oder es müssen wirksamere Mittel verwendet werden.
Literatur
Rostkrankheiten
- Anikster, Y., Bushnell, W.R., Eilam, T., Manisterski, J. & Roelfs, A.P. 1997. Puccinia recondita als Verursacher von Blattrost bei Kulturweizen, Wildweizen und Roggen. Can. J. Bot., 75: 2082-2096.
- Azbukina, Z. 1980. Economical importance of aecial hosts of rust fungi of cereals in the Soviet Far East. In Proc. 5th European and Mediterranean Cereal Rusts Conf., S.199-201. Bari, Rom.
- Beresford, R.M. 1982. Streifenrost (Puccinia striiformis), eine neue Krankheit des Weizens in Neuseeland. Cer. Rusts Bull., 10: 35-41.
- Biffen, R.H. 1905. Die Mendelschen Vererbungsgesetze und die Weizenzucht. J. Agric. Sci., 1: 4-48.
- Borlaug, N.E. 1954. Mexican wheat production and its role in the epidemiology of stem rust in North America. Phytopathologie, 44: 398-404.
- Buchenauer, H. 1982. Chemische und biologische Bekämpfung von Getreiderost. In K.J. Scott & A.K. Chakravorty, eds. The rust fungi, S. 247-279. London, Academic Press.
- Burdon, J.J., Marshall, D.R. & Luig, N.H. 1981. Isozymanalyse zeigt, dass ein virulenter Getreiderost-Erreger ein somatischer Hybrid ist. Natur, 293: 565-566.
- Casulli, F. 1988. Overseasoning of wheat leaf rust in southern Italy. In Proc. 7th European and Mediterranean Cereal Rusts Conf., 5-9 Sept., S. 166-168. Wien.
- Chester, K.S. 1946. Natur und Vorbeugung der Getreideroste am Beispiel des Blattrostes von Weizen. In Chronica botanica. Walthan, MA, USA. 269 pp.
- Craigie, J.H. 1927. Experimente zum Geschlecht bei Rostpilzen. Nature, 120: 116-117.
- Cummins, G.B. & Caldwell, R.M. 1956. The validity of binomials in the leaf rust fungus complex of cereals and grasses. Phytopathology, 46: 81-82.
- Cummins, G.B. & Stevenson, J.A. 1956. Eine Checkliste der nordamerikanischen Rostpilze (Uredinales). Plant Dis. Rep. Suppl., 240: 109-193.
- d'Oliveira, B. & Samborski, D.J. 1966. Aecial stage of Puccinia recondita on Ranunculaceae and Boraginaceae in Portugal. In Proc. Cereal Rusts Conf., Cambridge, S. 133-150.
- DeBary, A. 1866. Neue Untersuchungen über die Uredineen insbesondere die Entwicklung der Puccinia graminis und den Zusammenhang duselben mit Aecidium berberis. In Monatsber Preuss. Akad. Wiss., Berlin, S. 15-20.
- de Candolle, A. 1815. Uredo rouille des cereales. In Flora francaise, famille des champignons, S. 83.
- Dubin, H.J. & Stubbs, R.W. 1986. Epidemische Ausbreitung des Gersten-Streifenrostes in Südamerika. Plant Dis., 70: 141-144.
- Dubin, H.J. & Torres, E. 1981. Ursachen und Folgen der Weizenblattrostepidemie 1976-1977 in Nordwestmexiko. Ann. Rev. Phytopath, 19: 41-49.
- Eriksson, J. 1894. Über die Spezialisierung des Parasitismus bei dem Getreiderostpilzen. Ber. Deut. Bot. Ges., 12: 292-331.
- Eriksson, J. & Henning, E. 1894. Die Hauptresultate einer neuen Untersuchung über die Getreideroste. Z. Pflanzenkr., 4: 66-73, 140-142, 197-203, 257-262.
- Eriksson, J. & Henning, E. 1896. Die Getreideroste. Ihre Geschichte und Natur sowie Massregein gegen dieselben, S. 463. Stockholm, P.A. Norstedt und Soner.
- Ezzahiri, B., Diouri, S. & Roelfs, A.P. 1992. The-Role of the alternate host, Anchusa italica, in the epidemiology of Puccinia recondita f. sp. tritici on durum wheats in Morocco. In F.J. Zeller & G. Fischbeck, eds. Proc. 8th European and Mediterranean Cereal Rusts and Mildews Conf., 1992, S. 69-70. Heft 24 Weihenstephan, Deutschland.
- Fontana, F. 1932. Beobachtungen über den Getreiderost. P.P. Pirone, übersetzt. Classics No. 2. Washington, DC, Amer. Phytopathol. Society. (Ursprünglich veröffentlicht 1767).
- Green, G.J. & Campbell, A.B. 1979. Gegen Puccinia graminis tritici resistente Weizensorten in Westkanada: ihre Entwicklung, Leistung und ihr wirtschaftlicher Wert. Can. J. Plant Pathol., 1: 3-11.
Groth, J.V. & Roelfs, A.P. 1982. The effect of sexual and asexual reproduction on race abundance in cereal rust fungus populations. Phytopathologie, 72: 1503-1507. - Hare, R.A. & McIntosh, R.A. 1979. Genetische und zytogenetische Untersuchungen über die dauerhafte Resistenz erwachsener Pflanzen gegen Weizenrost bei 'Hope' und verwandten Sorten. Z. Pflanzenzüchtg, 83: 350-367.
- Hart, H. & Becker, H. 1939. Beiträge zur Frage des Zwischenwirts für Puccinia glumarum Z. Pflanzenkr. (Pflanzenpathol.) Pflanzenschutz, 49: 559-566.
- Hendrix, J.W., Burleigh, J.R. & Tu, J.C. 1965. Oversummering of stripe rust at high elevations in the Pacific Northwest-1963. Plant Dis. Rep., 49: 275-278.
- Hermansen, J.E. 1968. Untersuchungen über die Ausbreitung und das Überleben von Getreiderost- und Mehltaukrankheiten in Dänemark. Contrib. No. 87. Kopenhagen, Abteilung für Pflanzenpathologie, Königliches Vet. Agriculture College. 206 Seiten.
- Hirst, J.M. & Hurst, G.W. 1967. Long-distance spore transport. In P.H. Gregory & J.L. Monteith, eds. Airborne microbes, S. 307-344. Cambridge University Press.
- Hogg, W.H., Hounam, C.E., Mallik, A.K. & Zadoks, J.C. 1969. Meteorologische Faktoren, die die Epidemiologie des Weizenrostes beeinflussen. WMO Tech. Note No. 99. 143 pp.
- Huerta-Espino, J. & Roelfs, A.P. 1989. Physiologische Spezialisierung auf Blattrost bei Hartweizen. Phytopathologie, 79: 1218 (abstr.).
- Hylander, N., Jorstad, I. & Nannfeldt, J.A. 1953. Enumeratio uredionearum Scandinavicarum. Opera Bot., 1: 1-102.
- Johnson, R. 1981. Dauerhafte Krankheitsresistenz. In J.F. Jenkyn & R.T. Plumb, eds. Strategies for control of cereal diseases, S. 55-63. Oxford, UK, Blackwell.
- Johnson, T. 1949. Intervarietale Kreuzungen bei Puccinia graminis. Can. J. Res. Sect. C, 27: 45-63.
- Joshi, L.M. & Palmer, L.T. 1973. Epidemiologie von Stamm-, Blatt- und Streifenrost bei Weizen in Nordindien. Plant Dis. Rep., 57: 8-12.
- Katsuya, K. & Green, G.J. 1967. Reproduktionspotentiale der Rassen 15B und 56 des Weizenstängelrostes. Can. J. Bot., 45: 1077-1091.
- Kilpatrick, R.A. 1975. Neue Weizensorten und Langlebigkeit der Rostresistenz, 1971-1975. USDA, Agric. Res. Serv. Northeast Reg (Rep.), ARS-NE 64. 20 pp.
- Le Roux, J. & Rijkenberg, F.H.J. 1987. Pathotypen von Puccinia graminis f. sp. tritici mit erhöhter Virulenz für Sr24. Plant Dis., 71: 1115-1119.
- Lewellen, R.T., Sharp, E.L. & Hehn, E.R. 1967. Haupt- und Nebengene in Weizen für die Resistenz gegen Puccinia striiformis und ihre Reaktion auf Temperaturänderungen. Can. J. Bot., 45: 2155-2172.
- Line, R.F. 1976. Factors contributing to an epidemic of stripe rust on wheat in the Sacramento Valley of California in 1974. Plant Dis. Rep., 60: 312-316.
- Line, R.F., Qayoum, A. & Milus, E. 1983. Dauerhafte Resistenz gegen Streifenrost bei Weizen. In Proc. 4th Int. Cong. Plant Pathol., S. 204. Melbourne.
- Luig, N.H. 1985. Epidemiologie in Australien und Neuseeland. In A.P. Roelfs & W.R. Bushnell, eds. Cereal rusts, vol. 2, Diseases, distribution, epidemiology, and control, p. 301-328. Orlando, FL, USA, Academic Press.
- Luig, N.H. & Rajaram, S. 1972. The effect of temperature and genetic background on host gene expression and interaction to Puccinia graminis tritici. Phytopathologie, 62: 1171-1174.
- Luig, N.H. & Watson, I.A. 1972. The role of wild and cultivated grasses in the hybridization of formae speciales of Puccinia graminis. Aust. J. Biol. Sci., 25: 335-342.
- Maddison, A.C. & Manners, J.G. 1972. Sunlight and viability of cereal rust urediospores. Trans. Br. Mycol. Soc., 59: 429-443.
- Mains, E.B. 1932. Host specialization in the leaf rust of grasses Puccinia rubigovera. Mich. Acad. Sci., 17: 289-394.
- Mains, E.B. 1933. Studien über heterözischen Rost. Mycologia, 25: 407-417.
- Mains, E.B. & Jackson, H.S. 1926. Physiologische Spezialisierung beim Blattrost des Weizens, Puccinia triticina Erikss. Phytopathologie, 16: 89-120.
- Manners, J.G. 1960. Puccinia striiformis Westend. var. dactylidis var. nov. Trans. Br. Mycol. Soc., 43: 65-68.
- McIntosh, R.A. 1976. Genetik des Weizens und der Weizenroste seit Farrer: Farrer-Gedenkrede 1976. J. Aust. Inst. Agric. Sci., 42: 203-216.
- McIntosh, R.A. 1992. Close genetic linkage of genes conferring adult-plant resistance to leaf rust and stripe rust in wheat. Plant Pathol, 41: 523-527.
- McIntosh, R.A., Luig, N.H., Milne, D.L. & Cusick, J. 1983. Die Anfälligkeit von Triticale für Weizenstängelrost. Can. J. Plant Pathol., 5: 61-69.
- McIntosh, R.A., Hart, G.E., Devos, K.M., Gale, M.D. & Rogers, W.J. 1998. Katalog der Gensymbole für Weizen. In Proc. 9th Int. Wheat Genetics Symp., 2-7 Aug. 1998. Saskatoon Saskatchewan, Kanada.
- Melander, L.W. & Craigie, J.H. 1927. Nature of resistance of Berberis spp. to Puccinia graminis. Phytopathologie, 17: 95-114.
- Mont, R.M. 1970. Untersuchungen zur unspezifischen Resistenz gegen Stängelrost bei Sommerweizen. M.Sc. thesis. St. Paul, MN, USA, Universität von Minnesota. 61 pp.
- Nagarajan, S. & Joshi, L.M. 1985. Epidemiologie auf dem indischen Subkontinent. In A.P. Roelfs & W.R. Bushnell, eds. The cereal rusts, vol. 2, Diseases, distribution, epidemiology, and control, S. 371-402. Orlando, FL, USA, academic Press.
- O'Brien, L., Brown, J.S., Young, R.M. & Pascoe, T. 1980. Vorkommen und Verbreitung von Weizen-Streifenrost in Victoria und Anfälligkeit von kommerziellen Weizensorten. Aust. Plant Pathol. Soc. Newsl., 9: 14.
- Perez, B. & Roelfs, A.P. 1989. Resistenz gegen Weizenblattrost bei Landsorten und deren Derivaten. Phytopathologie, 79: 1183 (abstr.).
- Pretorius, Z.A., Singh, R.P., Wagoire, W.W. & Payne, T.S. 2000. Nachweis der Virulenz des Weizenstängelrost-Resistenzgens Sr31 bei Puccinia graminis f. sp. tritici in Uganda. Phytopathologie, 84: 203.
- Rajaram, S., Singh, R.P. & van Ginkel, M. 1996. Ansätze zur Züchtung von Weizen für breite Anpassung, Rostresistenz und Trockenheit. In R.A. Richards, C.W. Wrigley, H.M. Rawson, G.J. Rebetzke, J.L. Davidson & R.I.S. Brettell, eds. Proc. 8th Assembly Wheat Breeding Society of Australia, S. 2-30. Canberra, Australische Nationale Universität.
- Rapilly, F. 1979. Epidemiologie des Gelbrostes. Ann. Rev. Phytopathol. 17: 5973.
- Robbelen, G. & Sharp, E.L. 1978. Art der Vererbung, Interaktion und Anwendung von Genen, die die Resistenz gegen Gelbrost bedingen. Fortschr. Pflanzenzucht. Beih. Z. Pflanzenzucht., 9: 1-88.
- Roelfs, A.P. 1978. Geschätzte Verluste durch Rost bei Kleinkorngetreide in den Vereinigten Staaten 1918-1976. Misc. Publ. USDA, 1363: 1-85.
Roelfs, A.P. 1982. Effects of barberry eradication on stem rust in the United States. Plant Dis., 66: 177-181. - Roelfs, A.P. 1985a. Epidemiologie in Nordamerika. In A.P. Roelfs & W.R. Bushnell, eds. The cereal rusts, vol. 2, Diseases, distribution, epidemiology, and control, S. 403-434. Orlando, FL, USA, Academic Press.
- Roelfs, A.P. 1985b. Weizen- und Roggenstängelrost. In A.P. Roelfs & W.R. Bushnell, eds. The cereal rusts, vol. 2, Diseases, distribution, epidemiology, and control, p. 3-37. Orlando, FL, USA, Academic Press.
- Roelfs, A.P. 1986. Development and impact of regional cereal rust epidemics. In K.J. Leonard & W.E. Fry, eds. Pflanzenkrankheitsepidemiologie, Bd. 1, S. 129-150. New York, NY, USA, MacMillan.
- Roelfs, A.P. 1988. Genetische Kontrolle von Phänotypen bei Weizenstängelrost. Ann. Rev. Phytopathol. 26: 351-367.
- Roelfs, A.P. & Groth, J.V. 1980. A comparison of virulence phenotypes in wheat stem rust populations reproductive sexually and asexually. Phytopathologie, 70: 855-862.
- Roelfs, A.P. & Groth, J.V. 1988. Puccinia graminis f. sp. tritici, Schwarzer Halmrost von Triticum spp. In G.S. Sidhu, ed. Advances in plant pathology, vol. 6, Genetics of pathogenic fungi, p. 345-361. London, Academic Press.
- Roelfs, A.P. & Long, D.L. 1987. Die Entwicklung von Puccinia graminis in Nordamerika im Jahr 1986. Plant Dis., 71: 1089-1093.
- Roelfs, A.P. & Martell, L.B. 1984. Ure-dospore dispersal from a point source within a wheat canopy. Phytopathologie, 74: 1262-1267.
- Roelfs, A.P., Huerta-Espino, J. & Marshall, D. 1992. Gersten-Streifenrost in Texas. Plant Dis., 76: 538.
- Rowell, J.B. 1981. Relation von Postpenetrationsereignissen in Idaed 59 Weizensämlingen zu geringer Empfänglichkeit für Infektionen durch Puccinia graminis f. sp. tritici. Phytopathologie, 71: 732-736.
- Rowell, J.B. 1982. Control of wheat stem rust by low receptivity to infection conditioned by a single dominant gene. Phytopathologie, 72: 297-299.
- Rowell, J.B. 1984. Kontrollierte Infektion durch Puccinia graminis f. sp. tritici unter künstlichen Bedingungen. In. A.P. Roelfs & W.R. Bushnell, eds. The cereal rusts, vol. 1, Origins, specificity, structure, and physiology, S. 291-332. Orlando, FL, USA, Academic Press.
- Saari, E.E. & Prescott, J.M. 1985. World distribution in relation to economic losses. In A.P. Roelfs & W.R. Bushnell, eds. The cereal rusts, vol. 2, Diseases, distribution, epidemiology, and control, S. 259-298. Orlando, FL, USA, Academic Press.
Saari, E.E., Young, H.C., Jr. & Fernkamp, M.F. 1968. Infektion von nordamerikanischen Thalictrum spp. mit Puccinia recondita f. sp. tritici. Phytopathologie, 58: 939-943. - Samborski, D.J. 1985. Wheat leaf rust. In A.P. Roelfs und W.R. Bushnell, eds. The cereal rusts, vol. 2, Diseases, distribution, epidemiology, and control, p. 39-59. Orlando, FL, USA, Academic Press.
- Savile, D.B.O. 1984. Taxonomy of the cereal rust fungi. In W.R. Bushnell & A.P. Roelfs, eds. The cereal rusts, vol. 1, Origins, specificity, structures, and physiology, p. 79-112. Orlando, FL, USA, Academic Press.
- Sharp, E.L. & Volin, R.B. 1970. Additive Gene in Weizen, die die Resistenz gegen Streifenrost bedingen. Phytopathologie, 601: 1146-1147.
- Singh, R.P. 1992. Genetischer Zusammenhang zwischen dem Blattrost-Resistenzgen Lr34 und der Resistenz erwachsener Pflanzen gegen Streifenrost bei Brotweizen. Phytopathologie, 82: 835-838.
- Singh, R.P. & Rajaram, S. 1992. Genetics of adult-plant resistance to leaf rust in "Frontana" and three CIMMYT wheats. Genom, 35: 24-31.
- Singh, R.P. & Rajaram, S. 1994. Genetics of adult plant resistance to stripe rust in ten spring bread wheats. Euphytica, 72: 1-7.
- Singh, R.P., Mujeeb-Kazi, A. & Huerta-Espino, J. 1998. Lr46: Ein Gen, das eine Resistenz gegen Blattrost bei Weizen verleiht. Phytopathologie, 88: 890-894.
- Skovmand, B., Fox, P.N. & Villareal, R.L. 1984. Triticale in der kommerziellen Landwirtschaft: Fortschritte und Aussichten. Adv. Agron., 37: 1-45.
- Spehar, V. 1975. Epidemiologie des Weizenrostes in Europa. In Proc. 2nd Int. Winter Wheat Conf., 9-19 Jun., S. 435-440. Zagreb, Jugoslawien.
- Stakman, E.C. 1923. Weizenkrankheiten. 14. The wheat rust problem in the United States. In Proc. 1st Pan Pac. Sci. Congr., S. 88-96.
- Straib, W. 1937. Untersuchungen uben dasn Vorkommen physiologischer Rassen der Gelbrostes (Puccinia glumarum) in den Jahren 1935-1936 und uber die Agressivitat eninger neuer Formen auf Getreide un Grasern. Arb. Biol. Reichsant. Land. Fortw. Berlin-Dahlem, 22: 91-119.
- Stubbs, R.W. 1985. Stripe rust. In A.P. Roelfs & W.R. Bushnell, eds. The cereal rusts, vol. 2, Diseases, distribution, epidemiology, and control, p. 61-101. Orlando, FL, USA, Academic Press.
- Stubbs, R.W. & de Bruin, T. 1970. Bestrijding van gele roest met het systemische fungicide oxycaroxin 'Plantvax'. Gewasbescherming, 1: 99-104.
- Stubbs, R.W., Prescott, J.M., Saari, E.E. & Dubin, H.J. 1986. Handbuch zur Methodik von Getreidekrankheiten, S. 46. Mexiko, DF, CIMMYT.
- Sunderwirth, S.D. & Roelfs, A.P. 1980. Greenhouse evaluation of the adult plant resistance of Sr2 to wheat stem rust. Phytopathologie, 70: 634-637.
- Tollenaar, H. & Houston, B.R. 1967. A study on the epidemiology of stripe rust, Puccinia striiformis West in California. Can. J. Bot., 45: 291-307.
- Tozzetti, G. T. 1952. V. Alimurgia: Die wahre Natur, die Ursachen und die traurigen Auswirkungen der Roste, der Buntspechte, der Rußtaue und anderer Krankheiten des Weizens und Hafers auf dem Feld. In L.R. Tehon, Transl. Phytopathological Classics No. 9, S. 139. St. Paul, MN, USA, American Phytopathol. Society. (Ursprünglich veröffentlicht 1767).
- Tranzschel, W. 1934. Promezutocnye chozjaeva rzavwiny chlebov i ich der USSR. (Die Zwischenwirte der Getreiderostpilze und ihre Verbreitung in der UdSSR). In Bull. Plant Prot., Ser. 2, S. 4-40. (Auf Russisch mit deutscher Zusammenfassung).
- Viennot-Bourgin, G. 1934. La rouille jaune der graminees. Ann. Ec. Natl. Agric. Grignon Ser., 3, 2: 129-217.
- Wallwork, H. & Johnson, R. 1984. Transgressive Separation zur Resistenz gegen Gelbrost bei Weizen. Euphytica, 33: 123-132.
- Watson, I.A. & de Sousa, C.N.A. 1983. Long distance transport of spores of Puccinia graminis tritici in the Southern Hemisphere. In Proc. Linn. Soc. N.S.W., 106: 311-321.
- Wright, R.G. & Lennard, J.H. 1980. Origin of a new race of Puccinia striiformis. Trans. Br. Mycol. Soc., 74: 283-287.
- Zadoks, J.C. 1961. Gelbrost an Weizen - Studien zur Epidemiologie und physiologischen Spezialisierung. Neth. J. Plant Pathol., 67: 69-256.
- Zadoks, J.C. & Bouwman, J.J. 1985. Epidemiologie in Europa. In A.P. Roelfs & W.R. Bushnell, eds. The cereal rusts , vol. 2, Diseases, distribution, epidemiology, and control , p. 329-369. Orlando, FL, USA, Academic Press
Fusarium-Kopffäule
- Baht, C.V., Beedu, R., Ramakrishna, Y. & Munshi, R.L. 1989. Ausbruch von Trichothecentoxikose in Verbindung mit dem Verzehr von schimmelgeschädigten Weizenprodukten im Kaschmirtal, Indien. Lancet, S. 35-37.
- Bai, G. 1995. Schorf bei Weizen: Epidemiologie, Vererbung der Resistenz und molekulare Marker im Zusammenhang mit der Sortenresistenz. Ph.D. thesis. West Lafayette, IN, USA, Purdue University.
- Chen, P., Liu, D. & Sun, W. 1997. New countermeasures of breeding wheat for scab resistance. In H.J. Dubin, L. Gilchrist, J. Reeves & A. McNab, eds. Fusarium head scab: global status and future prospects. Mexiko, DF, CIMMYT.
- Diaz de Ackermann, M. & Kohli, M.M. 1997. Research on fusarium head blight of wheat in Uruguay. In H.J. Dubin, L. Gilchrist, J. Reeves & A. McNab, eds. Fusarium head scab: global status and future prospects. Mexiko, DF, CIMMYT.
- Dill-Macky, R. 1997. Fusarium head blight: Recent epidemics and research efforts in the upper midwest of United States. In H.J. Dubin, L. Gilchrist, J. Reeves & A. McNab, eds. Fusarium head scab: global status and future prospects. Mexiko, DF, CIMMYT.
- Dubin, H.J., Gilchrist, L., Reeves, J. & McNab?, A. 1997. Fusarium-Kopfschorf: Weltweiter Status und Zukunftsaussichten. Mexiko, DF, CIMMYT.
- Galich, M.T.V. 1997. Fusarium head blight in Argentina. In H.J. Dubin, L. Gilchrist, J. Reeves & A. McNab, eds. Fusarium head scab: global status and future prospects. Mexiko, DF, CIMMYT.
- Gilchrist, L., Rajaram, S., Mujeeb-Kazi?, A., van Ginkel, M.,Vivar, H. & Pfeiffer, W. 1997. In H.J. Dubin, L. Gilchrist, J. Reeves & A. McNab, eds. Fusarium head scab: global status and future prospects. Mexiko, DF, CIMMYT.
- Ireta, J. 1989. Seleccion de un modelo de crecimiento para la fusariosis del trigo causada por Fusarium graminearum Schw. In M.M. Kohli, ed. Taller sobre la Fusariosis de la espiga en America del Sur. Mexiko, DF, CIMMYT.
- Ireta, M.J. & Gilchrist, L. 1994. Fusarium-Kopfschorf des Weizens (Fusarium graminearum Schwabe). Weizen Sonderbericht Nr. 21b. Mexiko, DF, CIMMYT.
- Khonga, E.B. & Sutton, J.C. 1988. Inokulumproduktion und Überleben von Giberella zeae in Mais- und Weizenrückständen. Can. J. Plant Pathol., 10(3): 232-240.
- Luo, X.Y. 1988. Die Kontamination mit Fusarientoxinen in China. Proc. Japan Assoc. Mycotoxicology Suppl., 1: 97-98. Marasas, W.F.O., Jaskiewickz, K., Venter, F.S. & Schalkwyk, D.J. 1988. Fusarium moniliforme Kontamination von Mais in Speiseröhrenkrebsgebieten in der Transkei. S. AF. Med. J., 74: 110-114.
- Mihuta-Grimm, L. & Foster, R.L. 1989. Scab on wheat and barley in southern Idaho and evaluation of seed treatment for eradication of Fusarium spp. Plant Dis., 73: 769-771.
- Miller, J.D. & Armison, P.G. 1986. Abbau von Deoxynivalenol durch Suspensionskulturen der gegen Fusarium-Kopffäule resistenten Weizensorte Frontana. Can. J. Plant Pathol., 8: 147-150.
- Miller, J.D., Young, J.C. & Sampson, D.R. 1985. Deoxynivalenol und Fusarium-Kopffäule-Resistenz bei Sommergetreide. J. Phytopathol, 113: 359-367.
- Reis, E.M. 1985. Doencas do trigo III. Fusariose. Brasil, Merck Sharp Dohme.
- Reis, E.M. 1989. Fusariose: biologia y epidemiologia de Gibberella zeae en trigo. In M.M. Kohli, ed. Taller sobre la Fusariosis de la espiga en America del Sur. Mexiko, DF, CIMMYT.
- Schroeder, H.W. & Christensen, J.J. 1963. Factors affecting resistance of wheat to scab caused by Gibberella zeae. Phytopathologie, 53: 831-838.
- Snidjers, C.H.A. 1989. Current status of breeding wheat for Fusarium head blight resistant and mycotoxin problem in the Netherlands. Stiftung für landwirtschaftliche Pflanzenzüchtung, Wageningen. In M.M. Kohli, ed. Taller sobre la Fusariosis de la espiga en America del Sur. Mexiko, DF, CIMMYT.
- Snijders, C.H.A. 1990. The inheritance of resistance to head blight caused by Fusarium culmorum in winter wheat Euphytica, 50: 11-18.
- Teich, A.H. & Nelson, K. 1984. Survey of Fusarium head blight and possible effects of cultural practices in wheats fields in Lambton County in 1983. Can. Plant Dis. Surv., 64(1): 11-13.
- Trenholm, H.L., Friend, D.H. & Hamilton, R.M.G. 1984. Vomitoxin und Zearalenon in Tierfuttermitteln. Agriculture Canada Veröffentlichung 1745 E.
- Van Egmond, H.P. & Dekker, W.H. 1995. Weltweite Regelungen für Mykotoxine im Jahr 1994. Nat. Toxins, 3: 332.
- Viedma, L. 1989. Importancia y distribucion de la fusariosis de trigo en Paraguay. In M.M. Kohli, ed. Taller sobre la Fusariosis de la espiga en America del Sur. Mexiko, DF, CIMMYT.
- Wang, Y.Z. 1997. Epidemiologie und Management von Weizenschorf in China In H.J. Dubin, L. Gilchrist, J. Reeves & A. McNab, eds. Fusarium head scab: global status and future prospects. Mexiko, DF, CIMMYT.
- Wang, Y.Z. & Miller, J.D. 1988. Effects of metabolites on wheat tissue in relation to Fusarium head blight resistance. J. Phytopathol., 122: 118-125.
Fusarium-Kopffäule
- Infektion und Ausbreitung von Fusarium spp. an Weizen in Abhängigkeit der Anbaubedingungen im Rheinland, Lienemann, K.
- E.-C. Oerke und H.-W. Dehne
Auswirkungen von Wasseraktivität, Temperatur und pH-Wert auf das Wachstum von Isolaten von Fusarium moniliforme und Fusarium proliferatum in Mais, Sonia Marin, Vicente Sanchis und Naresh Magan - Interaktion von Fusarium graminearum und F. moniliforme in Maisähren: Krankheitsfortschritt, Pilzbiomasse und Mykotoxinakkumulation, L. M. Reid, R. W. Nicol, T. Ouellet, M. Savard, J. D. Miller, J. C. Young, D. W. Stewart, und A. W. Schaafsma
- Evaluierung von Einflussfaktoren auf den Fusarium-Ährenbefall des Weizens, Wolf, P. F. J.; Schempp, H.; Verreet, J.-A.
Septoria spp.
- Baker, C.J. 1971. Morphologie der Sämlingsinfektion durch Leptosphaeria nodorum. Trans. Brit. Mycol. Soc. 56:306-309.
- Baker, C.J. 1969. Studien über Leptosphaeria nodorum Müller und Septoria tritici Desm. an Weizen. Ph. D. thesis. Universität von Exeter.
- Baker, E.A., und Smith, I.M. 1978. Development of the resistant and susceptible reactions in wheat on inoculation with Septoria nodorum. Trans. Brit. Mycol. Soc. 71:475-482.
- Benedict, W.G. 1971. Differential effect of light intensity on the infection of wheat by Septoria tritici Desm. under controlled environmental conditions. Physiol. Pl. Pathol. 1:55-56.
- Bird, P.M., und Ride, J.P. 1981. The resistance of wheat to Septoria nodorum: fungal development in relation to host lignification. Physiol. Pl. Pathol. 19:289-299.
- Stagonospora und Septoria Pathogene von Getreide: The Infection Process 45 Bethenod, O., Bousquet, J., Laffray, D., and Louguet, P. 1982. Reexamen des modalités d'action de l'ochracine sur la conductance stomatique des feuilles de plantules de blé, Triticum aestivum L., cv "Etoile de Choisy".Agronomie 2:99-102.
- Bousquet, J.F., und Kollman, A. 1998. Variation in der Metabolitenproduktion von Septoria nodorum Isolaten, die an Weizen oder Gerste angepasst sind. J. Phytopathol. 146:273-277.
- Bousquet, J.F., Belhomme de Franqueville, H., Kollmann, A., and Fritz, R. 1980. Action de la septorine, phytotoxine synthétisée par Septoria nodorum, sur la phosphorylation oxydative dans les mitochondries isolées de coléoptiles de blé. Can. J. Bot. 58:2575-2580.
- Brennan, R.M., Fitt, B.D.L., Colhoun, J., und Taylor, G.S. 1986. Faktoren, die die Keimung von Septoria nodorum-Pyknidiensporen beeinflussen. J. Phytopathol. 117:49-53.
- Brönnimann, A., Sally, B.K., und Sharp, E.L. 1972. Untersuchungen über Septoria nodorum in Sommerweizen in Montana. Plant Dis. Reptr. 56:188-191.
- Cohen, L., und Eyal, Z. 1993. Die Histologie von Prozessen im Zusammenhang mit der Infektion von resistenten und anfälligen Weizensorten mit Septoria tritici. Plant Pathol. 42:737-743.
- Cunfer, B.M. 1983. Epidemiologie und Bekämpfung von samenbürtigem Septoria nodorum. Seed Sci. Tecnol. 11:707- 718.
- Essad, S., und Bousquet, J.F. 1981. Action de l'ochracine, phytotoxine de Septoria nodorum Berk., sur le cycle mitotique de Triticum aestivum L. Agronomie 1:689-694.
- Eyal, Z., Scharen, A.L., Prescott, J.M., und van Ginkel, M. 1987. Die Septoria-Krankheiten des Weizens: Konzepte und Methoden der Krankheitsbekämpfung. CIMMYT. Mexiko D.F. 46 pp.
- Fernandes, J.M.C., und Hendrix, J.W. 1986a. Viability of conidia of Septoria nodorum exposed to natural conditions in Washington. Fitopathol. Bras. 11:705-710.
- Fernandes, J.M.C., und Hendrix, J.W. 1986b. Auswirkungen von Blattnässe und Temperatur auf das Hyphenwachstum und die Entwicklung von Symptomen auf Weizenblättern, die mit Septoria nodorum infiziert sind. Fitopathol. Bras. 11:835-845.
- Fournet, J. 1969. Properiétés et role du cirrhe du Septoria nodorum Berk. Ann. Phytopathol. 1:87-94. Fournet, J., Pauvert, P., und Rapilly, F. 1970. Propriétés des gelées sporifères de quelques Sphaeropsidales et Melanconiales. Ann. Phytopathol. 2:31-41.
- Gough, F.J., und Lee, T.S. 1985. Moisture effects on the discharge and survival of conidia of Septoria tritici. Phytopathologie 75:180-182.
- Green, G.J., und Dickson, J.G. 1957. Pathologische Histologie und Sortenreaktionen bei Septoria-Blattfleckenkrankheit der Gerste. Phytopathologie 47:73-79.
- Griffiths, E., und Peverett, H. 1980. Effects of humidity and cirrhus extract on survival of Septoria nodorum spores. Trans. Brit. Mycol. Soc. 75:147-150.
- Harrower, K.M. 1976. Die Funktion der Zirren bei Leptosphaeria nodorum. APPS Rundbrief 5:20-21.
- Hilu, H.M., und Bever, W.M. 1957. Inoculation, oversummering, and suscept-pathogen relationship of on Triticum species. Phytopathologie 47:474-480.
- Holmes, S.J.I., und Colhoun, J. 1974. Infektion von Weizen durch Septoria nodorum und S. tritici. Trans. Brit. Mycol. Soc. 63:329-338.
- Jenkins, P.D. 1978. Interaktion bei Getreidekrankheiten. Ph. D. Dissertation. Universität von Wales.
- Karjalainen, R., und Lounatmaa, K. 1986. Ultrastruktur des Eindringens und der Besiedlung von Weizenblättern durch Septoria nodorum. Physiol. Mol. Pl. Pathol. 29:263-270.
- Kema, G.H.J., DaZhao, Y., Rijkenberg, F.H.J., Shaw, M.W., und Baayen, R.P. 1996. Histologie der Pathogenese von Mycosphaerella graminicola in Weizen. Phytopathologie 86:777-786.
- Keon, J.P.R., und Hargreaves, J.A. 1984. Die Reaktion von Blattepidermiszellen der Gerste auf die Infektion durch Septoria nodorum. New Phytol. 98:387-398.
- King, J.E., Cook, R.J., und Melville, S.C. 1983. A review of Septoriadiseases of wheat and barley. Ann. Appl. Biol. 103:345-373.
- Krupinsky, J.M., Scharen, A.L., und Schillinger, J.A. 1973. Pathogenvariationen bei Septoria nodorum Berk. in Bezug auf Organspezifität, scheinbare photosynthetische Rate und Ertrag von Weizen. Physiol. Pl. Pathol. 3:187-194.
- Lehtinen, U. 1993. Pflanzenzellwand-abbauende Enzyme von Septoria nodorum. Physiol. Mol. Pl. Pathol. 43:121-134.
- Magro, P. 1984. Produktion von Polysaccharid-abbauenden Enzymen in Kultur und während der Pathogenese. Plant Sci. Letters 37:63-68.
- Morgan, W.M. 1974. Physiologische Untersuchungen von Krankheiten des Weizens, die durch Septoria spp. und Fusarium culmorum verursacht werden. Ph. D. thesis. Universität von London.
- O'Reilly, P., und Downes, M.J. 1986. Form des Überlebens von Septoria nodorum auf symptomlosem Winterweizen. Trans. Brit. Mycol. Soc. 86:381-385.
- Rapilly, F., Foucault, B., und Lacazedieux, J. 1973. Études sur l'inoculum de Septoria nodorum Berk. (Leptosphaeria nodorum Müller) agent de la septoriose du blé I. Les ascospores. Ann. Phytopathol. 5:131-141.
- Rasanayagam, M.S., Paul, N.D., Royle, D.J., und Ayres, P.G. 1995. Variation in der Reaktion von Septoria tritici und S. nodorum auf UV-B-Bestrahlung in vitro. Mycol. Res. 99:1371-1377.
- Shipton, W.A., Boyd, W.R.J., Rosielle, A.A., und Shearer, B.L. 1971. Die üblichen Septoria-Krankheiten des Weizens. Bot. Rev. 37:231-262.
- Straley, M. L. 1979. Pathogenese von Septoria nodorum (Berk.) Berk. An Weizensorten mit unterschiedlicher Resistenz gegen Spelzenfleckenkrankheit. Ph. D. thesis. Montana State Universität. 99 Seiten.
- Straley, M.L., und Scharen, A.L. 1979. Die Entwicklung von Septoria nodorum in resistenten und anfälligen Weizenblättern. Phytopathologie 69:920-921.
- Weber, G. F. 1922. Septoria-Krankheiten des Getreides. Phytopathologie 12:537-585.
- Babadoost, M. & Herbert, T.T. 1984. Faktoren, die die Infektion von Weizensämlingen durch Septoria nodorum beeinflussen. Phytopathologie, 74: 592-595.
- Eyal, Z.E. 1981. Integrated control of Septoria diseases of wheat. Plant Dis., 65: 763-768.
- Eyal, Z., Sharen, A.L., Prescott, J.M. & van Ginkel, M. 1987. Die Septoria-Krankheiten des Weizens: Konzepte und Methoden der Krankheitsbekämpfung. Mexiko, DF, CIMMYT.
- Polley, R.W. & Thomas, M.R. 1991. Erhebungen über Weizenkrankheiten in England und Wales, 1976-1988. Ann. Appl. Biol., 119: 1-20.
- Henze, Mathias: Entwicklung einer anbauparameter- und wetterunsabhängigen Befallsprognose von Septoria tritici, CUVILLER VERLAG, Göttingen 2008
- B.M. Cunfer: Stagonospora und Septoria Pathogene von Getreide: The Infection Process, in Septoria and Stagonospora Diseases of Cereals: A Compilation of Global Research, M. van Ginkel, A. McNab, and J. Krupinsky editors, Proceedings of the Fifth International Septoria Workshop September 20-24, 1999, CIMMYT, Mexico
Empfohlene Ausrüstung
Prüfen Sie, welcher Sensorensatz für die Überwachung potenzieller Krankheiten dieser Kultur benötigt wird.