Banane Krankheitsmodelle
Die Banane ist eine der wichtigsten Früchte weltweit. In ihrer süßen Form als Dollar-Banane und in ihrer nicht süßen Kochform ist sie ein Hauptbestandteil der Ernährung der Menschen in tropischen Ländern. Seit den späten Jahren des neunzehnten Jahrhunderts entwickelt sich die Banane zur wichtigsten Welthandelsfrucht. Die in Mittelamerika und in der Karibik produzierten Bananen wurden in die USA und nach Europa exportiert. Heutzutage ist die Banane ein wichtiger Bestandteil des Obstbestandes in den Industrieländern. Mit dem steigenden Einkommen in China und Osteuropa entstehen neue Märkte, die eine neue Nachfrage nach Bananen erzeugen.
Es gibt zwei wichtige Blattfleckenkrankheiten in Bananen: Gelbe Sigatoka und Schwarze Sigatoka. Die gelbe Sigatoka, die durch den Pilz Mycosphaerella musicola verursacht wird, ist in allen Bananenanbaugebieten verbreitet, während die schwarze Sigatoka, die durch den Pilz M. fijiensis var. difformis wurde auf den Fidschi-Inseln gefunden. Die Schwarze Sigatoka weist eine viel höhere Virulenz auf als die Gelbe Sigatoka, weshalb sie in den meisten Bananenanbauländern zur wichtigsten Bananenkrankheit geworden ist.
Schwarze Sigatoka-Krankheit
Die Arbeit stützt sich auf die beiden folgenden Artikel:
- Black Leaf Streak Disease; Pests and Diseases of American Samoa Number 10, American Samoa Community College Community & Natural Resources Cooperative Research & Extension. 2004
- Black Sigatoka Ein immer wichtigerer Faktor für den Bananenanbau; Douglas H. Marín, Del Monte Fresh Produce; Ronald A. Romero, Chiquita Brands; Mauricio Guzmán, National Banana Corporation of Costa Rica; Turner B. Sutton, North Carolina State University, Raleigh
Die Schwarze Blattfleckenkrankheit (BLS), auch "Black Sigatoka" genannt, ist die weltweit schädlichste Blattkrankheit der Bananen. Die meisten Gebiete in den Tropen und Subtropen sind betroffen, wobei Verluste von 30-50% gemeldet werden. Im Pazifik wurde BLS erstmals vor 40 Jahren im Sigatoka-Tal auf den Fidschi-Inseln festgestellt. Die meisten Fungizide, die im Bananenanbau eingesetzt werden, dienen der Bekämpfung von BLS. Die Cavendish-Typ 'Williams'-Banane, die von den meisten kommerziellen Erzeugern angebaut wird, ist sehr anfällig für die Pilzkrankheit. Befallene Pflanzen haben weniger Blätter, was zu weniger und kleineren Früchten, einer verzögerten Ernte, einer vorzeitigen Reifung und einer geringeren Qualität der Früchte führt.
Mögliche Auswirkungen
Die Schwarze Sigatoka führt zur Zerstörung des Bananenblattgewebes, was die photosynthetischen Fähigkeiten der Pflanze beeinträchtigt und die Erträge um bis zu 50% verringern kann. Die Schwarze Sigatoka ist einer der Hauptfaktoren, die für den Rückgang der Bananenexportindustrie in den Ländern des Südpazifiks verantwortlich sind. Kommerzielle Plantagen, die Bananen für den Export produzieren, müssen ein kostspieliges Fungizid-Spritzprogramm zur Bekämpfung von Black Sigatoka durchführen, was aus Gründen des Umweltschutzes und der menschlichen Gesundheit kritisiert wurde. Wird die Krankheit jedoch nicht bekämpft, können die Früchte der befallenen Pflanzen während des Transports vorzeitig reifen und weitere Verluste verursachen. In den Folgejahren wurde die Krankheit durch chemische Spritzungen (15-17 Fungizidanwendungen) bekämpft, was jedoch die Produktionskosten erheblich erhöhte.
Betroffene Pflanzen
Eindeutige Symptome der Schwarzen Sigatoka wurden bisher nur bei Musa (Bananen), Musa paradisiaca (Kochbananen), Musa acuminata (Wildbanane) und Musa acuminata (subsp. bantesii und subsp. zebrina). Die Kultursorten reagieren unterschiedlich auf den Erreger. Die Immunität ist nicht bekannt, und es ist möglich, dass andere Wildarten und Unterarten von Musa sind infiziert, aber die Krankheit entwickelt sich nicht signifikant. Mycosphaerella fijiensis kann auch das Keimlingsstadium von Wildbananen befallen.
Jahreszeit des Auftretens
Schwarze Sigatoka-Sporen bilden sich leicht in tropischen und subtropischen Sommern oder unter Bedingungen von hohe Luftfeuchtigkeit und NiederschlägeDie Sporen werden vor allem dann verbreitet, wenn sich auf den Blättern ein Film aus freiem Wasser befindet. Die Sporen werden hauptsächlich durch Regen oder Spritzer verbreitet, aber später in der Entwicklung der Krankheit werden die Sporen auch zwangsweise in die Luftströme geschleudert. Die Infektion erfolgt auf den jüngsten Blättern der Pflanze während und unmittelbar nach dem Entfalten, aber ältere Blätter begünstigen die Entwicklung der Krankheit. Offensichtliche visuelle Symptome treten etwa 15-20 Tage nach der Erstinfektion auf.
Symptome
Die ersten sichtbaren Symptome der Blattinfektion sind kurze, rötlich-braune Linien von etwa 2 mm Länge. Die Linien gehen in 20-30 mm lange braune Streifen über, die sich zu elliptischen Flecken verbreitern, die auf der Unterseite des Blattes braun und auf der Oberseite schwarz sind. Die Flecken sind leicht eingesunken und von einem gelblichen Heiligenschein umgeben. Danach wird die Mitte des großen Flecks grau, umrandet von einer schwarzen Linie und einem gelben Lichthof. Schließlich verschmelzen die Flecken und das Blatt stirbt ab.
Epidemiologie
Sowohl Konidien als auch Ascosporen spielen eine Rolle bei der Verbreitung der Krankheit. Konidien bilden sich unter folgenden Bedingungen mit hoher Luftfeuchtigkeitbesonders dann, wenn sich auf den Blättern ein Film aus freiem Wasser befindet. Sie werden während der Entwicklung der ersten Krankheitsstadien gebildet (insbesondere während des Strichstadiums 2, des Streifstadiums3 und des Fleckenstadiums 4). Die Hauptverbreitungswege sind Regen und Spritzwasser; die Konidien werden nicht vom Wind abgelöst. Konidien werden hauptsächlich mit der lokalen Ausbreitung der Krankheit in Verbindung gebracht und sind in Zeiten hoher Luftfeuchtigkeit, häufigen starken Tauwetters und zeitweiliger Regenfälle von Bedeutung.
Denn M. fijiensis relativ wenige Konidien produziert, werden Ascosporen als wichtiger für die Verbreitung der schwarzen Sigatoka angesehen (4,20). Jacome et al. (10) stellten jedoch fest, dass Konidien in der Lage sind, erhebliche Mengen an Krankheiten zu verursachen, und dass die Krankheitssymptome mit denen identisch sind, die durch eine Ascosporeninfektion verursacht werden. Er wies darauf hin, dass Konidien in Trockenperioden an Bedeutung gewinnen, wenn sich die Krankheitsentwicklung aufgrund der weniger günstigen klimatischen Bedingungen verzögert (10). Ascosporen sind das wichtigste Mittel zur Ausbreitung über größere Entfernungen innerhalb von Plantagen und in neue Gebiete und sind das übliche Mittel zur Ausbreitung während längerer feuchter Wetterperioden (3,4,6,10, 11,15).
Ascosporen werden in Pseudothecien in reifen Läsionen gebildet, die häufig auf älteren Blättern der Pflanze oder in abgestorbenen Blättern am Boden zu finden sind. Meredith und Lawrence (14) berichteten, dass Pseudothezien auf beiden Seiten der Blattoberfläche gebildet werden, aber auf der adaxialen Oberfläche sind sie in größerer Zahl vorhanden. Im Gegensatz dazu stellten Gauhl et al. (6) fest, dass auf der abaxialen Blattoberfläche mehr Pseudothecien und Ascosporen gebildet werden. Obwohl Burt et al. (2) feststellten, dass etwa 4,5 Ascosporen pro Pseudothecium freigesetzt werden, scheint diese Zahl sehr niedrig zu sein, wenn man die hohe Konzentration des Inokulums bedenkt, die nach Regen in der Luft vorhanden ist (4).
Freisetzung von Ascosporen
Erfordert die Anwesenheit von ein Wasserfilm aus Regen oder Tau der die Pseudothecien aufsaugt und zum Ausstoßen der Ascosporen durch die Grenzschicht der Blätter führt, wo sie durch Luftströmungen verbreitet werden (15,20). Die Reifung der Pseudothecien erfordert Sättigung des abgestorbenen Blattgewebes für etwa 48 Stunden (3,4,7,10,11,15). Unter hawaiianischen Bedingungen stiegen die Ascosporenkonzentrationen während der Nacht an, waren um 6 Uhr morgens am höchsten und gingen tagsüber deutlich zurück. An regnerischen Tagen traten die höchsten Konzentrationen kurz nach Beginn des Regens auf. Der saisonale Anstieg der mittleren täglichen Ascosporenkonzentration steht in Zusammenhang mit vermehrten Niederschlägen und höherer relativer Luftfeuchtigkeit (15). Gauhl (4), der mit Bananen arbeitete, berichtete über ähnliche Ergebnisse unter costaricanischen Bedingungen. Während Meredith et al. (15) keine Anhaltspunkte dafür fanden, dass die Produktion oder Freisetzung von Ascosporen durch die Mindesttemperaturen beeinflusst wird, stellte Gauhl (4) fest, dass die Produktion von Inokulum in den trockeneren (oder regenärmeren) Monaten des Jahres in der karibischen Zone Costa Ricas, die auch die Jahreszeit mit den niedrigsten Temperaturen ist, abnimmt. Ascosporen werden durch den Wind verbreitet; die Ausbreitung über große Entfernungen ist jedoch aufgrund ihrer Anfälligkeit für ultraviolette Strahlung auf einige hundert Kilometer begrenzt (17). Ein konsistenter Zusammenhang zwischen Ascosporenausstoß und Krankheitsentwicklung konnte nicht nachgewiesen werden, was den Nutzen der Sporenfänge für die Krankheitsvorhersage einschränkt (5,11). Ascosporen werden während des Entfaltens eines neuen Blattes hauptsächlich auf der unteren Blattoberfläche abgelagert, was zu einem Streifenmuster von Infektionen auf der Seite führt, die zuerst freigelegt wird, was eine Folge der verstärkten Sporenablagerung auf dem zylindrischen Kandelaberblatt während des Entfaltens im Gegensatz zur gesamten offenen Blattlamelle ist. Folglich treten die meisten Infektionen auf der abaxialen Oberfläche der Blätter auf (3,7).
Infektion
Die Keimschläuche benötigen etwa 48 bis 72 Stunden, um in die Spaltöffnungen einzudringen (1,20), obwohl der Pilz bis zu 6 Tage lang epiphytisch auf der Blattoberfläche wachsen kann, bevor er tatsächlich in die Blätter eindringt (1). Erfolgreiche Infektion wird gefördert durch erweiterte Perioden hoher Luftfeuchtigkeit und das Vorhandensein von freiem Wasser auf den Blättern (3,7,13). Die maximale Keimung erfolgt bei Vorhandensein von freiem Wasser. Die Konidien keimen in einem größeren Bereich der relativen Luftfeuchtigkeit (92 bis 100%) als die Ascosporen (98 bis 100%). Die Wirkung von Temperatur auf die Keimung lässt sich durch eine quadratische Antwortfunktion mit einem geschätzten Optimum von 26,5 °C charakterisieren (10). Stover (21) beobachtete das maximale Wachstum von Ascosporen-Keimschläuchen bei 26 bis 28°C nach 24 Stunden Inkubation. Jacome und Schuh (8,9) berichteten, dass ältere Blätter anfälliger sind; E. Bureau (persönliche Mitteilung) und Romero (18) beobachteten jedoch, dass jüngere Blätter anfälliger sind (erstes bis drittes Blatt) als ältere Blätter.
Inkubationszeit
Die Zeit zwischen der Infektion und dem Auftreten von Symptomen variiert je nach Witterungsbedingungen und Anfälligkeit der Pflanzen (68). Bei Bananen fällt der Zeitpunkt der Blattinfektion schätzungsweise mit dem Erscheinen eines neuen Blattes an der Spitze des Pseudostamms zusammen (20). Unter sehr günstigen Bedingungen in Costa Rica und mit einem anfälligen Wirt kann die Inkubationszeit kann nur 13 bis 14 Tage betragen, während sich die Inkubationszeit bei ungünstigen Witterungsverhältnissen auf bis zu 35 Tage verlängern kann. Ähnliche Berichte gibt es aus Nigeria über Kochbananen (16). In der Regenzeit betrug die Inkubationszeit 14 Tage, in der Trockenzeit dagegen 24 Tage. Die Dauer der Inkubationszeit variiert auch mit der Anfälligkeit der Sorte für M. fijiensis. Bei den Sorten FHIA 1 und FHIA 2, zwei vom FHIA entwickelten tetraploiden synthetischen Hybriden, betrug die Inkubationszeit 26,2 bzw. 25,1 Tage, während sie bei der anfälligen Sorte Grande Naine 22,4 Tage betrug (19).
Nach dem Durchdringen des Blattes werden die Hyphen von <M. fijiensis kolonisieren benachbarte Zellen etwa 7 Tage lang, ohne dass es Anzeichen für eine Störung der Zellen gibt. Die vegetativen Hyphen können aus den Spaltöffnungen austreten und auf der Blattoberfläche wachsen und in benachbarte Spaltöffnungen eindringen oder Konidiophoren und Konidien bilden. Dieses epiphytische Wachstum ermöglicht es dem Pilz, angrenzendes Blattgewebe zu kolonisieren, was zu einer raschen Symptomentwicklung führt (4,20). M. fijiensis hat eine größere Fähigkeit, mehrere Spaltöffnungen zu durchdringen als M. musicolawas zu einer stärkeren Fleckenbildung führt als bei dem erstgenannten Erreger (20).
Latenzzeit
Obwohl Konidien in Läsionen produziert werden können, die frühe Symptome von M. fijiensis und zur Epidemie beitragen, wird die Latenzzeit durch den Zeitpunkt definiert, an dem der Pilz beginnt, Läsionen mit reifen Pseudothecien und Ascosporen zu bilden, die die Hauptquelle des Inokulums sind. Wie die Inkubationszeit variiert auch die Latenzzeit in Abhängigkeit von den Witterungsbedingungen, der Anfälligkeit des Wirts und der Intensität der Infektionen. Die Latenzzeit reichte von 25 Tagen während der Regenzeit (Juni bis Dezember) bis zu 70 Tagen während der Trockenzeit in Guapiles, Costa Rica. Wenn das Wetter für den Ascosporenauswurf und die Infektion sehr günstig ist, treten viele Infektionen auf den Blättern auf. Wenn die Infektionen dicht sind, wachsen sie in einem sehr frühen Entwicklungsstadium schnell zusammen und beschleunigen das Auftreten von reifen Flecken, die durch das Vorhandensein von Pseudothecien und Ascosporen gekennzeichnet sind (22). Unter diesen Bedingungen werden die Blätter schnell und stark geschädigt. Die Latenzzeit variiert auch je nach dem Grad der Resistenz. So betrug die Zeit vom Blattaustrieb bis zum ersten reifen Fleckensymptom unter denselben natürlichen Bedingungen bei der Sorte Curraré, einer Kochbanane, die zur Untergruppe der Kochbananen gehört, 44 Tage im Vergleich zu 34 Tagen bei der Sorte Valery, einer Banane, die zur Untergruppe der Cavendish gehört (4). Der Begriff "Krankheitsentwicklungszeit" wird in der Bananenliteratur in den Tropen häufig verwendet, um sich auf die Latenzzeit zu beziehen, und er ist definiert als die Zeit zwischen der Infektion und der Bildung reifer Flecken. Ein anderer in der Bananenliteratur häufig verwendeter Begriff ist "Symptomentwicklungszeit" oder "Übergangszeit", d. h. die Zeit zwischen den ersten Symptomen und dem Auftreten reifer Flecken (6). Die Symptomentwicklungszeit gibt einen guten Hinweis darauf, wie schnell die Krankheit auf den Blättern voranschreitet.
Literatur:
- Beveraggi, A. 1992. Etude des interactions hôte-parasite chez des bananiers sensibles et résistants inoculés par Cercospora fijiensis responsible de la maladie des raies noires. Thèse de 3ème cycle. Université de Montpellier, Montpellier, Frankreich.
- Burt, J. P. A., Rosenberg, L. J., Rutter, J., Ramírez, F., und González, O. H. 1999. Vorhersage der Ausbreitung von Mycosphaerella fijiensis, dem Erreger der Schwarzen Sigatoka-Krankheit bei Bananen, durch die Luft: Schätzungen der Anzahl von Perithecien und Ascosporen. Ann. Appl. Biol. 135:369-377.
- Fullerton, R. A. 1994. Sigatoka Leaf Diseases.Pages 12-14 in: Kompendium der tropischen Obstkrankheiten. R. C. Ploetz, G. A. Zentmyer, W. T. Nishijinia, K. G. Rohrbach, and H. D. Ohr, eds. Amerikanische Phytopathologische Gesellschaft, St. Paul, MN.
- Gauhl, F. 1994. Epidemiologie und Ökologie der schwarzen Sigatoka (Mycosphaerella fijiensis Morelet) auf Wegerich und Banane (Musa spp.) in Costa Rica, Mittelamerika. INIBAP, Montpellier, Frankreich.
- Gauhl, F. 2002. Sind Sporenfallen ein nützliches Instrument zur Vorhersage der Entwicklung der Sigatoka-Krankheit in kommerziellen Bananenplantagen. Seite 22 in: Int. Workshop Mycosphaerella Leaf Spot Dis. Bananas, 2nd - Programme and Abstracts. (Abstr.)
- Gauhl, F., Pasberg-Gauhl, C., und Jones, D. R. 2000. Krankheitszyklus und Epidemiologie. Seiten 56-62 in: Krankheiten von Banane, Abacá und Enset. D. R. Jones, ed. CAB International, Wallingford, UK.
- González, M. 1987. Enfermedades del cultivo del banano. Oficina de Publicaciones de la Universidad de Costa Rica, San José.
- Jacome, L. H., und Schuh, W. 1992. Effects of leaf wetness duration and temperature on development of black Sigatoka disease on banana infected by Mycosphaerella fijiensis var. difformis. Phytopathologie 82:515-520.
- Jacome, L. H., und Schuh, W. 1993. Auswirkung der Temperatur auf Wachstum und Konidienproduktion in vitro und Vergleich von Infektion und Aggressivität in vivo zwischen Isolaten von Mycosphaerella fijiensis var. difformis. Trop. Agric. 70:51-59.
- Jacome, L. H., Schuh, W., und Stevenson, R. E. 1991. Effect of temperature and relative humidity on germination and germ tube development of Mycosphaerella fijiensis var. difformis. Phytopathologie 81:1480-1485.
- Jeger, M. J., Eden-Green, S., Thresh, J. M., Johanson, J. M., Waller, J. M., und Brown, A. E. 1995. Bananenkrankheiten. Seiten 317-381 in: Bananen und Kochbananen. S. Gowen, ed. Chapman & Hall, London.
- Marín, D. H., und Romero, R. A. 1992. El combate de la Sigatoka negra. Boletín No. 4, Departamento de Investigaciones, Corporación Bananera Nacional, Costa Rica.
- Mayorga, M. H. 1990. La Raya negra (Mycosphaerella fijiensis Morelet) del plátano y del banano. I. Ciclo de vida del patógeno bajo las condiciones del Urabá. Revista ICA 25:69-77.
- Meredith, D. S., und Lawrence, J. S. 1969. Black leaf streak disease of bananas (Mycosphaerella fijiensis): Krankheitssymptome auf Hawaii und Anmerkungen zur Konidienform des verursachenden Pilzes. Trans. Br. Mycol. Soc. 52:459-476.
- Meredith, D. S., Lawrence, J. S., und Firman,I. D. 1973. Ascospore release and dispersal on black leaf streak disease of bananas (Mycosphaerella fijiensis). Trans. Br. Mycol. Soc. 60:547-554.
- Mobambo, K. N., Gauhl, F., Pasberg-Gauhl, C., und Zuofa, K. 1996. Season and plant age effect evaluation of plantain for response to black Sigatoka disease. Crop Prot. 15:609- 614.
- Parnell, M., Burt, P. J. A., und Wilson, K. 1998. The influence of exposure to ultraviolet radiation in simulated sunlight on ascospores causing black Sigatoka disease of banana and plantain. Int. J. Biometeorol. 42:22-27.
- Romero, R. A. 1995. Dynamik fungizidresistenter Populationen von Mycosphaerella fijiensis und Epidemiologie der schwarzen Sigatoka der Bananen. Ph.D. diss. North Carolina State, Raleigh.
- Romero, R. A., und Sutton, T. B. 1997. Reaction of four Musa genotypes at three temperatures to isolates of Mycosphaerella fijiensis from different regions. Plant Dis. 81:1139-1142.
- Stover, R. H. 1980. Sigatoka leaf spot of bananas and plantains. Plant Dis. 64:750-756.
- Stover, R. H. 1983. The effect of temperature on ascospore germ tube growth of Mycosphaerella musicola and Mycosphaerela fijiensis var. difformis. Fruits 38:625-628.
Schwarzes Sigatoka-Infektionsmodell
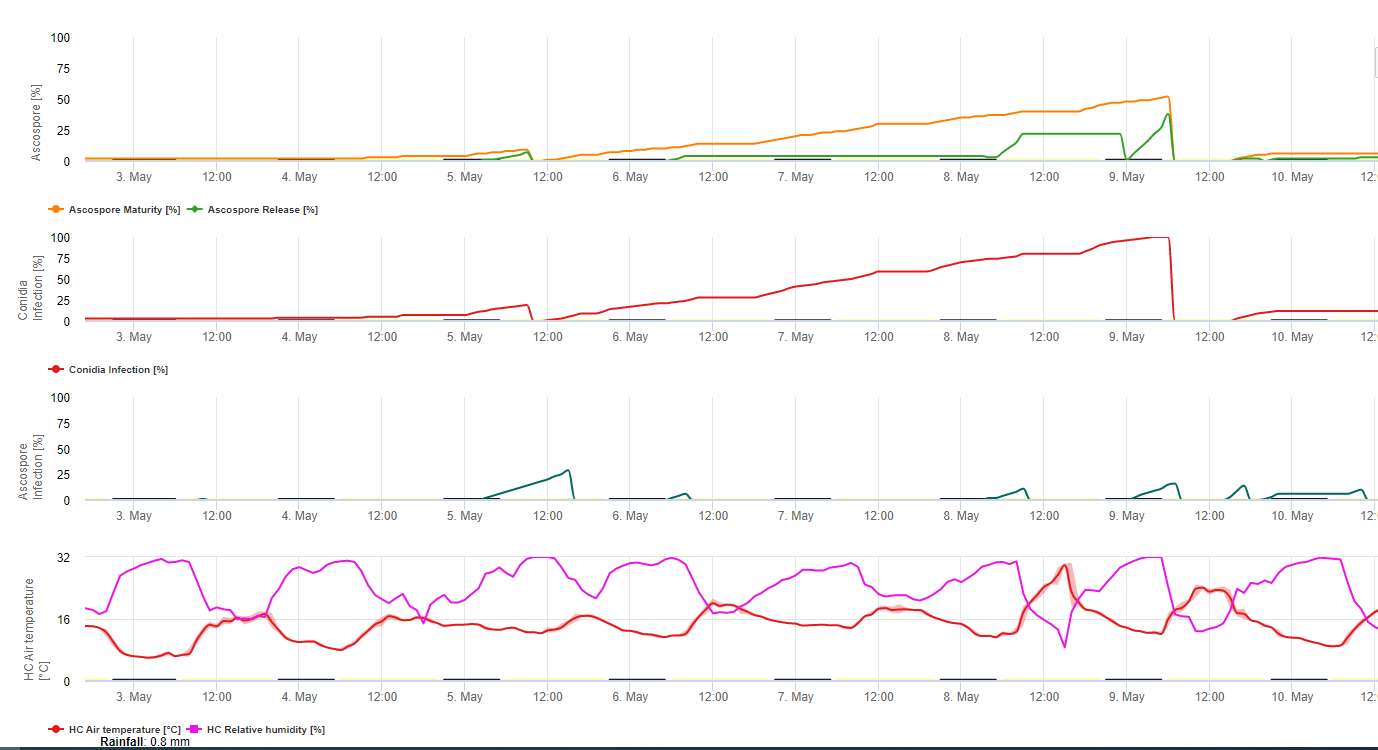
Das Sigatoka-Infektionsmodell auf FieldClimate.com besteht aus einem Modell für:
- Bildung von Ascosporen
- Ascosporen-Entladung
- Ascosporen-Infektion
Das Modell für die Konidienbildung verwendet die relative Luftfeuchtigkeit und die Lufttemperatur. Die Konidienbildung erfolgt, wenn die relative Luftfeuchtigkeit gleich oder höher als 70% ist. Die Geschwindigkeit der Konidienbildung ist von der Temperatur abhängig. Die optimale Temperatur für die Konidienbildung liegt bei 27°C bis 30°C. Bei dieser Temperatur werden maximal Konidien gebildet, wenn die relative Luftfeuchtigkeit 70% für mehr als 24 Stunden beträgt. Bei kühleren oder wärmeren Temperaturen dauert die maximale Konidienbildung 32 Stunden.
Das Modell für die Bildung von Ascosporen verwendet auch die Temperatur und die relative Luftfeuchtigkeit. Die Ascosporenbildung findet statt, wenn die relative Luftfeuchtigkeit gleich oder höher als 70% ist. Die optimale Temperatur liegt wiederum bei 27 °C bis 30 °C. Bei dieser Temperatur werden die meisten Ascosporen nach 48 Stunden erreicht. Bei niedrigeren Temperaturen dauert es 2 Tage, bis die maximale Menge an Ascosporen gebildet ist.
Der Ascosporenauswurf findet bei Regen statt. Die größte Menge an Ascosporen wird zu Beginn des Regens freigesetzt. Daher werden die Sporen zu Beginn der Infektion freigesetzt. Die Menge der freigesetzten Ascosporen ist auf die Anzahl der gebildeten Ascosporen begrenzt.
Die Infektion erfolgt bei Blattnässe oder einer relativen Luftfeuchtigkeit von mehr als 90%. Bei optimaler Temperatur ist die Infektion nach 12 Stunden unter feuchten Bedingungen abgeschlossen. Wenn die Temperatur nicht so hoch ist, dauert es 15 bis 24 Stunden.
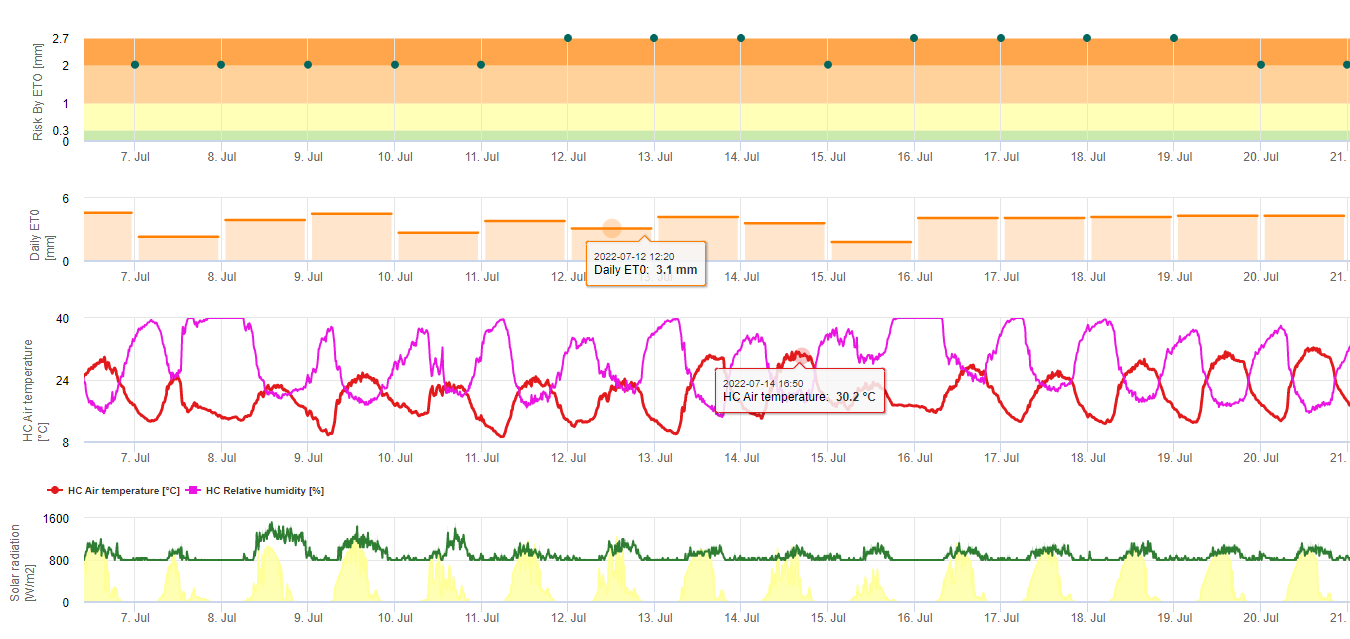
Schwarzes Sigatoka-Risikomodell
Zwei schwarze Sigatoka-Risikomodelle
Ein Modell (Sigatoka-Risiko durch ET) basiert auf a) der Bestimmung des Evapotranspiration (benötigte Sensoren: Temperatur, rel. Luftfeuchtigkeit, Windgeschwindigkeit und Globalstrahlung). Dieses Modell basiert auf den Arbeiten von Ganry, J. & Meyer,J.P. (1972): La lutte contrôlée contre le Cercospora aux Antilles. Bases climatiques de l'avertissement. Fruits 27(11):767-774. In dieser Studie wurde die ETpiche zur Bewertung der klimatischen Begünstigung von Sigatoka verwendet. Field.Climate verwendet die "Penman-Montheith"-Gleichung (die allgemeinste und am weitesten verbreitete Formel zur Berechnung der Referenz-ET) anstelle der ETpiche. Wenn die kumulierte Evapotranspiration der letzten 7 Tage ist:
> 40 mm Kein Risiko
> 30 mm Geringes Risiko
> 22 mm Durchschnittliches Risiko
< 22 mm Hohes Risiko
b) Das andere Modell (Sigatoka Risk by Infection) verwendet die Ergebnisse des Infektionsmodells, um die Infektionen und den Bereich der Niederschlag während dieser Infektion, um die Bedeutung dieser Infektionsereignisse zu bewerten. Die Menge des Regens während einer Infektion verantwortlich für die Vertrieb der Sporen. Je gleichmäßiger die Sporen auf dem anfälligen Gewebe verteilt sind, desto mehr Gewebe wird infiziert und desto größer ist die Ausbreitung der Krankheit. Eine Infektion ohne Regen hat den Krankheitsschweregrad 1. Eine Infektion mit weniger als 2, 5 und 10 mm Regen hat den Schweregrad 2, 3 oder 4. Wenn es mehr als 10 mm geregnet hat, beträgt der Schweregrad 5. Die Risikoanzeige erfolgt durch die Akkumulation dieser Schweregrade für die letzten 4 Tage. Bei einer Häufung von 0 besteht kein Risiko. Bei einer Häufung von weniger als 4 besteht ein geringes Risiko für Sigatoka. Bei einer Häufung zwischen 4 und 12 besteht ein mäßiges Risiko und bei mehr als 12 % akkumulieren innerhalb der letzten 4 Tage wird das Risiko als hoch eingestuft.
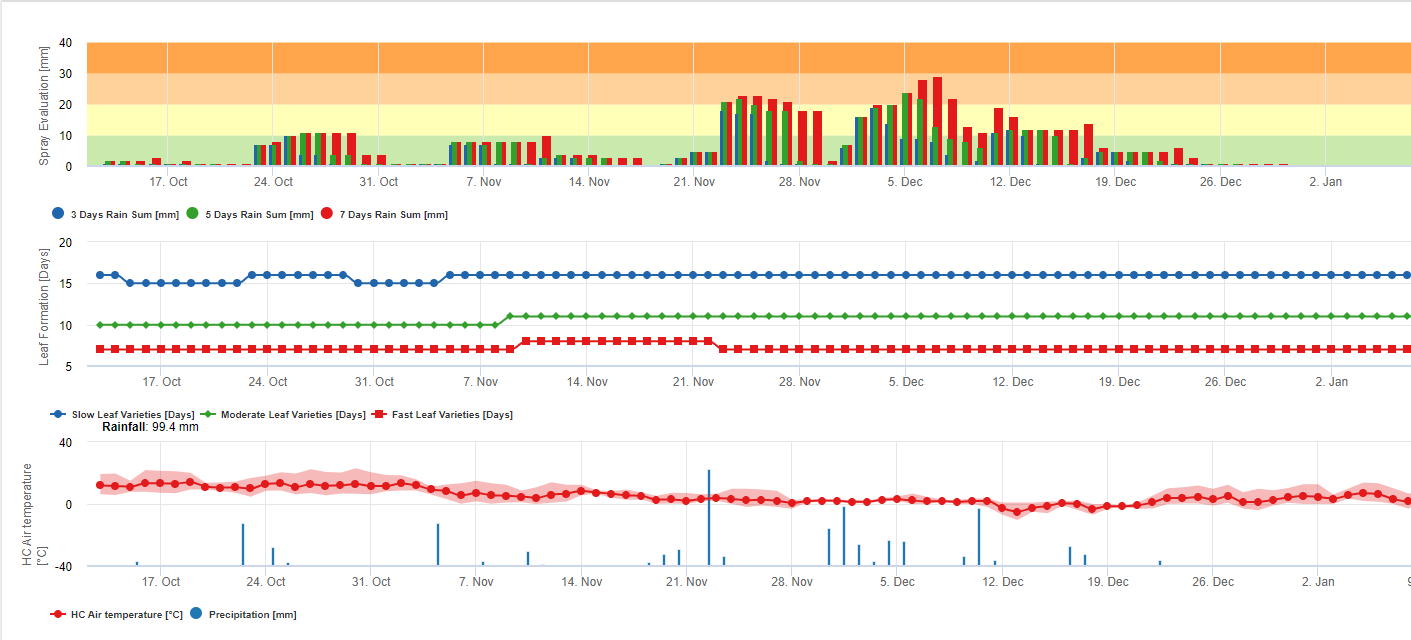
Informationen für Black Sigatoka Spray Bewertung
Anhäufung von Regen für die Rückstandsbewertung auf FieldClimate:
Wenn der Regen >= 3 mm ist, wird er gezählt und kumuliert:
- 3 Tage
- 5 Tage
- 7 Tage
Die akkumulierte Regensumme ergibt eine Grafik in Bezug auf einen Schwellenwert von 10, 20 und 30 mm.
Blattbildung für die Rückstandsbewertung bei FieldClimate:
Wenn Tag- und Nachtlufttemperaturen gleich sind:
12-14°C und 12-13°C dauert es 23, 16 oder 21 Tage 15-17°C und 14-15°C dauert es 20, 14 oder 10 Tage 18-20°C und 16-22°C dauert es <15, <12 oder <8 Tage 21-27°C und 16-22°C dauert es <13, <11 oder <6 Tage 28-30°C und 23-24°C dauert es <14, <12 oder <8 Tage 31-40°C und 25-40°C dauert es 20, 14 oder 10 Tage um alle Blätter bei Sorten mit durchschnittlicher, schneller und sehr schneller Blattbildung zu bilden.
Diese Informationen sollen helfen, ungeschütztes Gewebe zu bewerten. Gründe dafür könnten eine hohe Regenmenge seit der letzten Anwendung von Pflanzenschutzmitteln sein (Rückstände werden bereits abgewaschen oder es bilden sich neue Blätter.
Empfohlene Ausrüstung
Prüfen Sie, welcher Sensorensatz für die Überwachung potenzieller Krankheiten dieser Kultur benötigt wird.