Slunečnice modely onemocnění
Plísně puchýřnaté
Houba způsobující plíseň puchýřnatou na slunečnici je známá pod názvy Plasmopara halstedii nebo Plasmopara helianthi. Komplex houbových patogenů infikuje širokou škálu rodů z čeledi Asteraceae, včetně planě rostoucích a pěstovaných druhů hvězdnic. Helianthus. Choroba se vyskytuje všude, kde se pěstuje slunečnice.
Životní cyklus
Počínaje jedinou oosporou, která vyklíčí a dá vzniknout zoosporangiím, následuje diferenciace a uvolnění zoospor. V přítomnosti volné vody se zoospory brzy přesunou na místa infekce (kořen, hypokotyl), pokud jsou k dispozici. Po encystaci a prodloužení zárodečné trubice (ta obvykle končí v apresoriu proti hostitelské buňce) se u houby vytvoří infekční struktura (infekční kolík) pro přímý průnik. V experimentálních podmínkách bylo prokázáno, že zárodečné trubice obvykle netvoří apresoria ve vodě, ale v přítomnosti hostitelských buněk ano (Gray et al., 1985). Po penetraci houba roste intracelulárně a následně intercelulárně, a jakmile se usadí v citlivém (kompatibilním) hostiteli, začne systémově kolonizovat celou rostlinu růstem přednostně směrem k vrcholu výhonu a v menší míře směrem ke kořeni. Za příznivých podmínek dochází k asexuální sporulaci na napadených listech a příležitostně i na podzemních pletivech. Plně vyvinutá sporangia se šíří větrem, a protože jsou krátkověká a citlivá na sucho a přímé sluneční záření, závisí jejich přežití na aktuální povětrnostní situaci. Spory se vytvářejí také v infikovaných částech rostlin, především v kořenových a spodních pletivech stonků, zatímco listy a horní části rostlin, s výjimkou semen, jsou bez těchto odpočívajících spor (Sackston, 1981; Virányi, 1988; Onan a Onogur, 1991). Nejnáchylnější stadium vývoje hostitele je mezi klíčením a vzejitím (Meliala et al. 2000).
Přežití a zdroj inokula
Pokud jde o primární infekci, P. halstedii je půdní patogen. Jeho oospory slouží jako primární inokulum do podzemních pletiv mladých semenáčků slunečnice. Může se také přenášet větrem a způsobovat sekundární infekci listů a/nebo květenství. V druhém případě se houba může přenášet také semeny: napadená semena nesou mycelium a/nebo oospory uvnitř. Oospory se vyvíjejí hlavně v kořenových a spodních stonkových pletivech napadených rostlin, ať už s viditelnými příznaky nebo bez nich, a s rostlinnými zbytky předcházející slunečnicové plodiny se dostávají do půdy. Oospory jsou dlouhověké a jsou schopny přežívat nejméně 6-8 let (Sackston, 1981; Virányi, 1988). Obecně se předpokládá, že oospory klíčí především za vlhkých podmínek. Dosud však bylo k dispozici pouze několik výsledků o dynamice klíčení. Bylo prokázáno, že šok při nízké teplotě před navlhnutím a přítomnost exudátů uvolňovaných kořeny hostitele proces klíčení posilují (Delanoe, 1972). V jiné zprávě (Spring & Zipper 2000) nebylo možné pozorovat žádný takový vliv teploty a bylo zjištěno, že čerstvě vyvinuté oospory spontánně klíčí ve vodě během 10-30 dnů, ale s velmi variabilní rychlostí (1-17%).
Sekundární infekce je však považována za důležitý faktor šíření choroby v určitých oblastech za příznivých podmínek prostředí. Kromě toho, že sekundární infekce květenství může vést k latentní infekci semen, může být tato infekce způsobena i P. halstedii (Sackston, 1981), z lokálních lézí na listech je houba schopna prorůst do stonku a způsobit systémovou infekci (Spring 2001).
Epidemiologie
Povaha inokula (oospory nebo zoospory), povětrnostní vlivy (relativní vlhkost, teplota), místo infekce (stáří tkáně) a také reakce kultivaru jsou faktory, které ovlivňují nebo určují průběh infekce, výskyt a závažnost choroby. Zoospory, pocházející buď z pohlavní, nebo nepohlavní sporulace, vyžadují volnou vodu, aby si zachovaly životaschopnost a schopnost pohybu směrem k místům infekce. Předpokladem pro zahájení infekce jsou proto dešťové srážky nebo intenzivní zavlažování. Několik studií prokázalo, že pokud byl během prvních dvou týdnů po výsevu dostatek deště nebo odpovídající přísun vody, zvýšil se výskyt primární infekce z půdy. Doba, která podporuje infekci, je však poměrně krátká a i náchylné slunečnice se s věkem stávají odolnými (Sackston, 1981). Tourvieille et al. (2008a) zjistili, že riziko napadení plísní puchýřnatou se jeví jako největší v případě silných dešťů v době, kdy jsou semenáčky slunečnice v nejnáchylnějším stádiu, zatímco silné deště před výsevem nebo po vzejití neměly na procento nemocných rostlin žádný vliv. Göre (2009), že nízké teploty a rozsáhlé jarní deště v přibližně 85% ztrátě výnosu a nižší kvalitě produkce slunečnice v marmarské oblasti Trace. Kromě podmínek prostředí může být intenzita choroby ovlivněna také agresivitou populace patogenu. Sakr et al. (2009) dokázali rozlišit dva kmeny patogenu z hlediska jejich agresivity na základě latentní periody populace a hustoty sporulace.
Aspekty přenášené osivem
P. halstedii se vyskytuje v semenech slunečnice z přirozeně infikovaných rostlin, a to buď jako mycelium, nebo oospory (Novotel'nova, 1966). Doken (1989) uvádí, že mycelium se nacházelo pouze v testamentu a ve vnitřní vrstvě perikarpu; v embryu se nevyskytovalo. Po umělé inokulaci Cohen a Sackston (1973) potvrdili, že pupeny slunečnice inokulované P. halstedii se systémově infikovaly a produkovaly infikovaná semena. Oospory byly pozorovány v semenech inokulovaných a přirozeně infikovaných rostlin na poli. Další záznamy o infekci semen jsou známy z Íránu (Zad, 1978), Turecka (Döken, 1989) a Německa (Spring, 2001). Houba obvykle napadá vaječník a perikarp, ale neprorůstá do embrya (Novotel'nova, 1966; Döken, 1989). U systémově infikovaných rostlin pravidelně dochází k infekci semen, pokud přežijí až do fáze kvetení. V takových případech je vývoj embrya často zpomalen nebo inhibován. Takové rostliny jsou navíc zakrslé a zřídkakdy se sklízejí. Mohou zvýšit lokální zásobu oospor na poli, ale pro šíření patogenu semeny na velké vzdálenosti se zdají být méně důležité než semena z pozdně infikovaných rostlin bez příznaků (Spring, 2001). Druhý typ infekce je velmi závislý na povětrnostních podmínkách během kvetení. V suchých letech je tedy počet semen kontaminovaných patogenem velmi nízký a nemusí přesáhnout několik z tisíce, ale po chladném a vlhkém období v červnu/červenci může být mnohem vyšší. Například Spring (2001) zjistil, že téměř 10% semen z pole v Německu bylo kontaminováno, a Döken (1989) za příznivých experimentálních podmínek pozoroval houbové struktury u 28% zkoumaných semen.
Vliv na kvalitu osiva
Semena slunečnice, která vyrostla na rostlinách napadených plísní, jsou buď nedostatečně vyvinutá, bezbarvá, nebo jen výjimečně vypadají zdravě. I v posledním případě jsou takto napadená semena nekvalitní, vytvářejí abnormální semenáčky a jejich klíčivost je nízká (Döken, 1989).
Další informace naleznete na domovské stránce společnosti CABI.
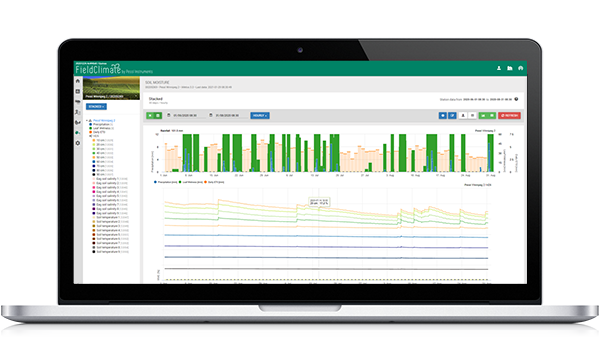
Model v FieldClimate
Použité senzory: teplota půdy, srážky, vlhkost listů, teplota a relativní vlhkost vzduchu.
Průběh infekce začínáme počítat, když se teplota pohybuje mezi 6 a 32 °C s optimem 18 až 24 °C a teplota půdy je vyšší než 10 °C. Dále jsou pro chorobu příznivé vlhké podmínky (dešťové události, relativní vlhkost vzduchu nad 70%).
Makrosporangia se tvoří při teplotách půdy nad 10 °C a srážkách (relativní vlhkost vyšší než 70%). K obnově dochází, pokud relativní vlhkost klesne pod 50%.
Pokud jsou makrosporangia plně vyvinuta - začíná se počítat s infekcí půdy nebo vzduchu (v grafu nazývaná primární infekce) (za podmínek vlhkosti listů).
Sporangia se tvoří za vlhka (více než 95% r.h.), ve tmě a při teplotách nad 12 °C. K obnově dochází během dne a v době, kdy sporangia nejsou plně vyvinuta.
Pokud jsou sporangia plně vyvinutá, začíná výpočet sekundární infekce v závislosti na teplotě vzduchu.
V Grafu se koncem dubna objevuje dlouhotrvající vlhké období, které vede k tvorbě makrospor a infekci půdy (primární infekce kořenů). Vzdušná infekce (zde nazývaná primární infekce) nebyla stanovena na 1. května, ale podmínky byly příznivé, takže byla stanovena 2. května. Pokud jsou v této době sazenice slunečnice v citlivém stádiu (právě vyseté), je třeba počítat s kontrolními měřeními ( profylaktické systémové fungicidy, většinou kyseliny fosforečné).
Odkazy:
- Achbani EH, Lamrhari A, Serrhini MN, Douira A, Tourvieille de Labrouche D, 1999. Hodnocení účinnosti ošetření osiva proti Plasmopara halstedii. Bulletin OEPP, 29(4):443-449; 15 ref.
- Achbani EH, Tourvieille D, 1993. Le tournesol au Maroc. Phytoma, 448:30-32.
- Agrawal SC, Gupta RK, Prasad KVV, 1991. A case of downy mildew of sunflower in Madhya Pradesh. Journal of Oilseeds Research, 8(1):126
- Albourie JM, Tourvieille J, Labrouhe DTde, 1998. Rezistence izolátů patogenu slunečnice Plasmopara halstedii k metalaxylu. European Journal of Plant Pathology, 104(3):235-242; 27 ref.
- Albourie JM, Tourvieille J, Tourvieille de Labrouhe D, 1998. Rezistence k metalaxylu u francouzských izolátů padlí. In: Gulya T, ed. Vear F, ed. Proc. Third Sunflower Downy Mildew Symposium, Fargo, USA: ISA, 235-242.
- Bán R, Kovács A, Körösi K, Perczel M, Turóczi G, 2014. První zpráva o výskytu nového patotypu, 714, Plasmopara halstedii (slunečnicová puchrovitost) v Maďarsku. Plant Disease, 98(11):1580-1581.
- Bán R, Kovács A, Perczel M, Körösi K, Turóczi G, 2014. První zpráva o zvýšeném rozšíření patotypu 704 Plasmopara halstedii v Maďarsku. Plant Disease, 98(6):844.
- Batinica J, Bes A, Dimic N, Numic R, Radman L, Ristanovic M, Vaclav V, 1973. Příspěvek k poznání škodlivé fauny a příčin chorob slunečnice v oblasti jejího pěstování v republice Bosna a Hercegovina. Radovi Poljoprivrednog Fakulteta Univerziteta u Sarajevu, 21/22(24/25):203-210.
- Berlese AN, De-Toni JB, 1888. Phycomycetteae. In: Sylloge fungorum, VII:242.
- Bohár G, Vajna L, 1996. Výskyt mikroskopických hub patogenních pro Ambrosia artemisifolia var. elatior (L.) Descourt. v Maďarsku. Növényvédelem, 32:527-528.
- Borovkov AY, McClean PE, 1993. Tandemově opakovaná sekvence z genomu Plasmopara halstedii. Gene, 124(1):127-130
- Borovkova IG, Borovkov AY, McClean PE, Gulya TJ, Vick BA, 1992. Polymorfismy délky restrikčních fragmentů a RAPD markery v DNA houby Plasmopara halstedii, puchýřnatky slunečnice. Proceedings of the 13th International Sunflower Conference Volume 2, Pisa, Italy, 7-11 September 1992, 1420-1425; 9 ref.
- Bouterige S, Robert R, Bouchara JP, Marot-Leblond A, Molinero V, Senet JM, 2000. Produkce a charakterizace dvou monoklonálních protilátek specifických pro Plasmopara halstedii. Applied and Environmental Microbiology, 66(8):3277-3282; 33 ref.
- Bouterige S, Robert S, Marot-Leblond A, Senet JM, 2000. Vývoj testu ELISA pro detekci antigenů Plasmopara halstedii v osivu. In: Proc. 15th Int. Sunflower Conference Toulouse, France: ISA (F):44-49.
- CABI/EPPO, 1998. Distribuční mapy karanténních škůdců pro Evropu (editoři: Smith, I. M. a Charles, L. M. F.). Wallingford, Velká Británie: CAB International, xviii + 768 pp.
- CABI/EPPO, 2014. Plasmopara halstedii. Mapa rozšíření. Distribuční mapy chorob rostlin, č. říjen. Wallingford, Velká Británie: CABI, mapa 286 (vydání 6).
- Choi YJ, Park MJ, Shin HD, 2009. První korejská zpráva o výskytu plísně Coreopsis lanceolata způsobené Plasmopara halstedii. Plant Pathology, 58(6):1171.
- CMI, 1988. Mapy rozšíření chorob rostlin. Mapa č. 286. Wallingford, Velká Británie: CAB International.
- Cohen Y, Sackson WE, 1974. Infekce semen a latentní infekce slunečnice houbou Plasmopara halstedii. Canadian Journal of Botany, 52:231-238.
- Delanoe D, 1972. Biologie et epidemiologie du mildiou du tournesol (Plasmopara helianthi Novot.). CETIOM Informations Techniques, 29:1-49.
- Delen N, Onogur E, Yildiz M, 1985. Úroveň citlivosti k metalaxylu u šesti izolátů Plasmopara helianthi Novot. Journal of Turkish Phytopathology, 14(1):31-36.
- Delos M, Penaud A, Lafon S, Walser P, De Guenin MC, Tourvieille J, Molinero V, Tourvieille D, 1997. Le mildiou de tournesol - Une maladie toujours d'actualitT. Phytoma, 495á:15-16.
- Doken MT, 1989. Plasmopara halstedii (Farl.) Berl. et de Toni v semenech slunečnice a úloha infikovaných semen při produkci rostlin se systémovými příznaky. Journal of Phytopathology, 124(1-4):23-26.
- Duarte LL, Choi YJ, Barreto RW, 2013. První zpráva o výskytu plísně způsobené Plasmopara halstedii na Gerbera jamesonii v Brazílii. Plant Disease, 97(10):1382.
- EPPO, 2014. Databáze PQR. Paříž, Francie: Evropská a středomořská organizace pro ochranu rostlin.
- Evropská a středomořská organizace pro ochranu rostlin, 2008. Plasmopara halstedii. Bulletin OEPP/EPPO Bulletin, 38(3):343-348.
- Garcia GM, Gulya TJ, 1991. Sunflower downy mildew race distribution in North Dakota and Minnesota. In: Proceedings of the 1991 Sunflower Research Workshop, Fargo, USA: National Sunflower Association, 3-5.
- Giresse X, Labrouhe DTDe , Richard-Cervera S, 2007. Twelve polymorphic expressed sequence tags-derived markers for Plasmopara halstedii, the causal agens of sunflower downy mildew (Dvanáct polymorfních markerů odvozených od exprimovaných sekvenčních značek pro Plasmopara halstedii, původce padlí slunečnicového), 7:1363-1365.
- Göre ME, 2009. Epidemické výskyty plísně způsobené houbou Plasmopara halstedii na slunečnici v Thrákii, části Marmarské oblasti v Turecku. Plant Pathology, 58(2):396.
- Gray AB, Sackston WE, Thauvette L, 1985. Vývoj infekčních struktur Plasmopara halstedii v suspenzi buněk slunečnice. Canadian Journal of Botany, 63(10):1817-1819.
- Gray B, Sackston WE, 1983. Studie tkáňových a buněčných kultur slunečnice inokulovaných Plasmopara halstedii. Canadian Journal of Plant Pathology, 5:206.
- Greathead DJ, Greathead AH, 1992. Biological control of insect pests by insect parasitoids and predators: the BIOCAT database. Biocontrol News and Information, 13(4):61N-68N.
- Gullino ML, Garibaldi A, 1988. Kryptogamické choroby hlavních rostlin pěstovaných v květináčích. Panorama Floricolo, 13(5):4-8.
- Gulya TJ, 1995. Jednoduchá metoda hodnocení reakce kořenů "odolných" linií slunečnice vůči plísni révokazné. In: Proceedings of the 17th Sunflower Research Workshop, Fargo, USA: National Sunflower Association, 63-66.
- Gulya TJ, 1995. Proposal for a revised system of classification races of sunflower downy mildew. In: Proceedings of the 17th Sunflower Research Workshop, Fargo, USA: National Sunflower Association, 76-78.
- Gulya TJ, 1996. Sunflower diseases in the Northern Great Plains (Choroby slunečnice na severu Velkých plání). In: Proceedings of the 18th Sunflower Research Workshop, Fargo, USA: National Sunflower Association, 24-27.
- Gulya TJ, 2000. Rezistence k metalaxylu u plísně slunečnicové a kontrola pomocí genetiky a alternativních fungicidů. In: 15th Int. Sunflower Conference Toulouse, France: ISA (G):16-21.
- Gulya TJ, 2007. Distribution of Plasmopara halstedii races from sunflower around the world, 3:121-134.
- Gulya TJ, Rashid KY, Masirevic SM, 1997. Sunflower Diseases. In: Schneiter AA, ed. Sunflower Technology and Production. Číslo 35 v řadě Agronomie. Wisconsin, USA: Amer. Soc. Agronomy, 263-379.
- Gulya TJ, Sackston WE, Viranyi F, Masirevic S, Rashid KY, 1991. Nové rasy patogenu slunečnicové puchýřnatosti (Plasmopara halstedii) v Evropě a Severní a Jižní Americe. Journal of Phytopathology, 132(4):303-311.
- Gulya TJ, Tourvieille de Labrouhe D, Masirevic S, Penaud A, Rashid K, Viranyi F, 1998. Proposal for standardized nomenclature and identification of races of Plasmopara halstedii (sunflower downy mildew). In: Gulya T, ed. Vear F, ed. Third Sunflower Downy Mildew Symposium. Fargo, USA: ISA, 130-136.
- Gulya TJ, Virányi F, Nowell D, Serrhini MN, Arouay K, 1996. New races of sunflower downy mildew from Europe and Africa (Nové rasy plísně slunečnice z Evropy a Afriky). In: Proceedings of the 18th Sunflower Research Workshop, Fargo, USA: National Sunflower Association, 181-184.
- Gulya TJ, Woods DM, Bell R, Mancl MK, 1991. Diseases of sunflower in California. Plant Disease, 75(6):572-574.
- Hall G, 1989. Neobvyklé nebo zajímavé nálezy rostlinných patogenních oomycetů. Plant Pathology, 38(4):604-611
- Harmon PF, Dunkle LD, Latin R, 2003. Rychlá metoda založená na PCR pro detekci Magnaporthe oryzae z infikovaných vytrvalých trav. Plant Disease, 87(9):1072-1076.
- Heller A, Rozynek B, Spring O, 1997. Cytologické a fyziologické příčiny latentního typu infekce slunečnice způsobené Plasmopara halstedii. Journal of Phytopathology, 145(10):441-445; 15 ref.
- Henning AA, Franca Neto JB, 1985. Fyziologická rasa a zdroje rezistence k plísni šedé (Plasmopara halstedii (Farl.) Berlese et de Toni) v Brazílii. In: Proceedings of the 11th International Sunflower Conference, Mar del Plata, Argentina: Volume 2, 407-409.
- Hong CX, 2006. Plíseň Rudbeckia fulgida cv. Goldsturm způsobená Plasmopara halstedii ve Virginii. Plant Disease, 90(11):1461. HTTP://www.apsnet.org
- Hua Z, Ma G, 1996. Přehled výzkumu chorob slunečnice v Číně. In: Proceedings of the 14th International Sunflower Conference, Beijing, China: ISC-LAAS, 754-759.
- Intelmann F, Spring O, 2002. Analýza celkové DNA pomocí minisatelitních primerů a primerů s jednoduchými sekvenčními opakováními pro využití v populačních studiích u Plasmopara halstedii. Canadian Journal of Microbiology, 48(6):555-559; 25 ref.
- IPPC, 2010. První nález Plasmopara halstedii ve Spojeném království. Oficiální zpráva IPPC o škodlivých organismech, č. GBR-23/1. Řím, Itálie: FAO.
- Jardine DJ, Gulya TJ, 1994. První zpráva o výskytu plísně slunečnice způsobené houbou Plasmopara halstedii v Kansasu. Plant Disease, 78(2):208
- Kinga R, Bíró J, Kovács A, Mihalovics M, Nébli L, Piszker Z, Treitz M, Végh B, Csikász T, 2011. Výskyt nové rasy padlí slunečnicového v jihovýchodní oblasti maďarské Velké nížiny. (Újabb napraforgó-peronoszpóra rassz megjelenése Magyarországon, a Dél-kelet Alföldi régióban). Növényvédelem, 47(7):279-286.
- Kola K, 1980. Srovnávací studie odrůd slunečnice k posouzení jejich odolnosti vůči houbovým chorobám v oblasti Zadrima. Buletini i Shkencave Bujqesore, 19:87-94.
- Komjáti H, Walcz I, Virányi F, Zipper R, Thines M, Spring O, 2007. Charakteristika izolátu Plasmopara angustiterminalis z Xanthium strumarium. European Journal of Plant Pathology, 119(4):421-428.
- Kucmierz J, 1976. Plasmopara helianthi Novot., nový druh houby pro Polsko. Fragmenta Floristica et Geobotanica, 22(3):373-375.
- Labrouhe DDe , Walser P, Serre F, Roche S, Vear F, 2008. Vztah mezi jarními srážkami a infekcí slunečnice Plasmopara halstedii (plísní puchýřnatou). Cordoba, Španělsko, 8.-12. června 2008. In: Proceedings of the 17th International Sunflower Conference Vol. ed. by Velasco, L.. Saville, Španělsko: Rada pro zemědělství a rybolov, 97-102.
- Lafon S, Penaud A, Walser P, De Guenin M-Ch, Molinero V, Mestres R, Tourvieille D, 1996. Le mildiou du tournesol toujour sou surveillance. Phytoma, 484:35-36.
- Leite RMVBde C, Henning AA, Rodrigues SR, Oliveira MFde, 2007. Detection and variability of Plasmopara halstedii in Brazil and resistance of sunflower genotypes to downy mildew. (Detecção e variabilidade de Plasmopara halstedii no Brasil e avaliação da resistência de genótipos de girassol ao míldio). Summa Phytopathologica, 33(4):335-340.
- Leppik EE, 1966. Origin and specialization of Plasmopara halstedii complex in the Compositae (Původ a specializace komplexu Plasmopara halstedii v čeledi Compositae). FAO Plant Protection Bulletin, 14:72-76.
- Liese AR, Gotlieb AR, Sackston WE, 1982. Použití enzymatického imunosorbčního testu (ELISA) pro detekci plísně puchýřnaté (Plasmopara halstedii) ve slunečnici. In: Proceedings of the 10th International Sunflower Conference, Surfers Paradise, Australia, 173-175.
- Ljubič A, Gulya TJ, 1988. Cotyledon-limited systemic downy mildew infection. In: Proceedings of the 1988 Sunflower Research Workshop, Bismarck, USA: National Sunflower Association, 9.
- Masirevic S, 1992. Rasy puchýřnatky (Plasmopara halstedii) na slunečnici vyskytující se v naší oblasti a ve světě. Zbornik Radova, 20:405-408.
- Mayee CD, Patil MA, 1987. Downy mildew of sunflower in India (Plísně slunečnice v Indii). Tropical Pest Management, 33(1):81-82.
- Melero-Vara JM, Garcia-Baudin C, Lopez-Herrera CJ, Jimenez-Diaz RM, 1982. Regulace plísně slunečnice metalaxylem. Plant Disease, 66(2):132-135
- Melero-Vara JM, Molinero Luiz L, Merino A, Dominguez J, 1996. Razas de Plasmopara halstedii presentes en Espana y evaluacion de susceptibilidad en hibridos comerciales. In: Proceedings of the ISA Symposium I, Disease Tolerance in Sunflower, Beijing, China: International Sunflower Association, 7-13.
- Meliala C, Vear F, Labrouhe DTde, 2000. Vztah mezi datem napadení slunečnice plísní slunečnicovou (Plasmopara halstedii) a rozvojem symptomů. Helia, 23(32):35-44.
- Molinero-Ruiz ML, Domfnguez J, Melero-Vara JM, 2002. Rasy izolátů Plasmopara halstedii ze Španělska a studie jejich virulence. Plant Disease, 86(7):736-740; 28 ref.
- Moses GJ, 1989. New occurrence of downy mildew of sunflower in Andhra Pradesh. Journal of Research APAU, 17(1):73
- Nandeeshkumar P, Ramachandra K, Prakash HS, Niranjana SR, Shetty H, 2008. Induction of resistance against downy mildew on sunflower by rhizobacteria (Indukce rezistence slunečnice vůči plísni šedé pomocí rhizobakterií), 3(4):255-262.
- Nandeeshkumar P, Sarosh BR, Kini KR, Prakash HS, Shetty HS, 2009. Elicitace rezistence a proteinů souvisejících s obranou pomocí kyseliny beta-amino máselné u slunečnice proti patogenu plísni Plasmopara halstedii. Archives of Phytopathology and Plant Protection, 42(11):1020-1032.
- Nandeeshkumar P, Sudisha J, Ramachandra KK, Prakash HS, Niranjana SR, Shekar SH, 2008. Chitosanem indukovaná rezistence k plísni slunečnice způsobené Plasmopara halstedii. PMPP Physiological and Molecular Plant Pathology, 72(4/6):188-194.
- Nikolov G, 1981. Zástěra 35 SD, účinný přípravek v boji proti plísni slunečnice. Rastitelna Zashchita, 29(3):40-41
- Nishimura M, 1922. Studium Plasmopara halstedii. J. Coll. Agric, 3(XI):185-210.
- Novotel'nova NS, 1966. Puchýřnatost slunečnice. Moskva, SSSR: Nauka.
- Onan E, Onogur E, 1989. Downy mildew of sunflower (Plasmopara helianthi Novot.). Ege Universitesi Ziraat Fakultesi Dergisi, 26(1):271-286.
- Onan E, Onogur E, 1991. Studies on relation between host and pathogen of sunflower downy mildew (Plasmopara helianthi Novot.). Journal of Turkish Phytopathology, 20(1):1-10.
- Oros G, Viranyi F, 1987. Skleníkové hodnocení fungicidů pro ochranu slunečnice proti plísni slunečnicové (Plasmopara halstedii). Annals of Applied Biology, 110(1):53-63
- Patil MA, Mayee CD, 1988. Investigations of downy mildew of sunflower in India (Výzkum plísně slunečnice v Indii). In: Proceedings of the 12th International Sunflower Conference, Novi Sad, Yugoslavia: 2:42.
- Patil MA, Phad HB, Ramtirthkar MS, 1993. Výskyt a rozšíření nedávno zavlečené plísně slunečnice v Maháráštře. Journal of Maharashtra Agricultural Universities, 18(1):129-130.
- Rahmani Y, Madjidieh-Ghassemi S, 1975. Výzkum relativní odolnosti různých odrůd a inbredních linií slunečnice k plísni Plasmopara helianthi Novt. ve skleníku a v experimentálním polním testu, 1973. Iranian Journal of Plant Pathology, 11(3/4):96-104; 42-45.
- Rashid KY, 1991. Sunflower downy mildew in Manitoba. In: Proceedings of the Sunflower Research Workshop, Fargo, USA: National Sunflower Association, 12.
- Rashid KY, 1993. Incidence a virulence Plasmopara halstedii na slunečnici v západní Kanadě v letech 1988-1991. Canadian Journal of Plant Pathology, 15(3):206-210.
- Rivera Y, Rane K, Crouch JA, 2014. První zpráva o výskytu puchýřnatky způsobené Plasmopara halstedii na černooké Zuzaně (Rudbeckia fulgida cv. 'Goldsturm') v Marylandu. Plant Disease, 98(7):1005-1006.
- Roeckel-Drevet P, Coelho V, Tourvieille J, Nicolas P, Labrouhe DTde, 1997. Nedostatek genetické variability u francouzských identifikovaných ras Plasmopara halstedii, původce padlí slunečnice Helianthus annuus. Canadian Journal of Microbiology, 43(3):260-263; 23 ref.
- Roeckel-Drevet P, Tourvieille J, Drevet JR, Says-Lesage V, Nicolas P, Labrouhe DTde, 1999. Vývoj diagnostického testu polymerázové řetězové reakce pro detekci biotrofního patogenu Plasmopara halstedii ve slunečnici. Canadian Journal of Microbiology, 45(9):797-803; 27 ref.
- Rozynek B, Spring O, 2000. Patotypy plísně slunečnice v jižních částech Německa. Helia, 23(32):27-34; 18 ref.
- Rozynek B, Spring O, 2001. Inokulace listových disků, rychlý a přesný test pro screening tolerance k metalaxylu u slunečnice. Journal of Phytopathology, 149(6):309-312; 17 ref.
- Ruiz MLM, Dominguez J, Vara JMM, Gulya TJ, 2000. Tolerance k metalaxylu u španělských izolátů Plasmopara halstedii. In: 15th Int. Sunflower Conference Toulouse, France: ISA, (G):11-15.
- Sackston WE, 1981. Downy mildew of sunflower. In: Spencer DE, ed. The Downy Mildews. London, UK: Academic Press, 545-575.
- Sackston WE, 1992. Na běžícím pásu: šlechtění slunečnice na odolnost vůči chorobám. Annual Review of Phytopathology, 30:529-551; 123 ref.
- Sackston WE, Anas O, Paulitz T, 1992. Biologická kontrola plísně slunečnice. In: Abstracts of the American Phytopathological Society North-East Division Meeting, Portland, USA: 33.
- Sakr N, Ducher M, Tourvieille J, Walser P, Vear F, Labrouhe DTde, 2009. Metoda měření agresivity plísně slunečnice (Plasmopara halstedii). Journal of Phytopathology, 157(2):133-136.
- Says-Lesage V, Meliala C, Nicolas P, Roeckel-Drevet P, Tourvieille de Labrouhe D, Archambault D, Billaud F, 2001. Molekulární test na přítomnost plísně (Plasmopara halstedii) v semenech slunečnice. OCL - Ole^acute~agineux, Corps Gras, Lipides, 8(3):258-260; 5 ref.
- Schuck E, Jobim CIP, 1988. Choroby slunečnice roční (Helianthus annuus L.) ve Viamao a Santo Augusto, Rio Grande do Sul. Agronomia Sulriograndense, 24(2):221-232; 12 ref.
- Simay EI, 1993. Výskyt vzácných mikroskopických hub pozorovaných v budapešťských oblastech Budateteny a Cinkota. Mikologiai Kozlemenyek, 32(1-2):81-89
- Skoric D, 1994. Šlechtění slunečnice na odolnost vůči dominantním chorobám. In: Proceedings of the EUCARPIA Oil and Protein Crops Section, Symposium on Breeding of Oil and Protein Crops, Albena, Bulharsko, 30-48.
- Jaro O, 2000. Homothalické pohlavní rozmnožování u Plasmopara halstedii, plísně slunečnice. Helia, 23(32):19-26; 13 ref.
- Jaro O, 2001. Nesystémové infekce slunečnice Plasmopara halstedii a jejich předpokládaná úloha při šíření patogenu. Journal of Plant Diseases and Protection, 108:329-336.
- Spring O, Benz A, Faust V, 1991. Vliv infekce puchýřnatkou (Plasmopara halstedii) na vývoj a metabolismus slunečnice. Zeitschrift fur Pflanzenkrankheiten und Pflanzenschutz, 98(6):597-604.
- Spring O, Haas K, 2002. Složení mastných kyselin u Plasmopara halstedii a jeho taxonomický význam. European Journal of Plant Pathology, 108(3):263-267; 20 ref.
- Spring O, Miltner F, Gulya TJ, 1994. Nové rasy plísně slunečnice (Plasmopara halstedii) v Německu. Journal of Phytopathology, 142(3-4):241-244.
- Spring O, Rozynek B, Zipper R, 1998. Infekce jednotlivých spor plísní slunečnice. Journal of Phytopathology, 146(11/12):577-579; 7 ref.
- Spring O, Zipper R, 2000. Isolation of oospores of sunflower downy mildew, Plasmopara halstedii, and microscopical studies on oospore germination. Journal of Phytopathology, 148(4):227-231; 15 ref.
- Spring O, Zipper R, 2006. Důkaz asexuální genetické rekombinace u plísně slunečnice, Plasmopara halstedii. Mycological Research, 110(6):657-663.
- Sudisha J, Niranjana SR, Sukanya SL, Girijamba R, Devi NL, Shetty HS, 2010. Relativní účinnost strobilurinových přípravků při regulaci plísně slunečnice. Journal of Pest Science, 83(4):461-470.
- Thanassoulopoulos CC, Mappas CB, 1992. První zpráva o výskytu plísně slunečnice v Řecku. Plant Disease, 76(5):539
- Tourvieille J, Roeckel-Drevet P, Nicolas P, Tourvieille de Labrouhe D, 1996. Characterization of sunflower downy mildew (Plasmopara halstedii) races by RAPD. In: Proceedings of the 14th International Sunflower Conference, Beijing, 781-785.
- Vida R, 1966. Puchýřnatost slunečnice: významný návrat. Növényvédelem, 32:533-535.
- Virányi F, 1984. Nejnovější výzkum plísně slunečnice v Maďarsku. Helia, 7:35-38.
- Virányi F, 1988. Faktory ovlivňující tvorbu oospor u Plasmopara halstedii. In: Proceedings of the 12th International Sunflower Conference, Novi Sad, Yugoslavia, Vol, 2:32.
- Viranyi F, Gulya TJ, 1995. Inter-isolate variation for virulence in Plasmopara halstedii (sunflower downy mildew) from Hungary. Plant Pathology, 44(4):619-624.
- Virányi F, Gulya TJ, 1995a. Patogenní variabilita u Plasmopara halstedii. In: Gwatt, Švýcarsko: Abstracts of papers of the 1st International Symposium on Downy Mildew Fungi: Federation of European Microbiological Societies, Ciba-Geigy.
- Virányi F, Gulya TJ, 1996. Exprese rezistence v patosystému Plasmopara halstedii - slunečnice. In: Proceedings of the ISA Symposium I, Disease Tolerance in Sunflower, Beijing, China: International Sunflower Association, 14-21.
- Viranyi F, Sziraki I, 1986. Založení duálních kultur Plasmopara halstedii a slunečnice. Transactions of the British Mycological Society, 87(2):323-325.
- Viranyi F, Walcz I, 2000. Populační studie Plasmopara halstedii: hostitelská specifita a tolerance k houbám. In: Sborník 15. mezinárodní konference o slunečnici Toulouse, Francie: ISA, (I):55-60.
- Walcz I, Bogßr K, Virßnyi F, 2000. Study on an Ambrosia isolate of Plasmopara halstedii (Studie o izolátu Plasmopara halstedii z rodu Ambrosia). Helia, 23(33):19-24; 8 ref.
- Yang SM, Wei SE, 1988. Choroby slunečnice pěstované v provincii Liaoning, Čínská lidová republika. Plant Disease, 72(6):546
- Yorinori FT, Henning AA, Ferreira LP, Homechin M, 1985. Choroby slunečnice v Brazílii. In: Proceedings of the 11th International Sunflower Conference, Mar del Plata, Brazílie, 459.
- Zad J, 1978. Transmission of sunflower downy mildew by seed. Iranian Journal of Plant Pathology, 14(1/4):1-2; 1-7.
- Zazzerini A, 1978. The spread of Plasmopara helianthi Novot in relation to slope. Phytopathologia Mediterranea, 17(3):153-156
- Zazzerini A, 1983. Peronosporová choroba (Plasmopara helianthi Novot.) slunečnice: fyziologické rasy parazita a metody identifikace infikovaného materiálu. Informatore Fitopatologico, 33(2):117-119
- Zimmer DE, 1974. Fyziologická specializace mezi rasami Plasmopara halstedii v Americe a Evropě. Phytopathology, 64(11):1465-1467
Sklerotiniová hniloba
Karpogenní klíčení sklerocií je stimulováno obdobími trvalé půdní vlhkosti. Na povrchu půdy se vytvářejí apothecia, z nichž se do vzduchu uvolňují askospory. Infekce většiny druhů plodin je spojena především s askosporami, ale k přímé infekci zdravých, neporušených rostlinných pletiv z klíčících askospor obvykle nedochází. K infekci tkání listů a stonků zdravých rostlin dochází pouze tehdy, když klíčící askospory kolonizují odumřelá nebo stárnoucí pletiva, obvykle části květů, jako jsou abscedující okvětní lístky, před vytvořením infekčních struktur a penetrací. Myceliogenní klíčení sklerocií na povrchu půdy může rovněž vést ke kolonizaci odumřelé organické hmoty s následnou infekcí přilehlých živých rostlin. U některých plodin, například slunečnice, však může myceliogenní klíčení sklerocií přímo iniciovat proces infekce kořenů a bazálního stonku, což vede k vadnutí. Podnět pro myceliogenní klíčení a infekci slunečnice není znám, ale pravděpodobně závisí na nutričních signálech v rhizosféře pocházejících z hostitelských rostlin.
Proces infekce
Infekce zdravé tkáně závisí na vytvoření apresoria, které může mít jednoduchou nebo složitou strukturu v závislosti na povrchu hostitele. Ve většině případů dochází k průniku přímo přes kutikulu, nikoli přes stomata. Apresoria vznikají z terminálního dichotomického větvení hyf rostoucích na povrchu hostitele a skládají se z polštářku širokých, vícesemenných, krátkých hyf, které jsou orientovány kolmo k povrchu hostitele, k němuž jsou připojeny slizem. Složitá apresoria se často označují jako infekční polštáře. Ačkoli dřívější pracovníci považovali penetraci kutikuly za čistě mechanický proces, existují silné důkazy z ultrastrukturálních studií, že v procesu penetrace hraje roli také enzymatické trávení kutikuly. Je známo jen málo informací o S. sclerotiorum kutinázy, nicméně genom kóduje nejméně čtyři enzymy podobné kutináze (Hegedus nepublikováno). Zdá se, že během penetrace se do kutikuly hostitele uvolňuje velká vezikula, která se tvoří na špičce apresoria před penetrací. Po proniknutí kutikulou se vytvoří subkutikulární vezikula, z níž se rozvětvují velké hyfy, které prorůstají a rozpouštějí subkutikulární stěnu epidermis.
Infekce enzymatickým rozkladem epidemických buněk: Kyselina šťavelová působí ve spojení s enzymy rozkládajícími buněčnou stěnu, jako je polygalakturonáza (PG), a způsobuje destrukci hostitelské tkáně tím, že vytváří prostředí příznivé pro útok PG na pektin ve střední lamele. To následně uvolňuje nízkomolekulární deriváty, které indukují expresi dalších genů PG. Celková aktivita PG je skutečně indukována pektinem nebo monosacharidy odvozenými od pektinu, jako je kyselina galakturonová, a je potlačena přítomností glukózy. Zkoumání vzorců exprese jednotlivých genů Sspg odhalilo, že vzájemné působení mezi PG a hostitelem během různých fází infekce je jemně koordinované. (Dwayne D. Hegedus *, S. Roger Rimmer: Sclerotinia sclerotiorum: Kdy "být či nebýt" patogenem? FEMS Microbiology Letters 251 (2005) 177-184)
Hledání klimatických podmínek pro infekci S. sclerotiorum je třeba vzít v úvahu tvorbu apothecií, sporulaci, přímou infekci apothecii (i když k ní nedochází příliš často) a infekci ze zavedeného mycelia encymatickým rozkladem epidemických buněk. Tvorba apothecia a sporulace nastane, pokud po dešti o intenzitě větší než 8 mm následuje období vysoké relativní vlhkosti vzduchu trvající déle než 20 hodin při optimální teplotě 21 °C až 26 °C.
Přímá infekce apothecii lze očekávat po období navlhčení listů, po kterém následuje 16 hodin relativní vlhkosti vyšší než 90% při optimální teplotě 21 °C až 26 °C ("infekce apresorií"). Zatímco saprofytický růst s následnou encymatickou degratací epidermálních buněk ("hydrolytická infekce") lze očekávat při mírně nižší relativní vlhkosti 80% trvající po dobu 24 hodin za optimálních podmínek 21 °C až 26 °C.
Literatura:
- Lumsden, R.D. (1976) Pectolytic enzymes of Sclerotinia sclerotiorum and their localization on inected bean (Pektolytické enzymy Sclerotinia sclerotiorum a jejich lokalizace na infikovaném bobu). Can. J. Bot. 54,2630-2641.
- Tariq, V.N. a Jeffries, P. (1984) Appressorium formation by Sclerotinia sclerotiorum: scanning electron microscopy. Trans. Brit. Mycol. Soc. 82, 645-651.
- Boyle, C. (1921) Studie o fyziologii parazitismu. VI. Infekce způsobená Sclerotinia libertiana. Ann. Bot. 35, 337-347.
- Abawi, G.S., Polach, F.J. a Molin, W.T. (1975) Infection of bean by ascospores of Whetzelinia sclerotiorum. Phytopathology 65, 673-678.
- Tariq, V.N. a Jeffries, P. (1986) Ultrastruktura penetrace Phaseolus spp. bakterií Sclerotinia sclerotiorum. Can. J. Bot. 64, 2909- 2915.
- Marciano, P., Di Lenna, P. a Magro, P. (1983) Oxalic acid, cell wall degrading enzymes and pH in pathogenesis and their significance in the virulence of two Sclerotinia sclerotiorum isolates on sunflower. Physiol. Plant Pathol. 22, 339-345.
- Fraissinet-Tachet, L. a Fevre, M. (1996) Regulace produkce pektinolytických enzymů bakterií Sclerotinia sclerotiorum kyselinou galakturonovou. Curr. Microbiol. 33, 49-53.
Praktické využití modelu sklerotinie
Model infekce bílé nohy ukazuje období, kdy se očekává tvorba apothecií. Pokud jsou tato období koincidenční s obdobím kvetení řepky nebo řepky, musíme očekávat S. sclerotiorum infekce během vlhkého období. Spory vytvořené v apotheciích mohou být k dispozici jeden až několik dní. O možnosti infekce vypovídá výpočet průběhu infekce u přímých nebo nepřímých infekcí apresorií nebo encymatické degradace buněčné stěny. Pokud linie průběhu infekce dosáhne 100%, je třeba předpokládat infekci. Tyto infekce by měly být pokryty preventivně nebo fungicidem s kurativním účinkem proti S. sclerotiorum musí být použita.
Šedá plíseň
Šedá forma (Botrytis cinerea) je ničivá choroba s vysokým ekonomickým dopadem na produkci. B. cinerea infikuje květy a plody v období před zralostí.
Tento houbový patogen má velmi široký okruh hostitelů a infikuje více než 200 různých hostitelů. Houba roste saprofyticky a paraziticky.
Příznaky
Na slunečnici způsobuje patogen šedou plíseň na hlávce a stonku. Mezitím začnou zasychat listy. Tyto příznaky se objevují během dozrávání zrn na hlávce. Na zadní straně se objevují hnědé skvrny. Tyto skvrny jsou pokryty houbovým myceliem a sporami, což vyvolává dojem prašnosti. Spory se mohou šířit za vlhkého počasí.
Černá sklerocia zbavená dřeně se objevují na zbytcích plodin po sklizni nebo přímo na rostlinách, pokud jsou sklizeny příliš pozdě.
Houba přezimuje během zimy na povrchu půdy nebo v půdě jako mycelium nebo sklerocia. Na jaře začne přezimující forma klíčit a produkovat konidie. Tyto konidie se šíří větrem a deštěm a infikují nová rostlinná pletiva.
Klíčení je možné při relativní vlhkosti vyšší než 85%. Optimální teplota pro klíčení je 18 °C. Houbový patogen se může množit mnohonásobně.
Možnosti ovládání: Kontrola osiva může chránit rostliny před zvlhnutím. Chemická ochrana je obtížná vzhledem k odolnosti patogenu. Proto jsou prováděny pokusy o přirozené kontrolní strategie s Trichoderma harzianum.
Podmínky pro modelování infekce
B. cinerea infekce souvisí s volnou vlhkostí. Proto se v polní výrobě zjišťuje vlhkost listů, která je dobrým indikátorem.
Bulger et al. (1987) zkoumali korelaci mezi vlhkostí listů během kvetení a výskytem plísně šedé na plodech. Zjistili, že pro vyšší riziko infekce při teplotě 20 °C je zapotřebí období vlhka listů delší než 32 hodin. Při nižších teplotách musí být období vlhkosti listů pro infekci chorobou delší.
FieldClimate indikuje riziko Botrytis cinerea na základě období vlhkosti listů a teploty během těchto období.
Níže uvedený graf znázorňuje délku trvání mokrých listů v závislosti na skutečné teplotě potřebné pro Botrytis infekce. Pokud je riziko vyšší než 0, každá doba zvlhčení listů delší než 4 hodiny zvyšuje riziko o stejný poměr.
Den s dobou vlhkosti listů kratší než 4 hodiny se považuje za suchý den a sníží riziko o 20% skutečné hodnoty.
Praktické využití modelu šedé formy: Model označuje období s rizikem Botrytis infekce. Toto rizikové období v době květu jahodníku vede k infikovaným plodům. Čím déle trvá rizikové období a čím vyšší je riziko, tím vyšší je pravděpodobnost a počet infikovaných plodů. Riziko, které lze vzít v úvahu, závisí na trhu. Pěstitelé, kteří prodávají své plody do supermarketů, nebudou riskovat, protože vědí, že nemohou prodávat infikované plody. Zatímco pěstitelé, kteří prodávají své ovoce přímo lidem, mohou podstoupit vyšší riziko.
Literatura:
- Bulger M.A., Ellis M. A., Madden L. V. (1987): Vliv teploty a délky trvání vlhkosti na infekci květů jahodníku Botrytis cinerea a výskyt choroby u plodů pocházejících z infikovaných květů. Ecology and Epidemiology; Vol 77 (8): 1225-1230.
- Sosa-Alvarez M., Madden L.V., Ellis M.A. (1995): Vliv teploty a délky trvání vlhkosti na sporulaci Botrytis cinerea na zbytcích listů jahodníku. Plant disease 79, 609-615.
TomCast
TOMCAST (TOMato disease foreCASTing) je počítačový model založený na polních datech, který se snaží předpovědět vývoj houbových chorob, konkrétně rané skvrnitosti, septoriové skvrnitosti listů a antraknózy rajčat. Na poli umístěné záznamníky dat zaznamenávají každou hodinu údaje o vlhkosti listů a teplotě. Tyto údaje se analyzují po dobu 24 hodin a mohou vést k vytvoření modelu. Hodnota závažnosti onemocnění (DSV); v podstatě přírůstek vývoje onemocnění. Jak se DSV hromadí, tlak chorob na plodinu stále narůstá. Pokud počet nahromaděných DSV překročí interval postřiku, doporučuje se aplikace fungicidu ke zmírnění tlaku choroby.
TOMCAST je odvozen z původního modelu F.A.S.T. (Forecasting Alternaria solani on Tomatoes), který vyvinuli doktoři Madden, Pennypacker a MacNab? na Pennsylvania State University (PSU). Model F.A.S.T. z PSU byl dále upraven Dr. Pitbladem na Ridgetown College v Ontariu do podoby, kterou nyní známe jako model TOMCAST používaný Ohio State University Extension. DSV jsou: DSV (Disease Severity Value) je měrná jednotka přiřazená určitému přírůstku rozvoje choroby (rané plísně). Jinými slovy, DSV je číselné vyjádření toho, jak rychle nebo pomalu se choroba (raná plíseň) na poli rajčat hromadí. DSV se určuje na základě dvou faktorů: vlhkosti listů a teploty během "vlhkých listů". S rostoucím počtem hodin listové vlhkosti a teplotou se DSV hromadí rychleji. Viz níže uvedený graf závažnosti choroby.
Naopak při menším počtu vlhkých hodin na listech a nižší teplotě se DSV hromadí pomalu, pokud vůbec. Když celkový počet nahromaděných DSV překročí současnou hranici, která se nazývá interval postřiku nebo práh, doporučuje se postřik fungicidem, aby se ochránily listy a plody před rozvojem choroby.
Interval postřiku (který určuje, kdy byste měli postřik provést) se může pohybovat v rozmezí 15-20 DSV. Přesnou hodnotu DSV, kterou by měl pěstitel použít, obvykle dodává zpracovatel a závisí na kvalitě plodů a konečném využití rajčat. Dodržování intervalu postřiku 15 DSV představuje konzervativní použití systému TOMCAST, což znamená, že budete postřikovat častěji než pěstitel, který používá interval postřiku 19 DSV se systémem TOMCAST. Kompromis spočívá v počtu postřiků aplikovaných během sezóny a v potenciálním rozdílu v kvalitě plodů.
Na Michigan Staate University byly zahájeny studie, jejichž cílem je otestovat systém předpovědi chorob TomCast pro použití v boji proti listovým puchýřům na mrkvi. Systém TomCast byl komerčně používán při produkci rajčat a nedávno byl upraven pro použití při regulaci chorob chřestu. Zpracovatelská mrkev 'Early Gold' byla vysazena pomocí přesného vakuového secího stroje na výzkumné farmě MSU Muck Soils Research Farm do tří řádků vzdálených 18 palců od sebe na vyvýšeném záhonu dlouhém 50 stop. Záhony s mrkví byly rozmístěny po 64 palcích a rozteč mezi řádky byla 1 palec. Každé ze čtyř opakování pokusu bylo umístěno v samostatných blocích mrkve, které se skládaly z 36 záhonů. V každé replikaci bylo náhodně rozmístěno sedmnáct záhonů o délce 20 stop v šachovnicovém uspořádání. Ošetření byla aplikována pomocí zádového postřikovače CO2, který byl kalibrován na dodávku 50 galonů postřikového roztoku na akr pomocí plochých vějířových trysek 8002. Ošetření se skládala z neošetřeného postřiku a z aplikací s různým rozvrhem postřiku přípravkem Bravo Ultrex 82,5WDG (22,4 oz/A) střídaným s přípravkem Quadris 2,08SC (6,2 fl oz/A). Chemický program byl aplikován podle desetidenního kalendářního programu a také podle předpovědi předpovědní služby TomCast. Pro načasování aplikace fungicidů byly použity tři různé prahové hodnoty předpovědi 15, 20 a 25 DSV. Když kumulativní denní hodnoty DSV dosáhly stanovené prahové hodnoty, byl aplikován postřik. Každý režim ošetření byl zahájen při čtyřech různých úrovních tlaku choroby (0%, stopa, 5% a 10% listová skvrnitost). První ošetření bylo aplikováno 2. července a poslední aplikace jakéhokoli ošetření byla provedena 21. září. Před první aplikací bylo označeno deset stop každého středního řádku postřikových bloků, které byly použity pro týdenní hodnocení chorob (viz grafy níže). Výnosy byly zjišťovány ze stejného desetimetrového úseku řádku ručním sklízením mrkve, vrškováním a vážením.
To naznačuje, že první ošetření mrkve by mělo být provedeno, jakmile zjistíme první výskyt choroby na poli. Od této chvíle fungovalo dobře použití modelu TomCast s prahovou hodnotou 20 DSV nashromážděných od posledního postřiku.
Polní klima určuje závažnost infekce Alternaria ve dvou různých modelech:
Zdroj: Jim Jasinski, koordinátor TOMCAST pro OHIO, INDIANA a MICHIGAN
Model TomCast Alternaria
V závislosti na klimatických podmínkách hodin vlhkosti listů a teploty vzduchu se stanoví hodnoty závažnosti infekce (od 0 do 4, viz tabulka výše).
Doporučené vybavení
Zkontrolujte, jaká sada senzorů je potřebná pro sledování potenciálních chorob této plodiny.