Банан модели заболеваний
Банан - один из самых важных фруктов во всем мире. В сладком виде, как Dollar Banana, и в несладкой кулинарной форме он является основной частью рациона людей, живущих в тропических странах. С конца девятнадцатого века банан начинает становиться самым важным фруктом мировой торговли. Банан, выращенный в Центральной Америке и на Карибах, начали экспортировать в США и Европу. В настоящее время банан является важной частью фруктового корзины индустриальных стран. С ростом доходов в Китае и Восточной Европе новые рынки предъявляют новые требования к бананам.
Есть два важных момента пятнистые заболевания листьев в бананах: Желтая сигатока и черная сигатока. Желтая сигатока, вызываемая грибком Mycosphaerella musicola, распространилась по всем районам выращивания бананов, в то время как черная сигатока, вызываемая грибком M. fijiensis var. difformis была обнаружена на Фиджи. Черная сигатока проявляет гораздо большую вирулентность, чем желтая сигатока, и по этой причине она стала самым важным заболеванием бананов в большинстве стран, выращивающих бананы.
Болезнь черной сигатоки
Работа основана на следующих двух статьях:
- Болезнь черной листовой пятнистости; Вредители и болезни Американского Самоа Номер 10, Колледж сообщества Американского Самоа и природные ресурсы Кооперативные исследования и расширение. 2004
- Черная сигатока - растущая нить для выращивания бананов; Дуглас Х. Марин, Del Monte Fresh Produce; Рональд А. Ромеро, Chiquita Brands; Маурисио Гусман, Национальная банановая корпорация Коста-Рики; Тернер Б. Саттон, Государственный университет Северной Каролины, Роли
Черная листовая пятнистость (ЧЛП), или "черная сигатока", является наиболее вредоносным заболеванием листьев бананов во всем мире. Поражаются большинство районов тропиков и субтропиков, потери составляют 30-50%. Первое сообщение о BLS в Тихоокеанском регионе было получено 40 лет назад в долине Сигатока, Фиджи. Большинство фунгицидов, используемых в производстве бананов, предназначены для борьбы с BLS. Банан 'Williams' сорта Кавендиш, выращиваемый большинством коммерческих производителей, очень восприимчив к грибковому заболеванию. У зараженных растений меньше листьев, что приводит к уменьшению количества и размера плодов, задержке сбора урожая, преждевременному созреванию и снижению качества плодов.
Потенциальное воздействие
Черная сигатока вызывает разрушение тканей листьев банана, что влияет на фотосинтетические способности растения и может снизить урожайность до 50%. Черная сигатока является одним из основных факторов, ответственных за снижение объемов экспорта бананов в странах южной части Тихого океана. Коммерческие плантации, производящие бананы на экспорт, вынуждены поддерживать дорогостоящую программу опрыскивания фунгицидами для борьбы с черной сигатокой, что подвергается критике по соображениям охраны окружающей среды и здоровья человека. Однако, если не бороться с болезнью, плоды, выращенные на больных растениях, могут преждевременно созреть во время транспортировки и привести к дополнительным потерям. В последующие годы борьба с болезнью велась с помощью химических опрыскиваний (15-17 применений фунгицидов), но это значительно увеличило затраты на производство.
Затронутые растения
Определенные симптомы черной сигатоки были зарегистрированы только на Муса (Бананы), Musa paradisiaca (Подорожники), Musa acuminata (дикий банан) и Musa acuminata (subsp. bantesii и subsp. зебрина). Культивары различаются по реакции на патоген. Иммунитет не известен, и возможно, что другие дикие виды и подвиды Муса заражаются, но болезнь не получает значительного развития. Mycosphaerella fijiensis может также поражать рассаду диких бананов.
Сезон возникновения
Споры черной сигатоки легко образуются во время тропического и субтропического лета или в условиях высокая влажность и осадкиособенно если на листьях есть пленка свободной воды. Основным способом распространения является орошение дождем или разбрызгивание спор, но на более поздних стадиях развития болезни споры также принудительно попадают в воздушные потоки. Заражение происходит на самых молодых листьях растения во время и сразу после разворачивания, но более старые листья более благоприятны для развития болезни. Очевидные визуальные симптомы появляются примерно через 15-20 дней после первичного заражения.
Симптомы
Первые видимые симптомы заражения листьев - короткие красновато-коричневые линии длиной около 2 мм. Линии превращаются в коричневые полосы длиной 20-30 мм, которые расширяются в эллиптические пятна, коричневые на нижней стороне листа, черные на верхней поверхности. Пятна слегка утоплены и окружены желтоватым ореолом. Затем центр большого пятна становится серым, окаймленным черной линией и желтым ореолом. Наконец, пятна сливаются, и лист погибает.
Эпидемиология
Конидии и аскоспоры играют роль в распространении болезни. Конидии образуются в условиях высокая влажностьособенно если на листьях есть пленка свободной воды. Они образуются во время развития первых стадий болезни (особенно во время стадии 2, стадии 3 и стадии 4). Основными способами распространения являются дождь и брызги; конидии не разносятся ветром. Конидии связаны в основном с местным распространением болезни и имеют большое значение в периоды высокой влажности, частых проливных дождей и периодических ливней.
Потому что M. fijiensis производит относительно мало конидий, аскоспоры считаются более важными в распространении черной сигатоки (4,20). Однако Жакоме и др. (10) заявили, что конидии способны вызывать значительное количество заболеваний, а симптомы болезни идентичны тем, которые вызываются заражением аскоспорами. Он указал, что конидии приобретают большее значение в засушливые периоды, когда развитие болезни задерживается из-за наличия менее благоприятных климатических условий (10). Аскоспоры являются основным средством рассеивание на большие расстояния внутри насаждений и на новые участки, и являются обычным средством распространения во время длительных периодов влажной погоды (3,4,6,10, 11,15).
Аскоспоры образуются в псевдотециях в зрелых поражениях, которые часто встречаются на старых листьях растения или на мертвых листьях, лежащих на земле. Мередит и Лоуренс (14) сообщили, что псевдотеции образуются на обеих сторонах поверхности листа, но большее их количество присутствует на адаксиальной поверхности. И наоборот, Гаул и др. (6) обнаружили, что больше псевдотеций и аскоспор образуется на абаксиальной поверхности листа. Хотя Берт и др. (2) обнаружили, что на одну псевдотецию выделяется примерно 4,5 аскоспоры, это число кажется очень низким, учитывая высокую концентрацию инокулята, который присутствует в воздухе после дождя (4).
Выделение аскоспор
Требуется присутствие пленка воды после дождя или росы которая пропитывает псевдотеции и приводит к принудительному выбросу аскоспор через пограничный слой листьев, где они распространяются воздушными потоками (15,20). Созревание псевдотеции требует насыщения в мертвых тканях листьев в течение примерно 48 ч (3,4,7,10,11,15). В гавайских условиях концентрация аскоспор увеличивалась в течение ночи, была максимальной около 06:00 часов и значительно снижалась в течение дня. В дождливые дни пик концентрации наступал вскоре после начала дождя. Сезонное увеличение среднесуточных концентраций аскоспор связано с увеличением количества осадков и относительной влажности (15). Гаул (4), работая с бананами, сообщил о похожих результатах в условиях Коста-Рики. В то время как Мередит и др. (15) не нашли доказательств того, что на производство или выделение аскоспор влияет минимальная температура, Гаул (4) определил, что в Карибской зоне Коста-Рики в более сухие (или менее дождливые) месяцы года происходит снижение производства инокулята, что также является сезоном с самой низкой температурой. Аскоспоры разносятся ветром, однако их распространение на большие расстояния ограничено несколькими сотнями километров из-за их восприимчивости к ультрафиолетовому излучению (17). Последовательная связь между выделением аскоспор и развитием болезни не была показана, что ограничивает полезность отлова спор для прогнозирования болезни (5,11). Аскоспоры оседают в основном на нижней поверхности листа во время разворачивания нового листа, создавая полосатый рисунок инфекций на стороне, которая первой подвергается воздействию, что является отражением повышенного отложения спор на цилиндрическом листе канделы во время его разворачивания по сравнению со всей открытой пластинкой листа. Следовательно, большинство инфекций происходит на абаксиальной поверхности листьев (3,7).
Инфекция
Для проникновения зародышевых трубок в стому требуется от 48 до 72 часов (1,20), хотя гриб может расти эпифитно на поверхности листа до 6 дней, прежде чем проникнуть в листья (1). Успешное заражение способствует расширенный периоды высокой влажности и наличие свободной воды на листьях (3,7,13). Максимальное прорастание происходит при наличии свободной воды. Конидии прорастают в более широком диапазоне относительной влажности (от 92 до 100%), чем аскоспоры (от 98 до 100%). Влияние температура на прорастание может быть охарактеризована квадратичной функцией отклика с предполагаемым оптимумом 26,5°C (10). Стовер (21) наблюдал максимальный рост зародышевых трубок аскоспор при 26 - 28°C после 24 ч инкубации. Jacome и Schuh (8,9) сообщили, что старые листья более восприимчивы; однако E. Bureau (личное сообщение) и Romero (18) заметили, что молодые листья более восприимчивы (с первого по третий), чем старые.
Инкубационный период
Время между заражением и появлением симптомов варьируется в зависимости от погодных условий и восприимчивости растений (68). У бананов время заражения листьев, по оценкам, совпадает с появлением нового листа из верхушки псевдостебля (20). При очень благоприятных условиях в Коста-Рике и при наличии восприимчивого хозяина инкубационный период может составлять всего 13-14 дней, в то время как в периоды неблагоприятной погоды продолжительность инкубационного периода может увеличиваться до 35 дней. Аналогичные сообщения имеются из Нигерии по подорожнику (16). В сезон дождей инкубационный период составлял 14 дней, а в сухой сезон - 24 дня. Продолжительность инкубационного периода также зависит от восприимчивости сорта к M. fijiensis. Инкубационный период составил 26,2 и 25,1 дней, соответственно, у сортов FHIA 1 и FHIA 2, двух тетраплоидных синтетических гибридов, выведенных FHIA, по сравнению с 22,4 днями у восприимчивого сорта Гранде Наин (19).
После проникновения в лист, гифы <M. fijiensis колонизируют соседние клетки в течение примерно 7 дней без каких-либо признаков нарушения клеток. Вегетативные гифы могут выходить из стом и расти на поверхности листа, проникать в соседние стомы или производить конидиофоры и конидии. Этот эпифитный рост позволяет грибу колонизировать прилегающие ткани листа, что приводит к быстрому развитию симптомов (4,20). M. fijiensis обладает большей способностью проникать через несколько стомат, чем M. musicolaчто приводит к большей пятнистости, чем при использовании первого патогена (20).
Латентный период
Хотя конидии могут образовываться в поражениях, демонстрирующих ранние симптомы M. fijiensis и способствуют развитию эпидемии, латентный период определяется временем, когда грибок начинает производить поражения со зрелыми псевдотециями и аскоспорами, которые являются основным источником инокулята. Как и инкубационный период, латентный период также изменяется в зависимости от погодных условий, восприимчивости хозяина и интенсивности инфекции. Латентный период варьируется от 25 дней в сезон дождей (с июня по декабрь) до 70 дней в сухой сезон в Гуапилес, Коста-Рика. Когда погода благоприятствует выделению аскоспор и заражению, многие инфекции появляются на листьях. Когда инфекции плотные, они быстро объединяются на очень ранней стадии развития, ускоряя появление зрелых пятен, которые характеризуются наличием псевдотеций и аскоспор (22). В таких условиях листья быстро и сильно повреждаются. Латентный период также варьируется в зависимости от уровня устойчивости. Например, время от появления листьев до первого симптома зрелого пятна при одинаковых природных условиях для сорта Curraré, кулинарного банана, относящегося к подгруппе подорожника, составило 44 дня по сравнению с 34 днями для сорта Valery, банана, относящегося к подгруппе кавендиш (4). Термин "время развития болезни" широко используется в литературе по бананам в тропиках для обозначения скрытого периода и определяется как время между заражением и образованием зрелых пятен. Другим распространенным термином, используемым в литературе по бананам, является "время развития симптомов" или "переходный период", который представляет собой время от появления первых симптомов до появления зрелых пятен (6). Время развития симптомов дает хорошее представление о том, как быстро болезнь прогрессирует на листьях.
Литература:
- Beveraggi, A. 1992. Etude des interactions hôte-parasite chez des bananiers sensibles et résistants inoculés par Cercospora fijiensis responsible de la maladie des raies noires. Thèse de 3ème cycle. Университет Монпелье, Монпелье, Франция.
- Burt, J. P. A., Rosenberg, L. J., Rutter, J., Ramírez, F., and González, O. H. 1999. Прогнозирование распространения воздушно-капельным путем Mycosphaerella fijiensis, вызывающего черную болезнь Сигатока на бананах: Оценка количества перитециев и аскоспор. Ann. Appl. Biol. 135:369-377.
- Фуллертон, Р. А. 1994. Болезни листьев сигатоки. Страницы 12-14 в: Compendium of Tropical Fruit Diseases. R. C. Ploetz, G. A. Zentmyer, W. T. Nishijinia, K. G. Rohrbach, and H. D. Ohr, eds. Американское фитопатологическое общество, Сент-Пол, штат Массачусетс.
- Gauhl, F. 1994. Epidemiology and Ecology of black Sigatoka (Mycosphaerella fijiensis Morelet) on Plantain and Banana (Musa spp.) in Costa Rica, Central America. ИНИБАП, Монпелье, Франция.
- Gauhl, F. 2002. Являются ли споровые ловушки полезным инструментом для прогнозирования развития болезни Сигатока на коммерческих банановых плантациях. Страница 22 в: Int. Workshop Mycosphaerella Leaf Spot Dis. Bananas, 2nd - Programme and Abstracts. (Abstr.).
- Гауль, Ф., Пасберг-Гауль, К., и Джонс, Д. Р. 2000. Цикл болезни и эпидемиология. Страницы 56-62 в: Diseases of Banana, Abacá and Enset. D. R. Jones, ed. CAB International, Уоллингфорд, Великобритания.
- González, M. 1987. Enfermedades del cultivo del banano. Oficina de Publicaciones de la Universidad de Costa Rica, San José.
- Jacome, L. H., and Schuh, W. 1992. Влияние продолжительности увлажнения листьев и температуры на развитие черной болезни Сигатока на банане, зараженном Mycosphaerella fijiensis var. difformis. Фитопатология 82:515-520.
- Jacome, L. H., and Schuh, W. 1993. Влияние температуры на рост и конидиальное производство in vitro, а также сравнение инфекции и агрессивности in vivo среди изолятов Mycosphaerella fijiensis var. difformis. Trop. Agric. 70:51-59.
- Jacome, L. H., Schuh, W., and Stevenson, R. E. 1991. Влияние температуры и относительной влажности на прорастание и развитие зародышевых трубок Mycosphaerella fijiensis var. difformis. Фитопатология 81:1480-1485.
- Джегер, М. Дж., Эден-Грин, С., Треш, Дж. М., Йохансон, Дж. М., Уоллер, Дж. М., и Браун, А. Е. 1995. Banana diseases. Страницы 317-381 в: Bananas and Plantains. S. Gowen, ed. Chapman & Hall, London.
- Marín, D. H., and Romero, R. A. 1992. El combate de la Sigatoka negra. Boletín No. 4, Departamento de Investigaciones, Corporación Bananera Nacional, Costa Rica.
- Mayorga, M. H. 1990. La Raya negra (Mycosphaerella fijiensis Morelet) del plátano y del banano. I. Ciclo de vida del patógeno bajo las condiciones del Urabá. Revista ICA 25:69-77.
- Meredith, D. S., and Lawrence, J. S. 1969. Болезнь черной листовой полосы бананов (Mycosphaerella fijiensis): Симптомы болезни на Гавайях и заметки о конидиальном состоянии гриба-возбудителя. Trans. Br. Mycol. Soc. 52:459-476.
- Meredith, D. S., Lawrence, J. S., and Firman,I. D. 1973. Выделение и рассеивание аскоспор при заболевании бананов черной листовой пятнистостью (Mycosphaerella fijiensis). Trans. Br. Mycol. Soc. 60:547-554.
- Mobambo, K. N., Gauhl, F., Pasberg-Gauhl, C., and Zuofa, K. 1996. Оценка влияния сезона и возраста растений на реакцию подорожника на болезнь черной сигатоки. Crop Prot. 15:609- 614.
- Parnell, M., Burt, P. J. A., and Wilson, K. 1998. Влияние воздействия ультрафиолетового излучения при имитации солнечного света на аскоспоры, вызывающие черную болезнь Сигатока банана и подорожника. Int. J. Biometeorol. 42:22-27.
- Ромеро, Р. А. 1995. Динамика устойчивых к фунгицидам популяций Mycosphaerella fijiensis и эпидемиология черной сигатоки бананов. Ph.D. diss. Штат Северная Каролина, Роли.
- Ромеро, Р. А., и Саттон, Т. Б. 1997. Реакция четырех генотипов Musa при трех температурах на изоляты Mycosphaerella fijiensis из разных регионов. Plant Dis. 81:1139-1142.
- Стовер, Р. Х. 1980. Sigatoka leaf spot of bananas and plantains. Plant Dis. 64:750-756.
- Стовер, Р. Х. 1983. Влияние температуры на рост зародышевой трубки аскоспор Mycosphaerella musicola и Mycosphaerela fijiensis var. difformis. Fruits 38:625-628.
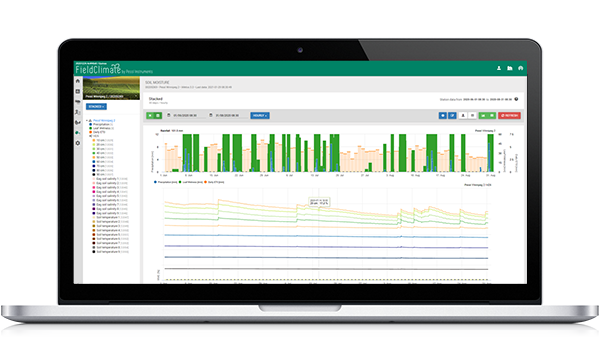
Модель заражения черной сигатокой
Модель инфекции Сигатока на FieldClimate.com состоит из модели для:
- Формирование аскоспор
- Выделение аскоспор
- Инфекция аскоспорами
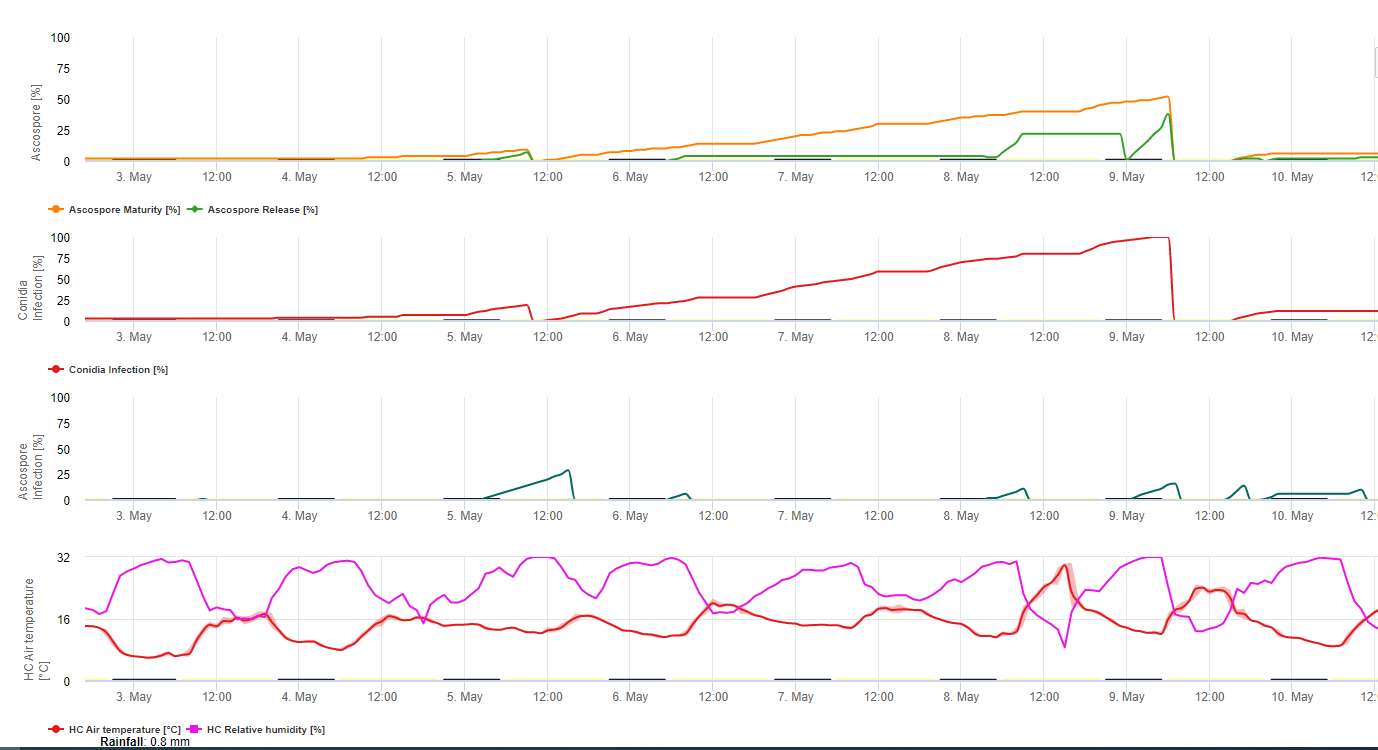
Модель образования конидий использует относительную влажность и температуру воздуха. Образование конидий происходит, если относительная влажность равна или выше 70%. Скорость образования конидий зависит от температуры. Оптимальная температура для образования конидий составляет от 27°C до 30°C. При этой максимальной температуре конидии будут образовываться, если относительная влажность воздуха 70% сохраняется более 24 часов. При более прохладной или теплой температуре максимальное образование конидий произойдет через 32 часа.
Модель образования аскоспор использует также температуру и относительную влажность. Образование аскоспор происходит, если относительная влажность равна или выше 70%. Оптимальная температура снова составляет от 27 °C до 30 °C. При такой температуре максимум аскоспор достигается через 48 часов. При более низкой температуре для образования максимального количества аскоспор потребуется 2 дня.
Выделение аскоспор происходит во время дождя. Основное количество аскоспор выделяется в начале дождя. Поэтому споры будут высвобождаться в начале заражения. Количество выделяемых аскоспор ограничено количеством сформировавшихся аскоспор.
Заражение происходит в периоды влажности листьев или относительной влажности выше, чем 90%. При оптимальной температуре заражение будет завершено через 12 часов влажных условий. Если температура не такая высокая, потребуется от 15 до 24 часов.
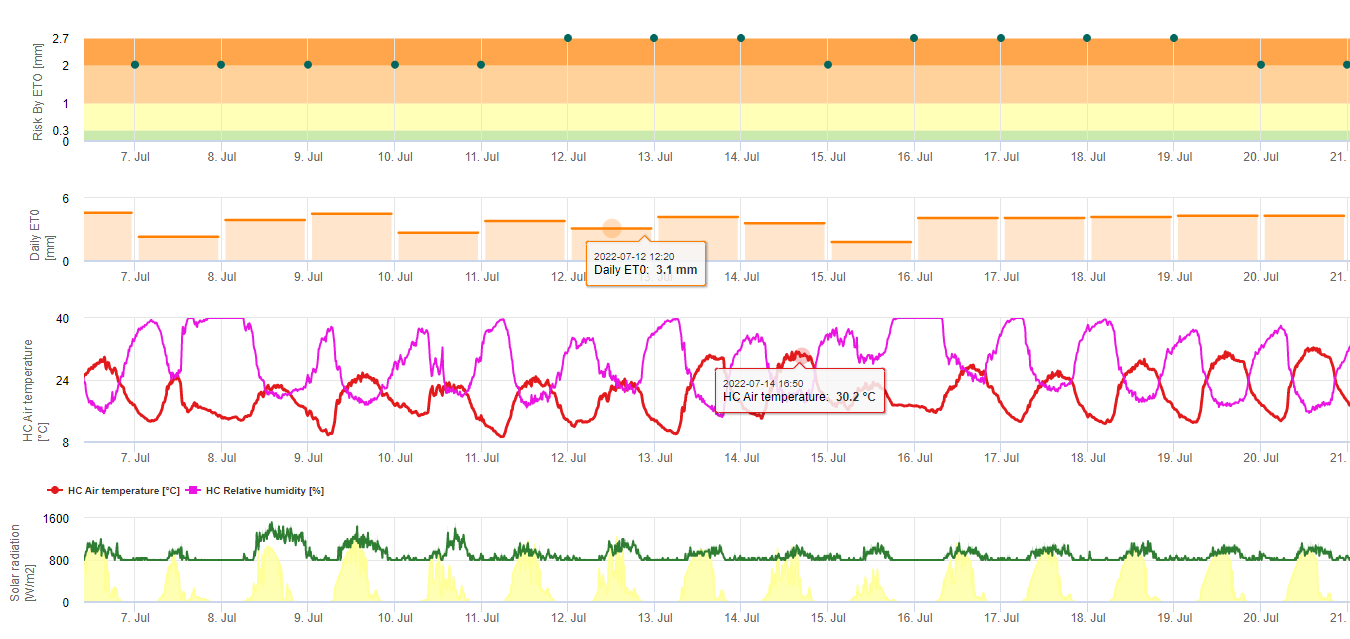
Модель риска Черная Сигатока
Две модели риска Черной Сигатоки
Одна модель (риск Сигатоки по ET) основана на a) определении эвапотранспирация (необходимые датчики: температура, относительная влажность, скорость ветра и глобальная радиация). Эта модель основана на работе Ganry, J. & Meyer,J.P. (1972): La lutte contrôlée contre le Cercospora aux Antilles. Bases climatiques de l'avertissement. Fruits 27(11):767-774. В данном исследовании для оценки климатической благоприятности для сигатоки использовался ETpiche. В Field.Climate вместо ETpiche используется уравнение "Пенмана-Монтейта" (наиболее общее и широко используемое уравнение для расчета эталонного ET). Если накопленная эвапотранспирация за последние 7 дней составляет:
> 40 мм Нет риска
> 30 мм Низкий риск
> 22 мм Средний риск
< 22 мм Высокий риск
b) Другая модель (Sigatoka Risk by Infection) использует результаты модели инфекции для доказательства инфекций и диапазона инфекций. осадки во время этой инфекции, чтобы оценить важность этого события инфекции. Количество осадков во время инфекции отвечает за распространение спор. Чем равномернее споры распределяются на восприимчивых тканях, тем больше тканей заражается и тем сильнее распространяется болезнь. Инфекция без дождя имеет степень тяжести заболевания 1. Инфекция с дождем менее 2, 5 и 10 мм имеет степень тяжести 2, 3 или 4. Если выпало более 10 мм осадков, значение тяжести равно 5. Индикация риска осуществляется путем накопления этих значений тяжести за последние 4 дня. При накоплении 0 риск отсутствует. При накоплении менее 4 риск для Сигатоки низкий. При накоплении от 4 до 12 - умеренный риск, а при накоплении от 4 до 12 - низкий риск. накапливать более 12 в течение последних 4 дней риск считается высоким.
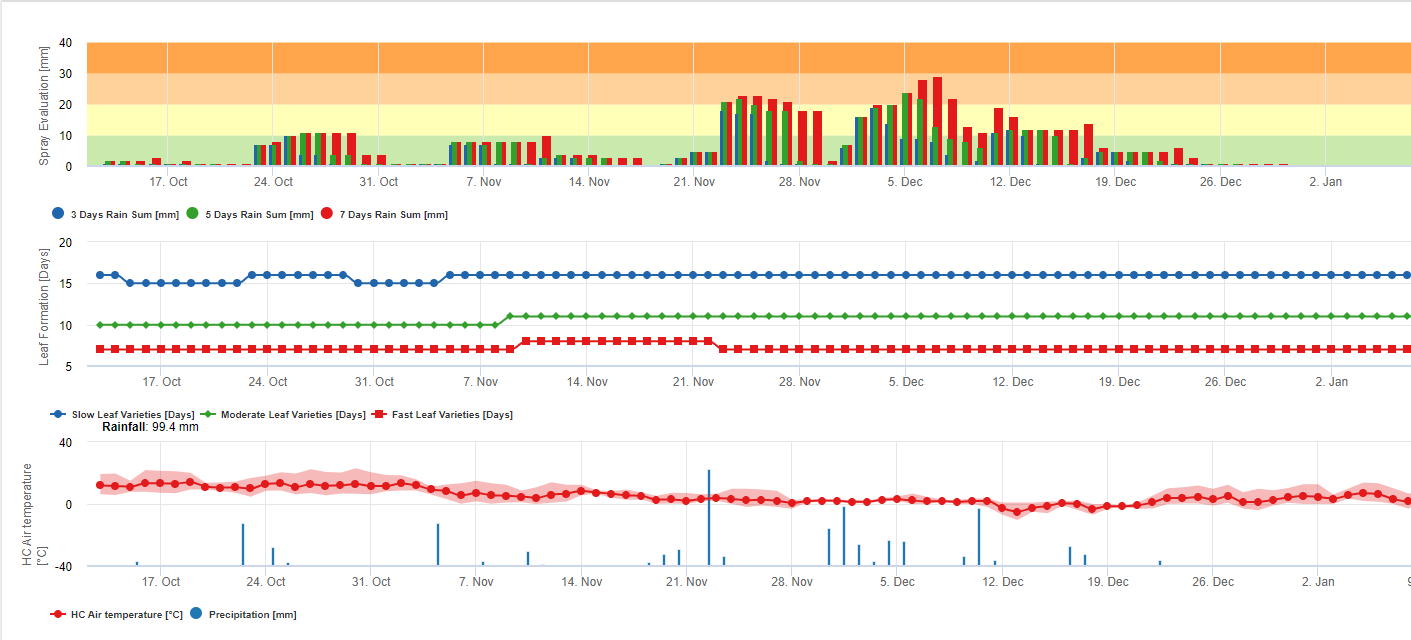
Информация для оценки спрея Black Sigatoka
Накопление дождя для оценки остатков на FieldClimate:
Если дождь составляет >= 3 мм, он учитывается и накапливается:
- 3 дня
- 5 дней
- 7 дней
Накопленная сумма дождя приводит к Графику по отношению к порогу в 10, 20 и 30 мм.
Формирование листьев для оценки остатков на FieldClimate:
Если дневная и ночная температуры воздуха равны:
12-14°C и 12-13°C требуется 23, 16 или 21 день 15-17°C и 14-15°C требуется 20, 14 или 10 дней 18-20°C и 16-22°C требуется <15, <12 или <8 дней 21-27°C и 16-22°C требуется <13, <11 или <6 дней 28-30°C и 23-24°C требуется <14, <12 или <8 дней 31-40°C и 25-40°C требуется 20, 14 или 10 дней для формирования всех листьев на сортах со средним, быстрым и очень быстрым формированием листьев.
Эта информация должна помочь оценить незащищенные ткани. Причинами этого могут быть большое количество дождей с момента последнего применения средств защиты растений (остатки уже смыты или образовались новые листья.
Рекомендуемое оборудование
Проверьте, какой набор датчиков необходим для мониторинга возможных заболеваний этой культуры.