Apple modele choroby
Najbardziej wyniszczającą chorobę jabłoni wywołuje patogen grzybowy Venturia inaequalis (Ascomycete).
Choroba ta występuje na całym świecie we wszystkich rejonach uprawy jabłek i jest pierwszą chorobą roślin, dla której opracowano i zastosowano w praktycznym ogrodnictwie modele chorób roślin oparte na danych pogodowych. Już Mills i Laplante potwierdzili w 1945 roku zależność pomiędzy czasem trwania zwilżenia liści a temperaturą prowadzącą do infekcji parcha jabłoni.
Dalsze modele zarazy ogniowej jabłoni (Erwinia amylovora) opartych na Blossom Blight (znanej również jako MaryBlight) i Cougar Blight szeroko stosowanych w stanie Waszyngton w Stanach Zjednoczonych są wdrażane. Modele te dają wskazówkę co do ryzyka wystąpienia zarazy ogniowej.
Ćma dorszowa (Cydia pomonella) model oparty jest na efektywnych temperaturach (pomiędzy 10 a 32°C). Model określa pierwsze pojawienie się po diapauzie i czas trwania stadium larwalnego od 1 do 5 oraz obecność osobników dorosłych na 5 poziomach (od aktywności lotnej bez składania jaj do aktywności lotnej z silnym składaniem jaj).
Rozmnażanie mszyc zależy głównie od temperatury. Godziny zbliżone do optymalnej temperatury i dostępność źródła pokarmu zwiększą tempo rozmnażania.
W przypadku modelu kumulacji deszczu, opady większe niż 5mm wyznaczane są na 5 różnych rozkładów grupujących.
Parch jabłoni
Parch jabłoni to najbardziej wyniszczająca choroba jabłoni. Wywołuje ją patogen grzybowy (Ascomycete) Venturia inaequalis. Choroba ta występuje na całym świecie we wszystkich rejonach uprawy jabłek. Była pierwszą chorobą roślin, dla której opracowano i wykorzystano w praktycznym ogrodnictwie modele chorób roślin oparte na danych pogodowych. MILLS i LAPLANTE (1945) opisali okres zwilżenia liści, który jest potrzebny do zainfekowania liści jabłoni.
Biologia parcha jabłoni
Pseudotecjum (forma płciowa) powstają w zainfekowanych tkankach roślinnych pod koniec sezonu. Mają średnicę 90-160 µm i można je zobaczyć gołym okiem lub przez soczewkę ręczną. Po zimie diploidalne pseudotecjum zaczyna tworzyć liczne asci, z których każda zawiera 8 askospor. Askospory te są odprowadzane przez deszcz, wiatr i zwilżenie liści i są odpowiedzialne za infekcję zielonej tkanki jabłoni. Woda jest jednym z najważniejszych czynników wzrostu i rozmnażania się grzybów, ascospory i konidia kiełkują w wolnej wodzie. Rurka kiełkująca tworzy apresorium (ciśnienie, enzym) i wnika w kutikulę rośliny. W okresie letnim grzyb ulega rozproszeniu przez konidia, zwane inokulum wtórnym, które podczas wilgotnej pogody powodują wtórne infekcje na liściach, owocach i pędach. Venturia inaequalis kolonizuje tylko gatunki z rodzaju Malus. W obrębie gatunków, odmian i kultywarów obserwuje się różne poziomy odporności. Liście i owoce stają się bardziej odporne w miarę dojrzewania.
Tworzenie i odprowadzanie askospor do infekcji tkanek roślinnych
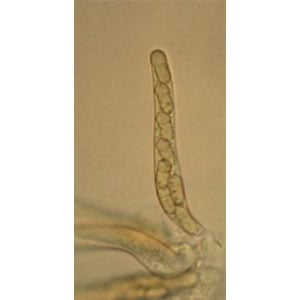

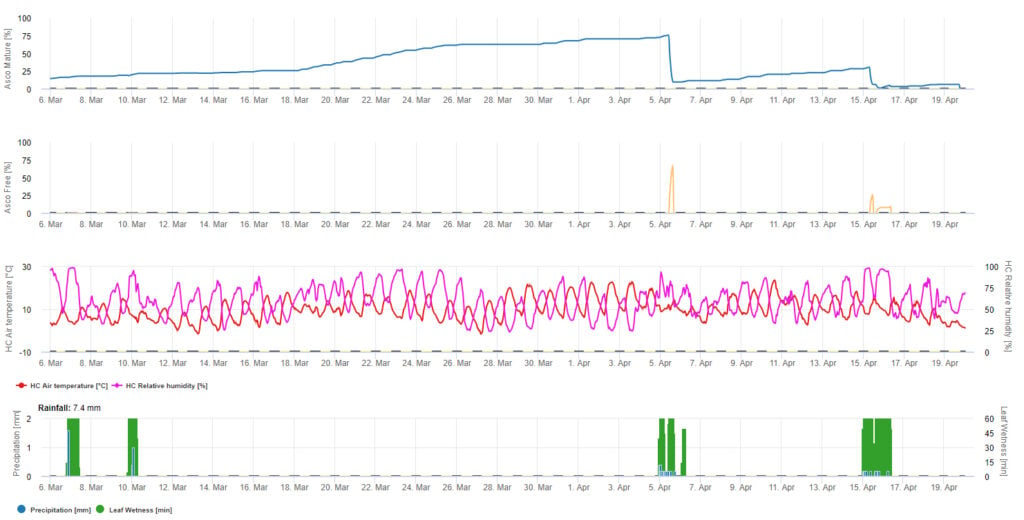

Vernturia inaequalis hibernują jako tzw. pseudotecja (ciało owocowe). Pseudothecia są dicariontyczne (diploidalne). Podczas tworzenia askospor mejotyczny podział komórki redukuje zestaw chromosomów i stają się one haploidalne. Po mejozie następuje mitoza i powstają liczne asci zawierające po 8 askospor. Formowanie askospor (Asco) ocenia się na podstawie liniowej kumulacji stopniodni na podstawie 10°C (= 1440 °godzin). Dojrzewanie askospor (Asc Reif) ma miejsce wiosną i wczesnym latem, w niektórych rejonach produkcji jabłek tygodnie przed pękaniem pąków, a w innych rejonach często w momencie pękania pąków. Porównanie różnych podejść do modelowania w celu oceny czasu uwalniania askospor wykazało, że uwalnianie askospor jest opóźnione przez okresy niskiej wilgotności. Oznacza to, że dojrzewanie askospor jest możliwe tylko wtedy, gdy wierzchnia warstwa gleby lub ściółki liściowej jest wystarczająco wilgotna.
Modelowanie dojrzewania askospor przewiduje się, gdy wilgotność względna jest wyższa niż 70%. Zakłada się, że szybkość i ilość dojrzałych ascospor jest proporcjonalna do skumulowanej temperatury powyżej 0°C. Zakłada się, że więcej niż 3 godziny powyżej -3°C powoduje redukcję dojrzałych askospor do 0.
Czynnikami wpływającymi na wysypywanie się askospor (Asc Frei) są wilgotność liści i światło. Jeśli liście są suche, nie dochodzi do wysypu askospor. Również światło jest potrzebne do tego, aby wydzielić dużą liczbę askospor. Na przykład: od 2 godzin po wschodzie słońca do 2 godzin po zachodzie słońca, gdy liście są wilgotne, może zostać uwolniona duża liczba askospor. Tak więc, bez słońca (noc i wyrzut askospor jest modelowany, gdy wilgotność i temperatura dla dojrzewania askospor jest podana, jak również liście są często mokre. Temperatura musi być powyżej 10°C. W większości obszarów uprawy jabłek nie będzie to miało miejsca ze względu na fakt, że w wilgotnych okresach wiosny temperatury są ograniczone.
Pierwotne zakażenie przez askospory


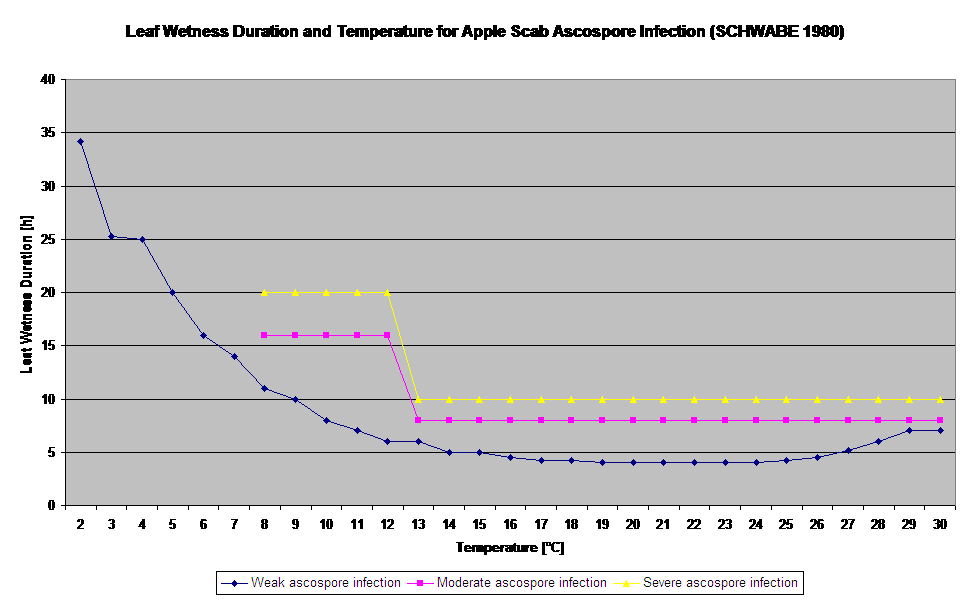
Kiełkowanie i penetracja askospor Venturia inaequalis na liściach lub owocach zależą od okresów zwilżenia liści (mokre liście lub wilgotność względna >80% (utrzymuje poziom infekcji do 80% r.h.)) i temperatury powietrza (powyżej 2°C). Wyższe temperatury prowadzą w warunkach wilgotnych do szybszej penetracji, natomiast przy niższych temperaturach potrzebne są dłuższe okresy zwilżenia liści. Zależność tę po raz pierwszy opublikowali MILLS i LAPLANTE (1945). Nasze obliczenia przeprowadzamy w oparciu o publikacje SCHWABE (1980). SCHWABE opisał nasilenie infekcji parcha w zależności od temperatury. Obserwacje te są zgodne z naszymi własnymi spostrzeżeniami.

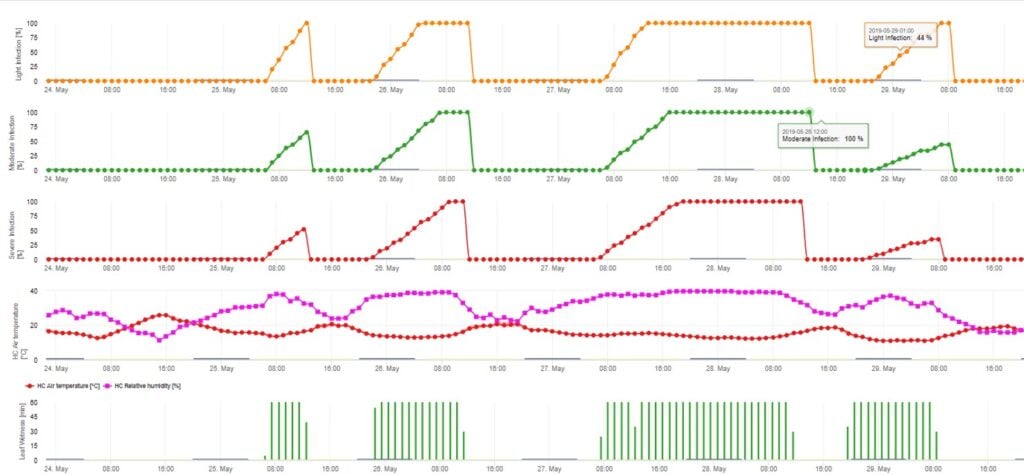
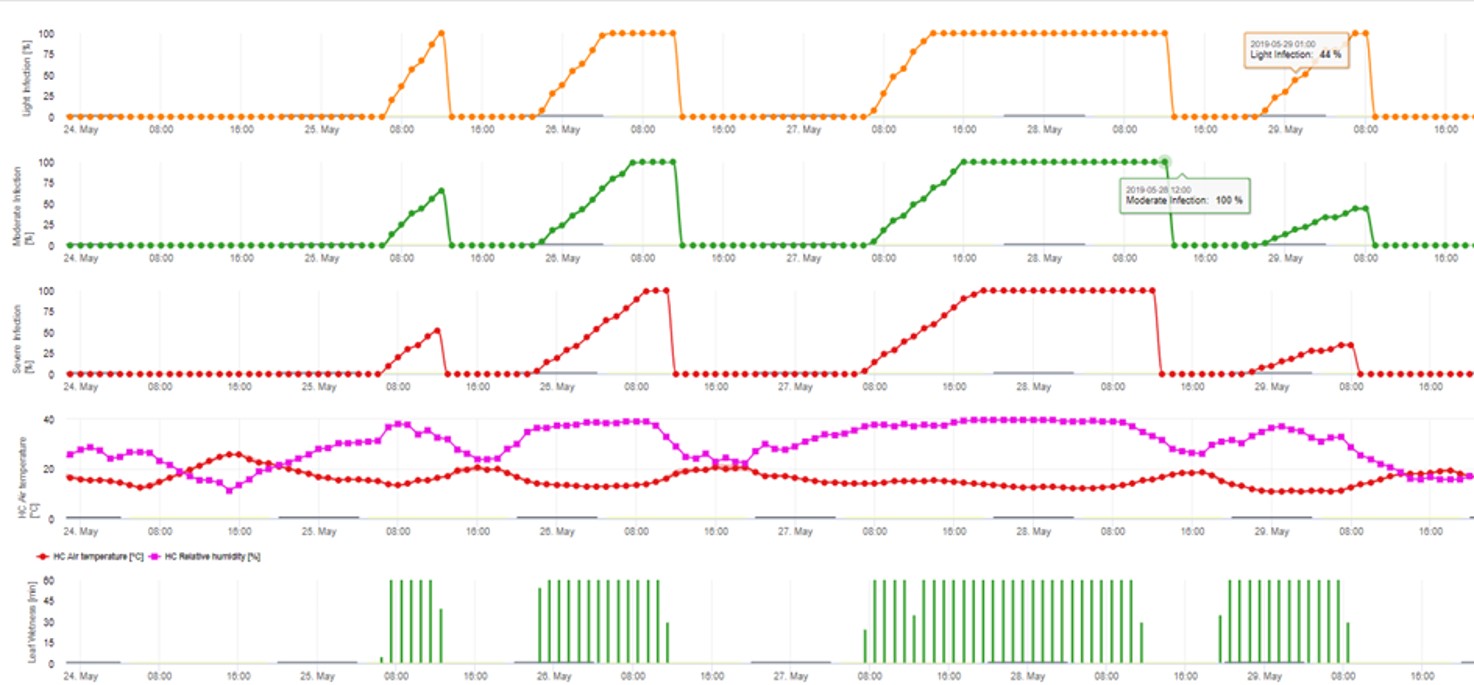
Model infekcji askosporowej oblicza postęp infekcji, w zależności od wilgotności liści i temperatury, dla infekcji słabych, umiarkowanych i ciężkich. Podział prognozy na trzy "klasy ciężkości" jest bardzo tradycyjny dla modeli parcha jabłoni. Postęp infekcji jest wyświetlany w formie graficznej dla wartości godzinowych. Infekcja ma miejsce, gdy tylko krzywa postępu dla słabej infekcji osiągnie 100%. Umiarkowana lub ciężka infekcja jest zakończona, jeśli krzywe postępu dla tych klas ciężkości osiągają (100%). Często w praktyce lub w rzeczywistości infekcja osiąga 70% lub 80% wczesnym rankiem i w zależności od aktualnej pogody będziesz mógł wiedzieć czy ta infekcja się skończy czy nie. Wyświetlanie dziennych maksymalnych wartości krzywej procesu infekcji daje przegląd przewidywanych terminów infekcji w sezonie.
Podstawowe zastosowanie modelu
Dla rynku absolutnie ważne jest, aby owoce jabłek były wolne od chorób, aby uzyskać dobrą cenę. Dlatego sadownicy najczęściej nie mają w ogóle tolerancji na parcha w swoich sadach. Model powinien być wdrożony do programu aplikacji leczniczej (zastosowanie oprysków zawierających związki cyprodynilu lub pirymetanilu przed kwitnieniem), gdy model wskazał na infekcję (nieważne czy słabą czy silną). W okresie kwitnienia i wczesnego przekwitania najczęstsze są silne infekcje i wszystkie wilgotne okresy zostały objęte opryskami ochronnymi. Dalej tkanka roślinna rośnie bardzo szybko, dlatego ochrona może działać tylko przez 4 dni. W tym przypadku może być również potrzebny oprysk leczniczy po niepełnym okresie infekcji. W tym przypadku ważne jest, czy infekcja była słaba czy silna, a także czy była niska czy wysoka liczba askospor gotowych do infekcji.
Literatura
- Schwabe WFS, 1980. Wymagania dotyczące wilgotności i temperatury dla infekcji liści jabłoni przez Venturia inaequalis w Afryce Południowej. Phytophylactica, 69-0.
- Schwabe WFS, 1980. Pogoda sprzyjająca infekcji parcha jabłoni w Afryce Południowej. Phytophylactica 12, 213-217.
- Mac Hardy W.E., 1996. Parch jabłoni biologia, epidemiologia i zarządzanie. St. Paul, MN: Am. Phytopathol. Soc.: 545.
Zakażenia wtórne przez konidia
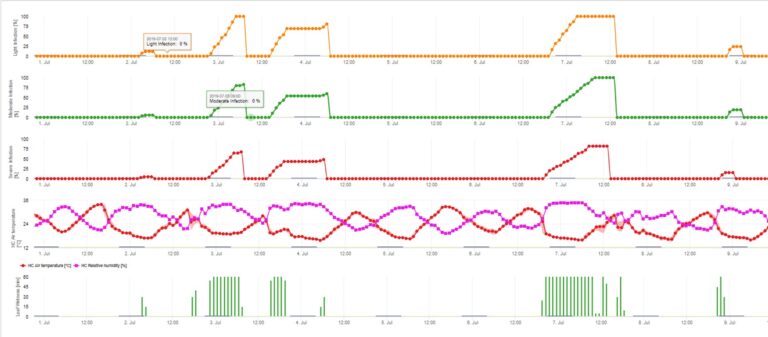


Infekcje parcha jabłoni przez konidia (bezpłciowe) zależą od tych samych czynników, co infekcje wywołane przez askospory. Różnica polega na tym, że konidia są zdolne do uwalniania się w warunkach jasnych i ciemnych, a infekcje konidialne mają miejsce głównie w okresie letnim.
W zależności od reżimu temperatury powietrza konidia Venturia inaequalis potrzebują dłuższych lub krótszych okresów zwilżenia liści do kiełkowania i wnikania w liście lub owoce jabłoni. Zależność tę po raz pierwszy opublikowali MILLS i LAPLANTE (1945). Nasze obliczenia przeprowadzamy w oparciu o publikacje SCHWABE (1980). Tam gdzie Mills i LAPLANTE (1945) zakładali jedynie, że konidia potrzebują określonego czasu zwilżenia liści; SCHWABE (1980) uwzględnił również znaczenie temperatury w procesie infekcji.
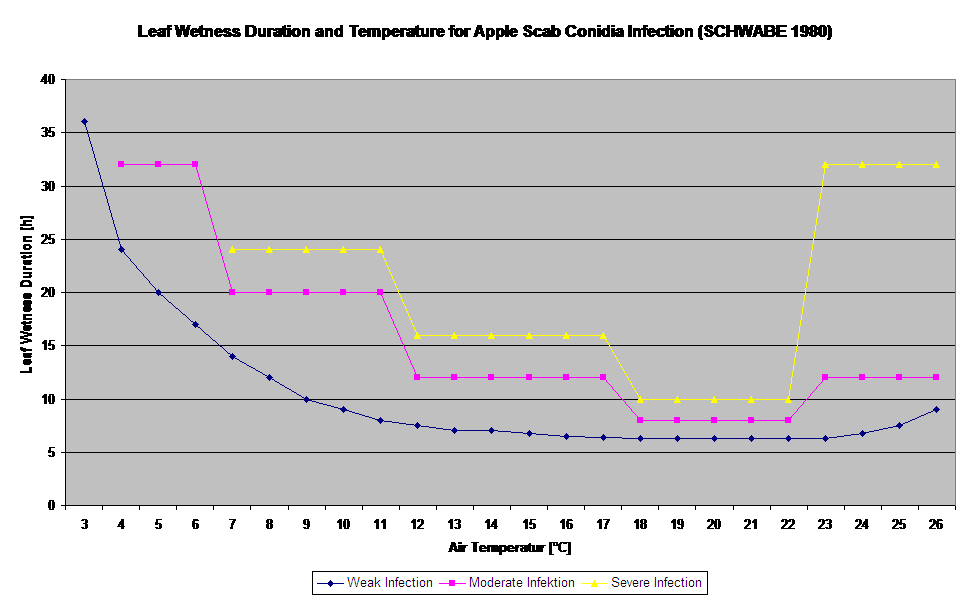

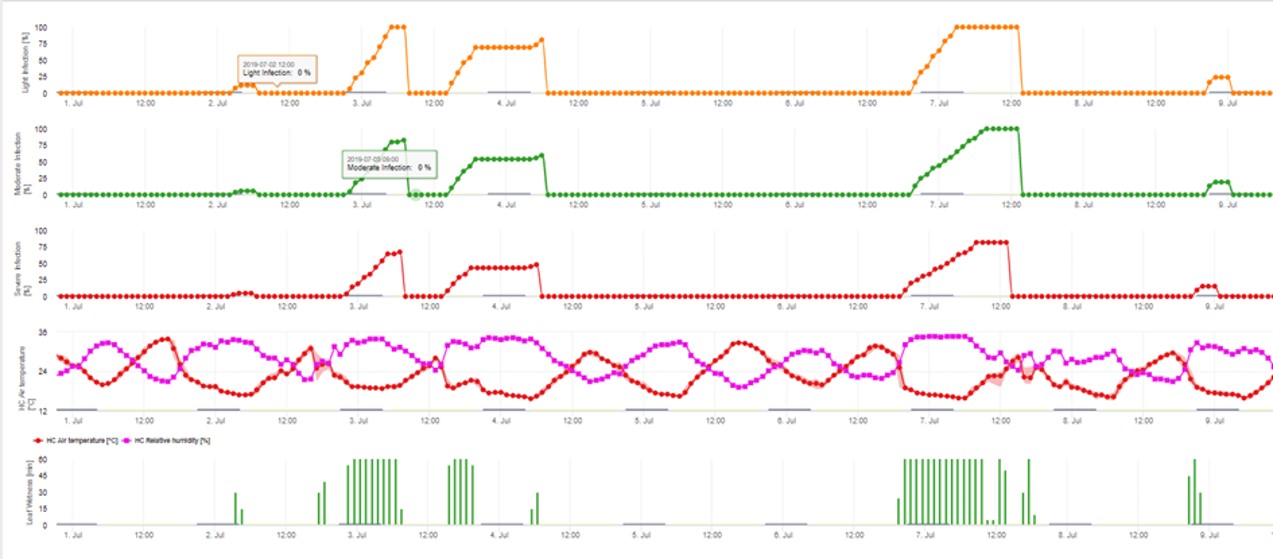
Model infekcji konidiami oblicza postęp infekcji w zależności od wilgotności liści i temperatury dla infekcji słabych, umiarkowanych i ciężkich. Podział prognozy na "trzy klasy ciężkości" jest bardzo tradycyjny dla modeli parcha jabłoni. Postęp infekcji jest wyświetlany w formie graficznej dla wartości godzinowych. Infekcja ma miejsce, gdy tylko krzywa postępu dla słabej infekcji osiągnie 100%. Umiarkowana lub ciężka infekcja jest zakończona, jeśli krzywe postępu dla tych klas ciężkości osiągają 100%. Często w praktyce lub w rzeczywistości infekcja osiąga 70% lub 80% wcześnie rano i w połączeniu z aktualną pogodą będziesz mógł wiedzieć, czy ta infekcja się zakończy czy nie. Wyświetlanie dziennych maksymalnych wartości krzywej postępu infekcji daje przegląd przewidywanych dat infekcji w sezonie.
Literatura:
- Zakażenie Venturia inaequalis, wskazując daty zakażenia askosporami i konidiami (SCHWABE, W. 1980)
- Mac Hardy W.E., 1996. Parch jabłoni biologia, epidemiologia i zarządzanie. St. Paul, MN: Am. Phytopathol. Soc.: 545.
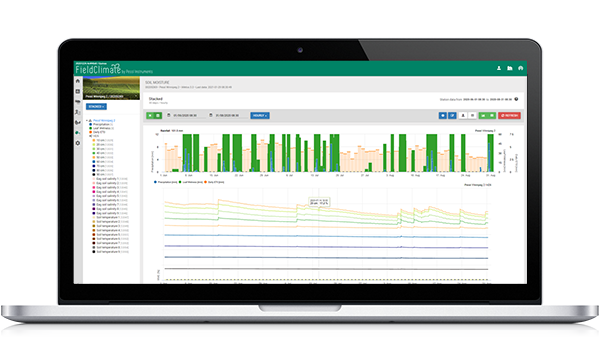
Graficzna prezentacja modelu
Do graficznej prezentacji modelu dojrzewania, tworzenia i uwalniania askospor wykorzystano wartości dzienne. Pokazuje on, że okresy zwilżenia liści prowadzą do uwolnienia askospor oraz krzywych dla dojrzałych i uwolnionych askospor. Nasilenie uwolnienia i liczby dojrzałych askospor nie mogą być oceniane w wartościach bezwzględnych. Wartości pomiędzy 0 a 100% wskazują na względną ilość dojrzałych i uwolnionych askospor w zależności od warunków klimatycznych.
1. Dojrzewanie, powstawanie i wypływanie askospor:
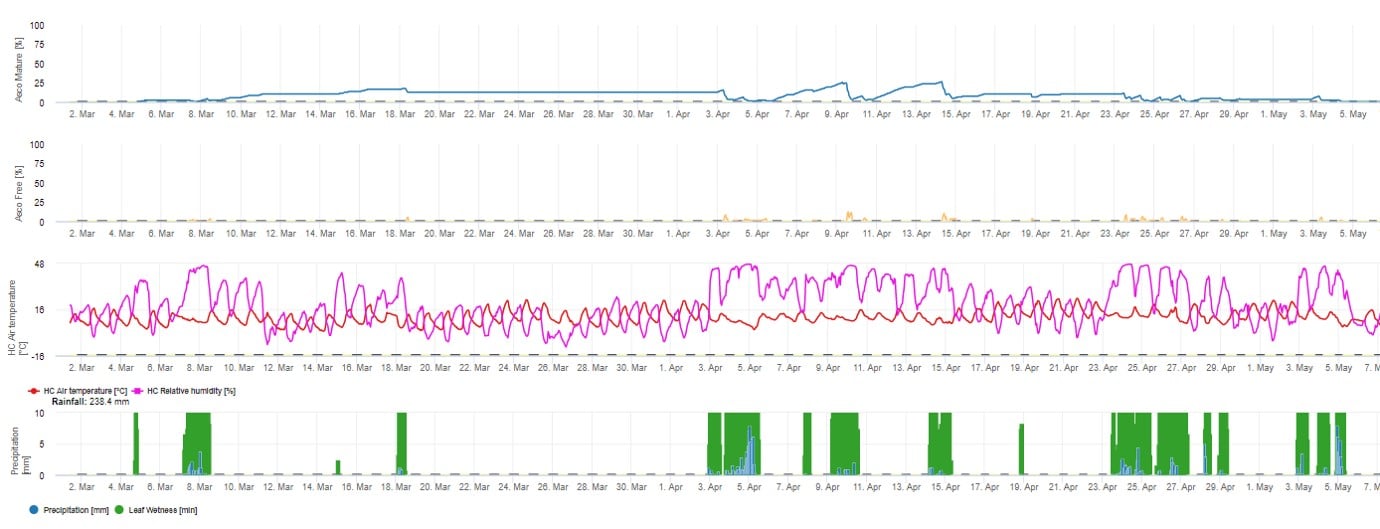

2. Infekcja askosporowa pokazana w trzech różnych klasach nasilenia (słaba: pomarańczowa, umiarkowana: zielona, silna: czerwona). Zawsze po osiągnięciu infekcji 100% określano optymalne warunki dla askospor do infekowania tkanek roślinnych. Należy więc uwzględnić pomiary ochrony roślin (przed infekcją profilaktyczne, po infekcji 100% lecznicze):

3. Infekcja konidiami pokazana w trzech różnych klasach nasilenia (słaba: pomarańczowa, umiarkowana: zielona, silna: czerwona). Zawsze po osiągnięciu infekcji 100% określano optymalne warunki dla askospor do infekowania tkanek roślinnych. Należy więc uwzględnić pomiary ochrony roślin (przed infekcją profilaktyczne, po infekcji 100% lecznicze):

Jabłka uprawiane w celach handlowych muszą być wolne od parcha. Jabłka z parchem będą sprzedawane tylko do przetwórstwa. Dlatego celem wszystkich działań ochrony roślin zarówno w uprawie konwencjonalnej, jak i ekologicznej jest uzyskanie owoców wolnych od parcha. Bardzo ważnym narzędziem do osiągnięcia tego celu są modele, które pokazują wydzielanie się askospor i infekcję askosporą/konidiami parcha jabłoni.
W konwencjonalnych systemach uprawy stosuje się dwa podstawowe rodzaje fungicydów przeciwko parchowi jabłoni: a) produkty zapobiegawcze, takie jak kaptan, mankozeb, ditianon i strobiluryny lub b) produkty lecznicze, takie jak cyprodynil (Chorus) lub pirymetanil (Scala) lub do stosowania w późniejszych, cieplejszych okresach sezonu - fungicydy DMI. W rzeczywistości większość producentów stosuje strategię zapobiegawczą. Jednak praktyczna strategia zapobiegawcza nie jest w stanie całkowicie ochronić jabłoni, ponieważ jabłoń rośnie i rozwija kwiaty, owoce i liście. Dlatego oprysk zapobiegawczy chroni tylko przez okres od 4 do 7 dni, w zależności od aktualnego wzrostu drzewa. Tak wąskie odstępy pomiędzy opryskami są niemożliwe do wykonania, dlatego sadownicy będą uwzględniać w swoich działaniach opryskowych doświadczenia związane z lokalnym klimatem, prognozą pogody i modelami parcha jabłoni. Będą oni planować opryski zapobiegawcze na podstawie swoich doświadczeń i prognozy pogody. Modele infekcji parcha jabłoni pokażą im dokładną datę infekcji (słaba, umiarkowana i ciężka), jak również model wydzielania askospor/konidiów, a dzięki swojemu doświadczeniu będą w stanie ocenić znaczenie infekcji. Daje to możliwość działania za pomocą produktu leczniczego, jeśli infekcja parcha jabłoni nastąpiła zbyt długo po ostatnim oprysku zapobiegawczym.
W ekologicznej produkcji jabłek siarka wapienna okazała się najskuteczniejszym środkiem zwalczającym parcha. Optymalną kontrolę można uzyskać, jeśli oprysk zostanie wykonany na krótko przed infekcją lub na początku infekcji. Należy to zaplanować na podstawie prognozy pogody. Czasami zdarza się, że przegapimy ten optymalny okres i będziemy musieli wykonać oprysk na mokre liście przy prawie całkowitej infekcji parcha. To nadal daje dobrą skuteczność. Modele parcha jabłoni pomagają w podjęciu decyzji, czy konieczne jest wykonanie oprysku na początku infekcji.
Zaraza ogniowa
Zaraza ogniowa jest niszczącą chorobą bakteryjną jabłek i gruszek, która niszczy kwiaty, pędy, kończyny, a czasem całe drzewo. Choroba ta występuje na całym świecie we wszystkich umiarkowanych i ciepłych rejonach uprawy jabłek. Ogniska choroby występują zazwyczaj bardzo sporadycznie, powodując w niektórych sadach w niektórych latach poważne straty, podczas gdy w innych nie występują żadne uszkodzenia.
Występowanie to przypisuje się:
a) różnice w dostępności inokulum zimującego
b) szczególne warunki zakażenia
c) zmiany w specyficznych lokalnych warunkach pogodowych i
d) stadium rozwoju odmian.
Potencjał destrukcyjny i sporadyczność występowania zarazy ogniowej, a także fakt, że epidemie często rozwijają się w kilku różnych fazach, sprawiają, że choroba ta jest trudna i kosztowna w zwalczaniu (P.W. Steiner, T. van der Zwet, and A. R. Biggs).
Objawy zarazy ogniowej
Na pniach i dużych konarach często wyraźnie widoczne są zimujące kanarki, w których znajduje się patogen zarazy ogniowej, w postaci lekko lub głęboko zagłębionych obszarów przebarwionej kory, które czasami są popękane na brzegach. Najwięcej jest jednak kanarków znacznie mniejszych i nie tak łatwo je odróżnić. Występują one na małych kończynach, gdzie w poprzednim roku doszło do infekcji kwiatów lub pędów, a także często wokół cięć wykonanych w celu usunięcia porażonych kończyn. Ponieważ wiele z tych kanarków powstaje w późniejszym okresie sezonu, nie są one często silnie zagłębione i rzadko widać na ich brzegach spękania kory. Ponadto są one często dość małe, sięgające mniej niż 2,5 cm, z czerwonawą lub fioletową korą, która może być pokryta drobnymi, czarnymi owocnikami grzyba (przede wszystkim Botryosphaeria obtusa, patogen czarnej zgnilizny jabłek).
Objawy zarazy kwiatowej pojawiają się najczęściej w ciągu jednego do dwóch tygodni od zakwitnięcia i zazwyczaj obejmują całe grono kwiatowe, które więdnie i zamiera, brązowiejąc w przypadku jabłoni i całkiem czerniejąc w przypadku gruszy. Gdy pogoda sprzyja rozwojowi patogenu, na kwiatach widoczne są kuleczki bakteryjnej maści. Pęd, na którym znajduje się grono kwiatowe, również zamiera, a infekcja może rozprzestrzenić się na część gałęzi podporowej i ją zabić. Końcówki młodych zainfekowanych pędów więdną, tworząc bardzo typowy objaw "pastucha". Starsze pędy, które zostały zainfekowane po wykształceniu około 20 liści, mogą nie wykazywać tego objawu zwijania się końcówki. W miarę rozprzestrzeniania się infekcji w dół osi pędu, na liściach pojawiają się najpierw ciemne smugi w środkowych żyłkach, a następnie więdną i brązowieją, pozostając przez cały sezon ściśle przylegającymi do pędu. Podobnie jak w przypadku infekcji kwiatów, patogen często poraża i zabija część kończyny podtrzymującej porażony pęd. Pierwszym objawem na pędach wodnych i pędach, które zostały zaatakowane systemowo przez pobliskie aktywne kanarki, jest pojawienie się żółtego do pomarańczowego przebarwienia na końcówce pędu przed zwiędnięciem. Ponadto ogonki liściowe i środkowe żyłki liści podstawowych na takich pędach zwykle stają się nekrotyczne przed tymi na wierzchołku pędu.
W zależności od odmiany i jej stadium rozwoju w momencie wystąpienia infekcji, zakażenie pojedynczego kwiatu lub pędu może spowodować śmierć całej kończyny, a w przypadku zaatakowania centralnej części drzewa lub pnia, znaczna część drzewa może zostać zabita w ciągu jednego sezonu. Ogólnie rzecz biorąc, wszelkiego rodzaju infekcje występujące pomiędzy opadaniem płatków a zawiązaniem pąków końcowych prowadzą zazwyczaj do największych strat w kończynach i drzewach. Ponadto drzewa silnie ustrukturyzowane mają tendencję do mniej poważnych strat w kończynach niż drzewa przyuczone do słabszych systemów w celu uzyskania wysokiej wydajności. W przypadku zakażenia wysoce podatnych podkładek jabłoni (M.26, M.9), znaczna część pnia zraza i głównych gałęzi powyżej zawiązka szczepu zwykle nie wykazuje objawów, podczas gdy wokół podkładki rozwija się wyraźny ciemnobrązowy rak. Gdy rak podkładki opasuje drzewo, górna część wykazuje objawy ogólnego spadku (słaby kolor liści, słaby wzrost) w połowie lub pod koniec sezonu. W niektórych przypadkach liście drzew dotkniętych zarazą podkładki nabierają wczesnojesiennego czerwonego koloru pod koniec sierpnia lub na początku września, co nie jest podobne do tego, co często wiąże się z chorobą zgnilizny kołnierzykowej powodowanej przez grzyby glebowe. Niektóre drzewa z infekcją podkładki mogą nie wykazywać objawów spadku aż do następnej wiosny, kiedy to można zaobserwować kłykcie rozszerzające się ku górze w dolnej części pnia.
Cykl chorobowy
Patogen bakteryjny powodujący zarazę ogniową zimuje prawie wyłącznie w kankach na kończynach zainfekowanych w poprzednim sezonie. Największa liczba sęków, a tym samym największe znaczenie w dostarczaniu inokulum, występuje na kończynach o średnicy mniejszej niż 38 mm, zwłaszcza w okolicach cięć wykonanych w poprzednim roku w celu usunięcia porażonych kończyn. Wczesną wiosną, w odpowiedzi na cieplejsze temperatury i szybki rozwój pąków, bakterie na brzegach raków zaczynają się szybko namnażać i wytwarzają gęstą żółtawą do białej maź, która jest wypracowywana na powierzchni kory do kilku tygodni przed okresem kwitnienia. Muł ten przyciąga wiele gatunków owadów (głównie muchy), które następnie roznoszą bakterie po całym sadzie. Gdy kilka pierwszych otwartych kwiatów zostanie skolonizowanych przez bakterie, owady zapylające szybko przenoszą patogen na inne kwiaty, zapoczątkowując w ten sposób większą liczbę przypadków zarazy kwiatowej. Skolonizowane kwiaty ulegają infekcji w ciągu kilku minut po każdym zwilżeniu spowodowanym deszczem lub silną rosą, gdy średnie dzienne temperatury są równe lub większe niż 16 °C, a płatki kwiatów są nienaruszone (dna kwiatowe i młode owoce są odporne po opadnięciu płatków). Po zakażeniu kwiatów można spodziewać się wczesnych objawów po zgromadzeniu co najmniej 57 stopniodni (DD) powyżej 13 °C, co w zależności od temperatur dziennych może wymagać od 5 do 30 dni kalendarzowych.
Wraz z pojawieniem się objawów zarazy pędów znacznie zwiększa się liczba i rozmieszczenie źródeł inokulum w sadzie. Inokulum z tych źródeł jest dalej rozprzestrzeniane przez wiatr, deszcz i wiele przypadkowych owadów odwiedzających młode wierzchołki pędów, co zwiększa prawdopodobieństwo wybuchu zarazy pędów. Ostatnie badania przeprowadzone w Pensylwanii wskazują, że żerowanie mszyc nie przyczynia się do powstawania zarazy pędów. Potrzeba więcej badań, aby określić, czy koniki polne odgrywają rolę w występowaniu zarazy pędów. Większość infekcji wierzchołków pędów występuje pomiędzy okresem, w którym pędy mają około dziewięciu do dziesięciu liści, a zawiązaniem pąków końcowych, kiedy dostępne są źródła inokulum i wektory owadów, a temperatury dzienne wynoszą średnio 16 °C lub więcej.
W latach, w których nie dochodzi do zakażenia kwiatów, głównym źródłem inokulum dla fazy zarazy pędów są zimujące kanarki, a w szczególności młode pędy wodne w pobliżu tych kanalików, które ulegają zakażeniu, ponieważ bakterie przemieszczają się do nich systemowo z brzegów kanalików. Takie systemowe infekcje pędów, zwane zarazą kłączy, są najwyraźniej inicjowane około 111 DD więcej niż 13 °C po zielonym wierzchołku, chociaż widoczne objawy mogą być widoczne dopiero po nagromadzeniu co najmniej 157 DD więcej niż 13 °C po zielonym wierzchołku. W przypadku braku infekcji kwiatów, rozwój infekcji zarazy pędów jest często zlokalizowany wokół miejsc, w których zimują kanty.
Zaraza kwiatów modelu
Model wymaga od użytkownika rozpoznania specyficznych i ciągle zmieniających się lokalnych wydarzeń i aspektów jego sadu, które mogą zwiększyć lub zmniejszyć ryzyko wystąpienia zarazy ogniowej w stosunku do innych sadów w regionie. Model wymaga od użytkownika przyjęcia założenia, że ryzyko infekcji zarazą ogniową istnieje zawsze, gdy na drzewach obecne są kwiaty, szczególnie w okresie opadania płatków i w okresie "po kwitnieniu", gdy na wielu odmianach jabłoni i grusz mogą pozostać rozproszone kwiaty. Użytkownik modelu jest proszony o dokładną ocenę sytuacji na swoim stanowisku i rozpoczęcie działań kontrolnych, jeśli występują kwiaty, poziom ryzyka jest "wysoki" lub "ekstremalny", a zwilżenie kwiatów prawdopodobnie wystąpi w ciągu najbliższych 24 godzin.
Struktura modelu: Temperatury i wilgotność: Kluczowym procesem zarazy ogniowej, który musi być modelowany, jest możliwość rozwoju bakterii na słupkach kwiatów jabłoni i gruszy. Wzrost ten jest zależny od temperatury, więc niezawodne przewidywanie ryzyka infekcji wymaga zastosowania metody pomiarowej, która najdokładniej odzwierciedla wzrost bakterii na słupkach kwiatów jabłoni i gruszy. Erwinia amylovora kolonie. Główny spór wśród modelarzy dotyczy tego, jak należy to robić.
Model zarazy Cougar szacuje szybkość wzrostu bakterii z godzinami stopni na podstawie określonej krzywej wzrostu. Ta krzywa wzrostu jest oparta na tempie wzrostu E. amylovora bakterii w testach laboratoryjnych. Wartości godzinowe stopni są gromadzone w każdej godzinie dnia, w której temperatury są wyższe niż 15°C. Wartości godzinowe rosną wraz ze wzrostem temperatury od 15°C do 29°C, maleją przy wyższych temperaturach i osiągają zero dla każdej godziny z temperaturą powyżej 40°C.
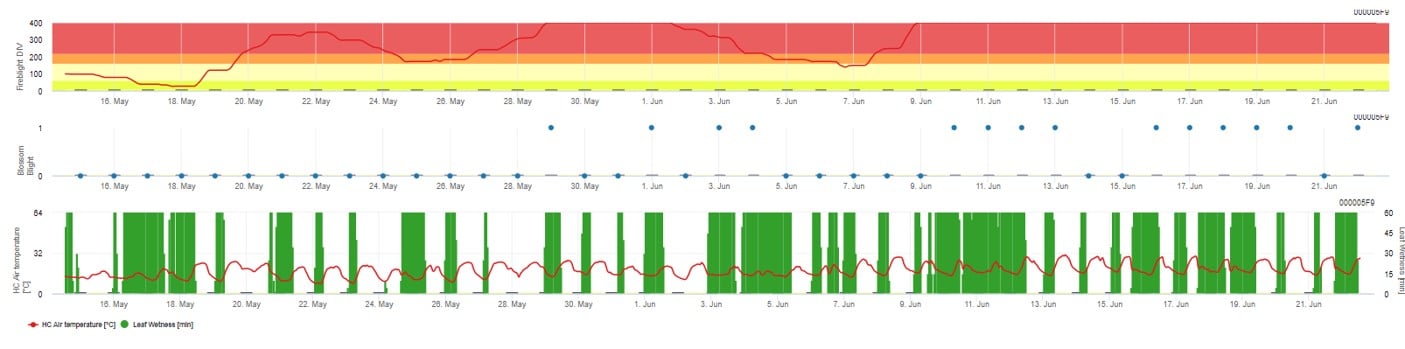
W FieldClimate.com oba modele są wyświetlane na tym samym rysunku. Model Fireblight DIV jest oparty na Courgarblight, a model Blossomblight na Maryblight.
Modelowa zaraza pumy
Występowanie zarazy kwiatowej jest jednym z najbardziej sporadycznych aspektów epidemii zarazy ogniowej. Model został zbudowany przy założeniu, że istnieje obfitość inokulum i że aby doszło do zdarzenia infekcji kwiatów, muszą być spełnione kolejno cztery ścisłe warunki. Warunkami tymi są:
1) kwiat musi być otwarty z nienaruszonymi słupkami i płatkami, słupki muszą być odsłonięte dla kolonizacji, kwiaty w opadnięciu płatków są odporne;
2) nagromadzenie co najmniej 110 °C godzin > 18,3°C w ciągu ostatnich 44°C dni > 4,4°C określa potencjał infekcji epifitycznej dla najstarszego otwartego, a więc najbardziej skolonizowanego kwiatu w sadzie
3) zdarzenie zwilżające występujące jako rosa lub 0,2 mm deszczu lub 2,5 mm deszczu poprzedniego dnia umożliwia przemieszczanie się bakterii ze skolonizowanych słupków do nektarthodes
4) średnia temperatura dobowa >= 15,6°C: Może to wpływać na szybkość migracji bakterii do nektarthodes, jak również na namnażanie się bakterii potrzebnych do ustanowienia infekcji.
Graficzna prezentacja modeli
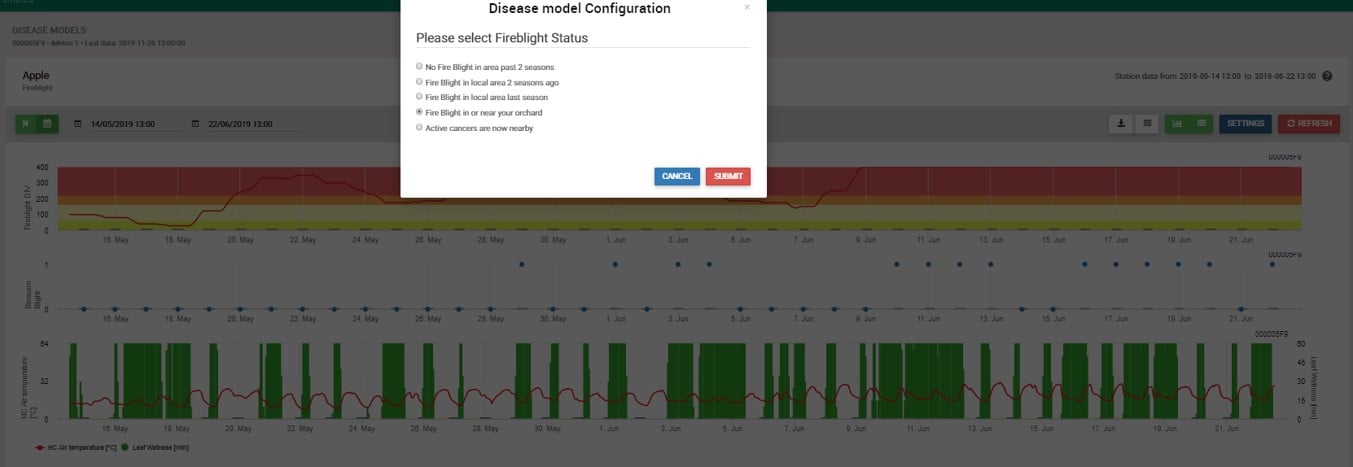
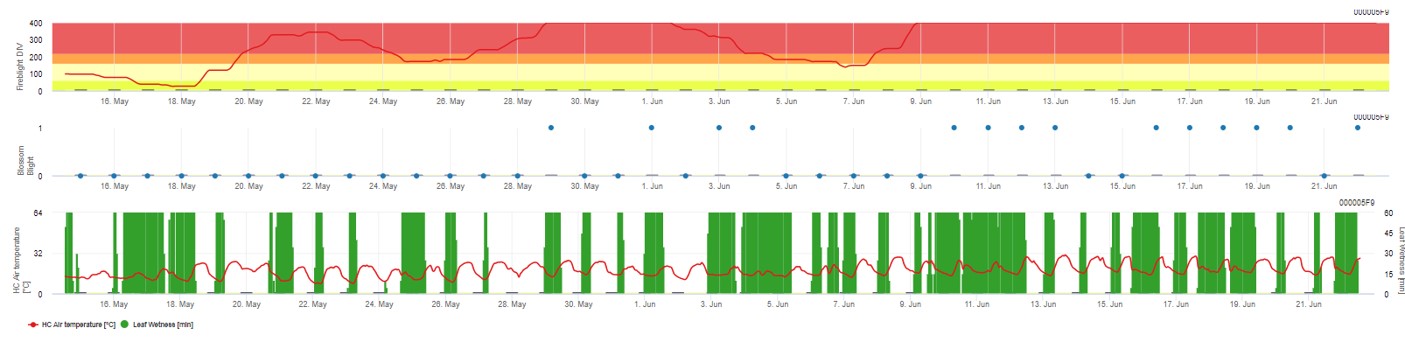
Oba modele są wyświetlane na tej samej stronie. Graficzna prezentacja modeli zarazy ogniowej jest najlepsza do użycia z wartościami zagregowanymi na bazie dziennej. Wykres pokazuje wartości klimatyczne związane z tą chorobą. Wynik Cougar Blight nazwany Fire Blight DIV oraz wyniki Blossom Blight. Aby zinterpretować wyniki zarazy Cougar, wykres jest pokryty 5 różnymi kolorami. Rozkład tych kolorów jest dokonywany na podstawie ustawień historii pierwszej zarazy w danym sadzie (patrz przycisk po prawej stronie u góry). 5 kolorów wskazuje klasę ryzyka dla wartości DIV.
Interpretacja wartości (w zależności od występowania zarazy ogniowej w ostatnich latach, zestaw podstawowy):
Aktywne kanki obecne w pobliżu
Ustawienia historii zarazy ogniowej ustawiamy niebieskim dolnym "Ustawienia" w prawej górnej części:

Wyświetlanie wyników modelu zarazy ogniowej przez 1) Modell Cougar Blight (nazwany Fireblight DIV na podstawie historii i kolorów tła) i 2) Modell Blossom Blight

| Potencjał obecności patogenów | Niski | Umiarkowany | High | Extreme |
| Potencjał obecności patogenów | Niski | Umiarkowany | High | Extreme |
| Brak zarazy ogniowej w ciągu ostatnich dwóch lat | 0-350 | 350-500 | 500-800 | 800+ |
| Zaraza ogniowa na lokalnym obszarze dwa sezony | 0-300 | 300-500 | 500-750 | 750+ |
| Zaraza ogniowa na lokalnym obszarze dwa sezony | 0-250 | 250-450 | 450-700 | 700+ |
| Zaraza ogniowa w sadzie w ubiegłym roku | 0-200 | 200-350 | 350-500 | 500+ |
Próg działania:
Zwalczanie zaleca się w przypadku stwierdzenia okresu infekcji o wysokim lub skrajnym ryzyku. Czynnikami decydującymi o szkodach są: liczba kwiatów, wiek drzewa, wigor i odmiana,... zbyt.
Szansa na infekcję Blossom Blight jest wyświetlana przez pasek od 0- 1 (a więc wszystkie warunki są spełnione lub nie).
Celem modeli zarazy ogniowej jest ocena prawdopodobieństwa infekcji przez Erwinia amyloflora w sadzie.
Model Mary Blight, który jest oceniany dla zarazy kwiatów, bardzo dobrze wskazuje sytuacje infekcji o dużym wpływie ekonomicznym. Z tego powodu jest on dość często wykorzystywany do wskazywania zastosowania antybiotyków przeciwko temu patogenowi. Cougar blight daje informacje o ryzyku infekcji fire blight w związku z ogólnymi możliwościami rozprzestrzeniania się patogenu. Jej waga, wynikająca z historii sadu, jest bardzo pomocna przy wskazywaniu nam, jak uważnie musimy sprawdzać sady pod kątem objawów zarazy ogniowej, nawet w sytuacjach, w których zaraza Mary nie będzie wskazywała na infekcję.
Ćma dorszowa
Ćma dorszowa, Cydia pomonella (Linn.), jest najgroźniejszym szkodnikiem jabłoni i gruszy w skali światowej. Jeśli drzewa nie są chronione przed tym owadem, badania wykazały, że uszkodzeniu może ulec ponad 95% owoców. Oprócz jabłoni i gruszy, dorszówka może atakować pigwę, głóg, krabówkę, wiśnię i orzech angielski. Dorosłe ćmy składają jaja na rozwijających się owocach lub w ich pobliżu. Z tych jaj wylęgają się małe, białe gąsienice, które przedostają się do owoców i żerują w nich podczas ich rozwoju. Gąsienice można znaleźć wewnątrz owoców w czasie zbiorów, ale zazwyczaj zjadły drogę na zewnątrz, aby przezimować na korze drzewa. Następnie przepoczwarczają się i wiosną następnego roku wylęgają się z nich dorosłe ćmy, gotowe do kopulacji.
Symptomy
Ćmy dorszowe w stadium gąsienic powodują rozległe tunele w owocach, psując je. Uszkodzone owoce mogą przedwcześnie dojrzewać i opadać.
Biologia ćmy dorszowej
Na stronie C. pomonella zimę spędza w postaci dojrzałej larwy, która rozwija się w kokonie znajdującym się w chronionych miejscach na drzewie (szczeliny lub pęknięcia kory), co jest preferowanym miejscem, lub u podstawy drzewa w ściółce. W nowoczesnych sadach jabłoniowych o dużym zagęszczeniu, ze względu na gładką korę, miejsc do tworzenia kokonów na drzewach jest bardzo mało. Poczwarki tworzą się w kokonie uplecionym przez dojrzałą larwę.
Stadium dorosłe wyłania się z obudowy poczwarkowej i po krótkim okresie hartowania egzoszkieletu wlatuje na drzewo. Większość literatury wskazuje, że aktywność ćmy występuje w górnej trzeciej części korony drzewa. Dorosłe osobniki są aktywne o zmierzchu przez kilka godzin, a średni próg aktywności wynosi od 13°C do 15°C. Do godów dochodzi zazwyczaj na żywicielu, a bezpośrednio po nich składane są jaja. W ciepłe wieczory samica ćmy może pojawić się, odbyć gody i złożyć jaja w ciągu dwóch dni. A C. pomonella W idealnych warunkach ćma może żyć ponad 20 dni, jednak na polach uprawnych prawdopodobnie przeżywa znacznie krócej, zwłaszcza w gorące lato. W warunkach laboratoryjnych samica ćmy składa do 100 jaj, ale rzeczywista płodność na polu jest prawdopodobnie mniejsza, a większość jest składana w pierwszych dniach po pojawieniu się i zapłodnieniu.
Jaja składane są pojedynczo na górnej powierzchni liścia, na gałązkach lub na owocach. W pierwszym pokoleniu jaja składane są tylko na liściach do około dwóch tygodni po zawiązaniu owoców, kiedy to rozmycie owoców odpada. W drugim pokoleniu około 65% jaj jest składanych na liściach, ale są one zwykle bardzo blisko owocu. Jaja są kremowobiałe, gdy są składane po raz pierwszy, w połowie rozwoju mają czerwoną obwódkę, a gdy są bliskie wylęgu, widać czarną kapsułkę z główką.
Świeżo wykluta larwa wędruje, aż zlokalizuje owoc. Przeżuwa skórkę i przez kilka dni żywi się miąższem jabłka pod skórką. W procesie przegryzania skórki i żerowania pod nią larwa wypycha resztki pokarmowe z miejsca wejścia. Wokół wlotu często pojawia się czerwony pierścień, zwłaszcza w młodych owocach. Po tym, jak larwa przechodzi do następnego etapu, wwierca się w kierunku rdzenia, gdzie żywi się nasionami aż do osiągnięcia dojrzałości. Gdy larwa jest już prawie dojrzała, drąży tunel od rdzenia do zewnętrznej strony jabłka i zasklepia otwór odchodami i jedwabiem. Gdy larwa jest gotowa do wytworzenia kokonu, opuszcza owoc, wędrując po drzewie lub opadając na ziemię na jedwabnej nici, i znajduje chronione miejsce.
Wzór dla ćmy dorszowej
Nasz model opiera się na kumulacji temperatur efektywnych w przedziale od >= 10°C do <=32°C. Na półkuli północnej ta kumulacja zaczyna się od pierwszego stycznia. Na półkuli południowej zaczyna się ona od pierwszego lipca. Każdy pomiar kumulujemy w jego odpowiedniku dla danego dnia (patrz wykres poniżej). Dla rozwoju owadów stosowane są następujące progi:
*Kompletna Generacja= 650
| *Od złożenia jaj do wyklucia się jajka | = 88 |
| *Pierwsze stadium larwy | = 60 |
| *Drugie stadium larwy | = 65 |
| *Trzecie stadium larwy | = 55 |
| *Faza larwy | = 45 |
| *Piąte stadium larwy plus poczwarka | = 335 |
Wykres wytworzony przez model przedstawia pierwsze pojawienie się i czas trwania larwy w instrumencie 1 do 5 oraz obecność osobników dorosłych w 5 poziomach.
| *Level 1: | Aktywność lotnicza, niebędąca składaniem jaj |
| *Level 2: | Aktywność lotna z możliwością składania jaj. |
| *Level 3: | Aktywność lotna z pewnym składaniem jaj. |
| *Level 4: | Aktywność lotowa z rozsądnym do silnego składaniem jaj. |
| *Level 5: | Aktywność lotna z silnym składaniem jaj. |
Prezentacja stadiów rozwojowych dorosłej ćmy dorszowej w 5 różnych poziomach (pierwszy wykres), a także skumulowanych stopniodni (czerwona linia, drugi wykres) dla rozwoju dorosłego osobnika oraz stadiów larwalnych przedstawionych na niebiesko (trzeci wykres).

Mszyce na jabłkach
W sadach jabłoniowych występuje kilka gatunków mszyc. Mszyca jabłoniowa zielona, mszyca jabłoniowo owsiana lub mszyca jabłoniowo-trawiasta oraz mszyca jabłoniowa różowa. W prywatnych ogrodach głównie pewne znaczenie ma mszyca różowa jabłoniowa. Mszyca ta prowadzi do ciężkich zmian hormonalnych w końcówkach pędów przy porażeniu. Liście stają się poskręcane, a pęd ulega skróceniu. Później liście żółkną i zamierają. Mszyca ta poraża głównie młode pędy. Mszyca różowa jabłoniowa już w niewielkiej liczebności może wyrządzić poważne szkody. Natomiast mszyca jabłoniowa zielona i mszyca jabłoniowa trawnikowa mogą występować w większej liczebności nie prowadząc do szkód gospodarczych. Mszyca jabłoniowa musi być oceniona jako mająca w ogóle nieekonomiczne znaczenie.
Mszyca różowa jabłoniowa
Jest to stary europejski gatunek wprowadzony do Stanów Zjednoczonych około 1870 roku. Stał się on głównym szkodnikiem jabłek pod koniec XIX wieku. Aby się rozwijać, gatunek ten musi mieć pod dostatkiem swojej letniej rośliny żywicielskiej - babki wąskolistnej. Istnieje niezwykła zbieżność pomiędzy wprowadzeniem i rozprzestrzenianiem się różowej mszycy jabłkowej i babki wąskolistnej. Mszyca ta występuje we wszystkich rejonach uprawy owoców na całym świecie.
Etapy życia
Jajo: Jajo jest owalne i lekko spłaszczone na boku przy korze. Długość waha się od 0,49 do 0,56 mm. Przy pierwszym złożeniu jest jasnożółte i pokryte glutowatą substancją, która z wiekiem twardnieje. Kolor stopniowo zmienia się na zielonkawo-żółty, a w końcu na błyszczący, jet czarny. Czas potrzebny do zmiany koloru waha się w normalnych warunkach zewnętrznych od około dziewięciu dni do ponad dwóch tygodni.
Nimfa: Osobniki, które wylęgają się z jaj to wszystkie żyworodne bezskrzydłe samice. Wyróżnia się pięć stadiów rozwojowych. Ostatnim jest dojrzała matka macierzysta, która krótko po czwartym instrumencie zaczyna produkować żywe młode partenogenetycznie. Produkuje ona średnio pięć do sześciu młodych dziennie. Nimfy drugiego pokolenia, z których wszystkie są samicami, osiągają dojrzałość w ciągu dwóch do trzech tygodni. Zdecydowana większość nimf rozpoczyna rozmnażanie na jabłoni, choć nieliczne mogą rozwinąć skrzydła i migrować na platany.
Trzecie pokolenie jest wytwarzana w czerwcu i na początku lipca. Większość tego pokolenia rozwija skrzydła i migruje na platany wąskolistne. W niektórych sezonach bezskrzydłe samice trzeciego pokolenia wytwarzają na jabłoni czwarte pokolenie. W ostatnich latach w niektórych rejonach obserwuje się, że szkodliwe populacje mszycy różowej jabłoniowej utrzymują się w sadach do połowy lata lub później. Nie wiadomo, czy zmiana ta wynika z procesu selekcji, zmiany pokroju czy braku zapotrzebowania na alternatywnego żywiciela.
Dorosły: Dorosłe osobniki różnią się znacznie pod względem oznakowania kolorystycznego. Ogólny kolor jest różowobrązowy, z różowawym odcieniem z powodu pudrowego pokrycia. Niektóre starsze osobniki są fioletowe, a młodsze zdecydowanie czerwonoróżowe.
Zakres hostów
Preferowanym żywicielem jest jabłoń, ale mszyca żeruje również na gruszy i głogu. Cortland, Golden Delicious, Rhode Island Greening i Ida Red to szczególnie podatne odmiany jabłek. Mszyca ta występuje na wszystkich obszarach sadowniczych w Stanach Zjednoczonych i Kanadzie.
Obrażenia lub uszkodzenia: Żerowanie mszycy różówkowej często powoduje zwijanie się liści jabłoni, począwszy od opadania płatków. Liście te mogą później przebarwiać się na jaskrawoczerwono. Żerowanie mszycy na liściach wokół gron owocowych często prowadzi do pęczkowania, zahamowania wzrostu i deformacji rozwijających się owoców. Nieprawidłowości te pogłębiają się w miarę rozwoju owoców i w końcu mogą sprawić, że owoce nie nadają się do sprzedaży.
Duże populacje mszyc mogą wytwarzać duże ilości spadzi jako odpad z soku, którym się żywią. Spadź wydalana na owoce stanowi pożywkę dla grzyba pleśniowego, który wpływa na wykończenie jabłek. Toksyny zawarte w ślinie mszyc służą również jako "kropla zatrzymująca", która zapobiega oderwaniu się owoców od drzewa podczas normalnych zbiorów.
Historia życia: Mszyca ta przechodzi zimę w stadium jaja. Wylęg następuje wczesną wiosną, około tygodnia do 10 dni później niż mszyca jabłoniowa i mniej więcej w tym samym czasie co mszyca jabłoniowa. Jaja wylęgają się, gdy wiosną zaczynają otwierać się pąki, w okresie dwóch tygodni. Młode zaraz po wykluciu poszukują otwierających się pąków jabłoni; wydaje się, że preferują pąki owocowe. Żerują na zewnętrznej stronie pąków liściowych i skupisk pąków owocowych, dopóki liście nie zaczną się rozwijać. Następnie schodzą do wnętrza gron i zaczynają wysysać soki z pędów i nowo powstałych owoców.
Ich żerowanie powoduje zwijanie się liści, chroniąc mszyce przed opryskami i niektórymi wrogami. Silne zwijanie się liści spowodowane przez ten gatunek jest chyba najbardziej charakterystyczną cechą jego pracy. Pojedyncza matka łodygowa zlokalizowana na spodniej stronie liścia w pobliżu środkowej żebra powoduje ciasne zwinięcie liścia. Wystarczy kilka matek macierzystych, aby spowodować silne zwinięcie wszystkich liści otaczających otwierający się pąk kwiatowy, co stanowi idealną ochronę dla szybko rozwijających się mszyc. Matki pędowe osiągają dojrzałość, gdy jabłonie zaczynają kwitnąć.
Dojrzałe matki macierzyste są bardzo mało aktywne. Osiedlają się, żerują i w szybkim tempie produkują młode. Po rozłożeniu szybko usuwają dziób z tkanek roślinnych i szukają innego miejsca, w którym mogłyby kontynuować. Matki łodygowe dojrzewają po około dwóch tygodniach od wyklucia. Długość tego czasu zależy w dużej mierze od warunków pogodowych. Produkcja młodych rozpoczyna się zwykle dwa lub trzy dni po ostatnim molcie i trwa bez przerwy przez ponad miesiąc.
Całkowita produkcja przez jedną samicę wynosi średnio około 185 sztuk. Zazwyczaj okres rozrodu trwa od około początku maja do czerwca. Zazwyczaj maksymalny okres aktywności reprodukcyjnej przypada na około ostatni tydzień maja i pierwszy tydzień czerwca, kiedy młode owoce zaczynają się zawiązywać i rozpoczynają aktywny wzrost. Mszyca różowa jabłoniowa rzadko występuje atakując młode i szybko rosnące pędy. Ogranicza się do liści, łodyg kwiatowych i młodych owoców.
Jedną z charakterystycznych cech tego gatunku jest gromadzenie się młodych wokół matki. Każda pojedyncza matka na łodydze lub grupa matek będzie miała wokół siebie setki młodych. Porażone liście mogą być wkrótce pokryte - w niektórych przypadkach - więcej niż jedną warstwą mszyc. Ten zwyczaj gromadzenia się wkrótce zabije zaatakowane liście i spowoduje przymusową migrację mszyc. Młode poruszają się aktywnie i pospiesznie, najwyraźniej pragnąc znaleźć odpowiednie miejsce do żerowania. W tym okresie często można je spotkać zgromadzone na tworzących się owocach lub atakujące nowe, soczyste, rozwijające się liście.
Drugie pokolenie potrzebowało od 4 do 40 dni na osiągnięcie dojrzałości i wydanie młodych. Większość drugiego pokolenia to bezskrzydłe samice. Średnia całkowita produkcja każdego osobnika w drugim pokoleniu około 119. Zwyczaje i aktywność trzeciego pokolenia nie różnią się od tych z drugiego. Mszyce gromadzą się w ogromnych ilościach na spodniej stronie liści, powodując ich silne zwijanie się. Atakują również zawiązki i rozwijające się owoce, powodując charakterystyczne uszkodzenia.
Większość tego trzeciego pokolenia nabywa skrzydła i migruje do wąskolistnej rośliny żywicielskiej, letniej. Może powstać czwarte pokolenie. Wszystkie one wytwarzają skrzydła i migrują do wąskolistnych roślin żywicielskich. Po ostatnim linieniu dorosłe osobniki ze skrzydłami są bardzo delikatne i nieaktywne. Przez dwa lub trzy dni pozostają ukryte w zwiniętych liściach, zanim wyruszą w lot migracyjny. Tuż przed lotem stają się bardzo aktywne i nerwowe, biegając lub poruszając skrzydłami w górę i w dół w oczekiwaniu na lot.
Mszyca na zielonym jabłku
Mszyca jabłoniowa, Aphis pomi (DeGeer), jest szeroko rozpowszechniona we wszystkich rejonach uprawy jabłek. Na półkuli północnej po raz pierwszy pojawia się w sadach jabłoniowych pod koniec maja do początku czerwca. Owad ten wysysa soki z liści na pędach wodnych i soczystych przyrostach końcowych. Mszyca jabłoniowa występuje najczęściej w pobliżu głównych żyłek na spodniej powierzchni liścia. Mszyca jabłoniowa atakuje również gruszę, głóg, pigwę, jabłoń krabową i spiraea.
Opis mszycy jabłoniowej
Jaja mszycy jabłoniowej są owalne i błyszczące, czarne. Nimfy i osobniki dorosłe są ciemno- lub jasnozielone. Mszyca jabłoniowa ma zieloną głowę, jednolicie zielony lub żółtozielony odwłok, czarne nogi i długie czarne gzymsy - "rury ogonowe" (na tylnym końcu owada). Dorosłe samice są ciemnozielone do czarnych i uskrzydlone. W okresie letnim samice te, czyli alaty, rodzą żywe młode partenogenicznie.
Biologia mszycy jabłoniowej
Mszyca jabłoniowa zimuje w postaci jaj na odrostach, u podstawy pąków oraz na bliznach liściowych pędów końcowych. Jaja wylęgają się zwykle w momencie pękania pąków i rozwijania się pierwszych liści. Nimfy natychmiast zaczynają żerować na rozwijających się liściach. Początkowo występują na pędach terminalnych, a później przenoszą się na starsze liście groniaste. Dorosłe samice mszyc wytwarzają bezskrzydłe samice w ciągu dwóch tygodni, z których każda jest w stanie wydać 50-100 żywych potomków. Młode mszyce rozwijają się w ciągu siedmiu do dziesięciu dni. Populacje mszycy jabłoniowej tworzą się na jabłoni zazwyczaj powoli wczesną wiosną (kwitnienie, płatki kwiatowe, jesień), a szybciej wraz ze wzrostem średniej temperatury dobowej. W okresie letnim powstają mszyce uskrzydlone, czyli alatki, oraz mszyce bezskrzydłe. Mszyca na zielonych jabłkach najliczniej występuje w lipcu i na początku sierpnia. W początkowych stadiach infestacji więcej jest nimf niż dorosłych alatek. W miarę wzrostu populacji wzrasta odsetek alatów. Kolonie mszycy jabłoniowej mogą się podwoić w ciągu tygodnia, jeśli warunki są sprzyjające. Jeśli mszyce nie mają soczystych nowych przyrostów i muszą żerować na starszych liściach, wówczas liczba produkowanych młodych może spaść nawet o 50%. Jeśli temperatury dzienne wynoszą 30-32°C i więcej, samice nie rozmnażają się dobrze. Gdy wysokie temperatury utrzymują się przez kilka dni, mszyce giną. W ciągu lata rozwija się kilka pokoleń mszycy jabłoniowej, a formy uskrzydlone rozpraszają się po całym sadzie. Zdarza się, że mszyca jabłkowa zielona i mszyca różowa, Dysaphis plantaginea Pars. mają kolonie na tym samym liściu. Różowa mszyca jabłkowa jest różowa lub fioletowa. Jesienią rozwijają się i kopulują bezskrzydłe samce i samice, a samice składają jaja na zimę. Najwięcej jaj znajduje się w odległości 15-20 cm od czubków gałązek. Jaja rzadko znajdują się na dużych kończynach rusztowań lub na pniach jabłoni.
Szkody
Mszyca jabłoniowa wysysa soki z liści. Silna infestacja ogranicza wigor i wzrost pędów. Jest to szczególnie niepokojące w szkółkach i młodych, nieowocujących sadach. Owady te mogą ograniczać wielkość pąków i długość międzywęźli oraz powodować zwijanie się liści. Żerowanie mszyc może również stymulować wzrost bocznych gałęzi, co może wpływać na kształt drzewa. Zwinięte liście i osłabione końcówki są podatne na uszkodzenia zimowe. Spadź wytwarzana przez mszyce może kapać na owoce, umożliwiając rozwój grzybów powodujących powstawanie sadzy. Grzyb ten powoduje plamistość owoców i obniża ich wartość rynkową. Przy dużym nasileniu występowania mszyca jabłoniowa może żerować na niedojrzałych jabłkach i powodować ordzawienia.
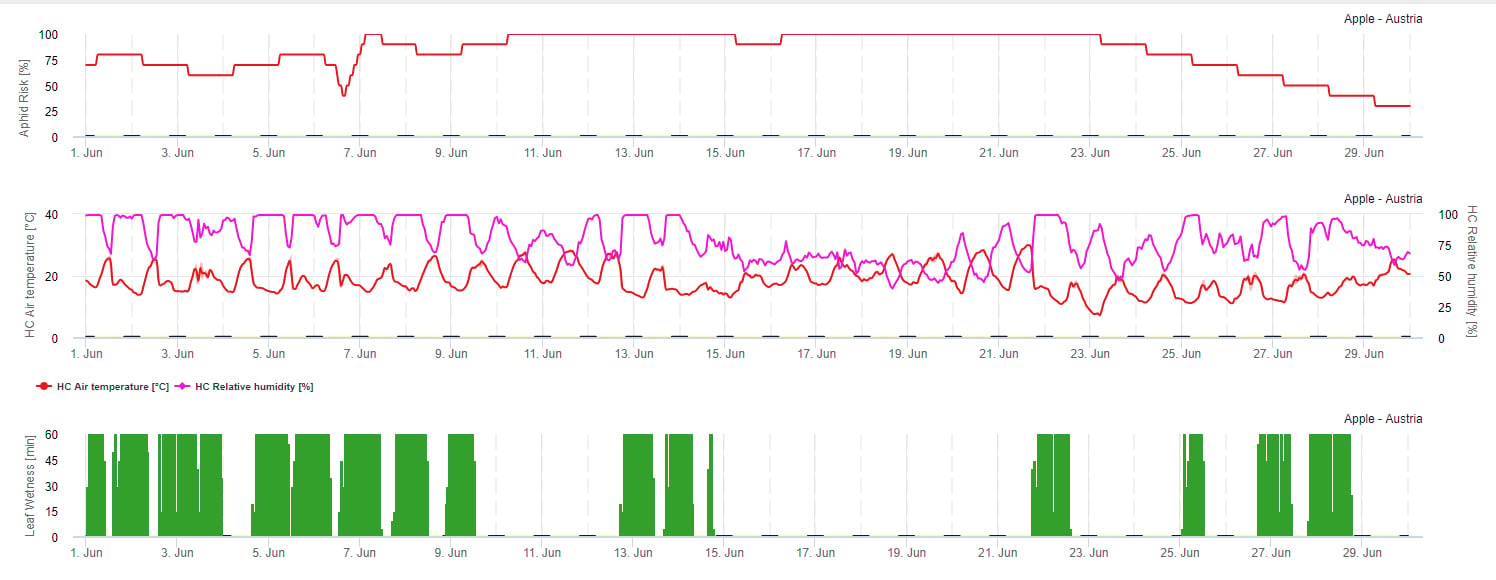
Model ryzyka rozprzestrzeniania się
Na rozmnażanie się mszyc największy wpływ ma temperatura. Im więcej godzin jest zbliżonych do optymalnej temperatury (20-32°C) i dostępne jest źródło pokarmu, tym większa będzie szybkość rozmnażania. Natomiast jaja i młode stadia rozwojowe są wrażliwe na suche powietrze. Niska wilgotność względna powietrza (poniżej 30% r.h.) również może zaszkodzić populacji mszyc. Oprócz insektycydów, mszyce są zwalczane przez drapieżniki i grzyby pasożytnicze. Grzyby pasożytnicze są zależne od wilgotności. Większość z tych gatunków, jak np. Beauvaria bassiana sprzyjają wolnej wilgoci.
Zwiększamy ryzyko, gdy optymalna temperatura wynosi od 20 do 32°C i wilgotność względna od 30 do 95% r. h., a zmniejszamy ryzyko, gdy jest zbyt wilgotno (zwilżenie liści, deszcz lub wilgotność względna powyżej 95%), zbyt zimno (temperatury niższe niż 20°C) lub zbyt gorąco (temperatury powyżej 32°C), mokre noce (zwilżenie liści w godzinach nocnych).

Zalecane wyposażenie
Sprawdź, jaki zestaw czujników jest potrzebny do monitorowania potencjalnych chorób tej uprawy.