Trigo modelos de enfermedad
Trigo (Triticum spp.) es el segundo cultivo de serie más importante. El trigo se cultiva en una gama muy amplia de climas, que van desde la producción subtropical de invierno hasta el clima fresco escocés de 11 meses de duración, con su enorme productividad. Como todas las enfermedades de las plantas, unas tienen aspectos más históricos y otras se deben principalmente al clima.
Las enfermedades de origen climático son: En enfermedades de la royaque son más importantes en las zonas de clima más cálido, son principalmente enfermedades de origen climático. Tizón de la cabeza por Fusarium y su capacidad para formar toxinas está influenciada por la historia del campo y también por la situación climática; no se producirá si el clima no es favorable para una infección durante la floración. También Septoria tritici depende de las salpicaduras de las lluvias y de la humedad duradera de las hojas para infectar el canope y más adelante el maíz.
Enfermedades con aspectos históricos: Oidio Blumeria graminisque se da en una amplia gama climática está influenciada principalmente por la historia de un campo. Pseudocercosporella herpotrichoides (Enfermedad de la mancha ocular), Gaeumannomyces graminis (Take- all, Schwarzbeinigkeit) y Rhizoctonia cerealis (lote amarillo) dependen sobre todo de la historia del lugar y no están muy influidos por el clima.
La enfermedad Pyricularia grisea se describe detalladamente en Enfermedades del arroz y aquí se denomina Magnaporthe grisea.
Óxido marrón
El agente patógeno Puccinia triticina necesita las mismas condiciones ambientales que la hoja de trigo. El hongo es capaz de infectar dentro de períodos de rocío de tres horas o menos a temperaturas de unos 20°C el tejido vegetal; sin embargo, se producen más infecciones con períodos de rocío más largos. A temperaturas más frías, se requieren periodos de rocío más largos, por ejemplo, a 10°C es necesario un periodo de rocío de 12 horas. Se producen pocas o ninguna infección cuando las temperaturas del período de rocío son superiores a 32°C (Stubbs et al., 1986) o inferiores a 2°C.
La mayoría de las epidemias graves se producen cuando las uredinias y/o las infecciones latentes sobreviven al invierno en algún nivel umbral en el cultivo de trigo, o cuando el trigo sembrado en primavera es el receptor del inóculo exógeno en una fecha temprana, normalmente antes del espigado. Pueden producirse graves epidemias y pérdidas cuando la hoja bandera se infecta antes de la antesis (Chester, 1946). Puccinia triticina es principalmente un patógeno del trigo, sus ancestros inmediatos y el cultivo artificial triticale.
Anfitriones alternativos
El hongo produce sus gametos sexuales (picniosporas e hifas receptivas) en el hospedador alternativo. La mayoría de los investigadores de la roya suponen que Thalictrum speciosissimum (de la familia Ranunculaceae) es el principal hospedador alternativo de P. recondita f. sp. tritici en Europa. El hospedador alternativo se infecta cuando las teliosporas germinan en presencia de humedad libre. Se producen basidiosporas (1n) capaces de ser transportadas a corta distancia (unos pocos metros) para infectar a los hospedadores alternativos. Aproximadamente entre siete y diez días después de la infección, aparecen picnios con picniosporas e hifas receptivas. Éstas sirven de gametos, y la fecundación se produce cuando el néctar que contiene las picniosporas es transportado a las hifas receptivas del otro tipo de apareamiento por insectos, por salpicaduras de lluvia o por cohesión. Las copas aeciales aparecen entre siete y diez días después en la superficie inferior de la hoja, produciendo aeciosporas que son transportadas por el viento y que causan la infección al penetrar en los estomas de las hojas de trigo. Las distancias recorridas por las aeciosporas parecen ser relativamente cortas.
Ciclo de vida (roya parda)
La figura de al lado muestra el ciclo de vida de P. triticina y P. triticiduri y el ciclo de la enfermedad de la roya de la hoja del trigo. El momento de cada evento y la frecuencia de algunos de ellos (ciclo sexual, temporada de cultivo del trigo y puente verde) pueden variar entre zonas y regiones del mundo.
El hospedador alternativo actualmente proporciona poco inóculo directo de P. triticina al trigo, pero puede ser un mecanismo de intercambios genéticos entre razas y quizás poblaciones. El patógeno sobrevive al periodo entre cosechas de trigo en muchas zonas en un puente verde de trigo voluntario (auto-sembrado) (ver sección "Epidemiología"). El inóculo en forma de urediniosporas puede ser transportado por el viento de una región a otra. El ciclo sexual es esencial para P. triticiduri. Las teliosporas pueden germinar poco después de su desarrollo, y la infección por basidiosporas puede producirse durante todo el ciclo de cultivo del trigo.
Las uredosporas inician la germinación 30 minutos después del contacto con agua libre a temperaturas de 15° a 25°C. El tubo germinativo crece a lo largo de la superficie de la hoja hasta que alcanza un estoma; entonces se forma un apresorio, seguido inmediatamente por el desarrollo de una clavija de penetración y una vesícula subestomática a partir de la cual se desarrollan hifas primarias. Una célula madre haustorial se desarrolla contra la célula mesófila y se produce la penetración directa. El haustorio se forma dentro de la célula huésped viva en una interacción huésped-patógeno compatible. Se desarrollan hifas secundarias que dan lugar a células madre haustoriales y haustorios adicionales. En una respuesta hospedador-patógeno incompatible, los haustorios no se desarrollan o lo hacen a un ritmo más lento. Cuando muere la célula huésped, muere el haustorio del hongo. Dependiendo de cuándo o cuántas células estén implicadas, la interacción huésped-patógeno dará lugar a una respuesta de resistencia visible (Rowell, 1981, 1982).
La germinación de las esporas hasta la esporulación puede producirse en un periodo de siete a diez días a temperaturas óptimas y constantes. Con temperaturas bajas (de 10° a 15°C) o fluctuaciones diurnas, son necesarios períodos más largos. El hongo puede sobrevivir como micelio insípido durante un mes o más cuando las temperaturas son cercanas o inferiores al punto de congelación. La esporulación máxima se alcanza unos cuatro días después de la esporulación inicial (a unos 20°C). Aunque el número puede variar mucho, se producen unas 3 000 esporas por uredinio y día. Este nivel de producción puede continuar durante tres semanas o más si la hoja de trigo permanece viva ese tiempo (Chester, 1946; Stubbs et al., 1986). Los uredinios (pústulas) son rojos, de forma ovalada y dispersos, y atraviesan la epidermis (Lámina 12). Las uredosporas son de color naranja a rojo oscuro, equinuladas, esféricas y suelen medir de 20 a 28 µm de diámetro (Lámina 13). Las teliosporas (Lámina 14) son de color marrón oscuro, bicelulares, con paredes gruesas y redondeadas o aplanadas en el ápice (Lámina 15). Puccinia triticiduri difiere de P. triticina en que necesita de 10 a 12 días para que aparezcan las urediniosporas, y la producción inicial de teliosporas suele producirse a los 14 días de la infección inicial. Las uredinias son de color marrón amarillento y producen muchas menos urediniosporas por uredinia, y en pocos días la lesión produce principalmente teliosporas. También P. triticiduri Es probable que las infecciones se produzcan en la superficie inferior de la hoja.
Las teliosporas de P. triticina se forman bajo la epidermis en condiciones desfavorables o de senescencia y permanecen con las hojas. Los tejidos de las hojas pueden dispersarse o ser trasladados por el viento, los animales o los seres humanos a distancias considerables. Las basidiosporas se forman y liberan en condiciones húmedas, lo que limita su dispersión. Las basidiosporas también son hialinas y sensibles a la luz, lo que limita aún más su desplazamiento a probablemente decenas de metros. Las aeciosporas son más parecidas a las urediniosporas en cuanto a su capacidad de ser transportadas por las corrientes de viento, pero por alguna razón no se ha observado transporte a larga distancia. Puccinia triticiduri producirá abundantes teliosporas a las pocas semanas de la infección inicial, produciendo un anillo oscuro de telia alrededor de cada foco de infección.
Fuente: Las royas del trigo: R.P. Singh, J. Huerta-Espino, A.P. Roelfs
Modelo de infección por Puccinia tritici
Puccinia tritici infecciones tienen lugar después:
- Algunas horas de humedad de la hoja en condiciones óptimas de temperatura. El hongo puede infectar en un amplio rango de temperaturas.
- El modelo supone que la infección necesita una temperatura del aire acumulada por hora de 90°C de humedad foliar en un rango de temperatura del aire de 5°C a 30°C.
Humedad de la hoja para temperaturas medias horarias acumuladas para 90°C
- (si T <= 22,5°C entonces ∑(Th) si no ∑ (22,5-(Th-22,5))
- 5°C < Temp. < 30°C
En FieldClimate el Puccinia tritici La infección se muestra con la línea amarilla (véase más arriba). Las condiciones son similares a P. graminispero con un umbral de temperatura inferior de 5°C. Si la infección se sitúa en 100%, debe tomarse una medida fitosanitaria curativa (aplicación sistémica). Si el riesgo se sitúa en 80% y la previsión meteorológica pronostica más periodos de humedad foliar, podrían realizarse aplicaciones foliares protectoras.
Óxido negro
La roya negra del trigo está causada por P. graminis f. sp. tritici. En una época, era una enfermedad temida en la mayoría de las regiones trigueras del mundo. El temor a la roya del tallo era comprensible porque un cultivo aparentemente sano tres semanas antes de la cosecha podía quedar reducido a una maraña negra de tallos rotos y grano marchito antes de la cosecha. En Europa y Norteamérica, la eliminación del hospedador alternativo redujo el número de combinaciones de virulencia y la cantidad de inóculo producido localmente (aeciosporas). Además, en algunas zonas se introdujeron cultivares de maduración temprana para permitir una segunda cosecha o para evitar la floración y el llenado del grano durante el tiempo caluroso. Los cultivares de maduración temprana evitan gran parte de los daños causados por la roya del tallo al evitar el periodo de crecimiento del hongo. El uso generalizado de cultivares resistentes en todo el mundo ha reducido la enfermedad como factor significativo en la producción. Aunque los cambios en la virulencia del patógeno han hecho que algunas resistencias sean ineficaces, en general se han desarrollado cultivares resistentes antes que el patógeno. Las espectaculares epidemias que se desarrollaron en Eureka (Sr6 en Australia) en la década de 1940 y en Lee (Sr9g, Sr11, Sr16), Langdon (Sr9e, +) y Yuma (Sr9e, +) en Estados Unidos a mediados de la década de 1950 han sido realmente excepciones en el pasado. La experiencia en otras partes del mundo ha sido similar (Luig y Watson, 1972; Roelfs, 1986; Saari y Prescott, 1985). Hoy en día, la roya del tallo está en gran medida bajo control en todo el mundo.
Epidemiología
La epidemiología de la P. graminis es similar a P. triticina. Las temperaturas mínima, óptima y máxima para la germinación de las esporas son de 2°, 15° a 24° y 30°C, respectivamente (Hogg et al., 1969) y para la esporulación, de 5°, 30° y 40°C, respectivamente, lo que supone unos 5,5°C más en cada categoría que para la P. triticina. La roya del tallo es más importante al final del periodo de crecimiento, en cultivares de trigo de siembra y maduración tardías, y en altitudes más bajas. El trigo sembrado en primavera es especialmente vulnerable en las latitudes más altas si las fuentes de inóculo se encuentran a sotavento. En el sur de las Grandes Llanuras de Norteamérica hay grandes extensiones de trigo sembrado en otoño, que proporcionan inóculo para el cultivo de trigo sembrado en primavera en el norte. En climas cálidos y húmedos, la roya del tallo puede ser especialmente grave debido al largo período de condiciones favorables para el desarrollo de la enfermedad cuando se dispone de una fuente local de inóculo.
La roya del tallo difiere de la roya de la hoja en que requiere un periodo de rocío más largo (son necesarias de seis a ocho horas). Además, muchas púas de penetración no se desarrollan a partir del apresorio a menos que se estimule con al menos 10 000 lux de luz durante un periodo de tres horas mientras la planta se seca lentamente tras el periodo de rocío. La infección máxima se obtiene con 8 a 12 horas de rocío a 18°C seguido de 10 000+ lux de luz mientras el rocío se seca lentamente y la temperatura sube a 30°C (Rowell, 1984). La luz rara vez es limitante en el campo, ya que los rocíos suelen producirse por la mañana. Sin embargo, se produce poca infección cuando los rocíos y/o lluvias vespertinos van seguidos de vientos que provocan un secado antes del amanecer. En el invernadero, la escasez de luz suele ser la causa de las bajas tasas de infección. El efecto de la luz es probablemente un efecto sobre la planta más que sobre el sistema fúngico, ya que las urediniosporas inyectadas en el interior del verticilo de la hoja dan lugar a penetraciones fúngicas exitosas sin que la luz incida sobre el hongo. Las uredinias de la roya del tallo aparecen tanto en la superficie de las hojas como en la del tallo, así como en las vainas de las hojas, las espigas, las glumas, las barbas e incluso los granos.
Una pústula de la roya del tallo (uredinium) puede producir 10 000 urediniosporas al día (Katsuya y Green, 1967; Mont, 1970). Esta cantidad es superior a la de la roya de la hoja, pero la infectabilidad es menor, ya que sólo uno de cada diez gérmenes produce una infección. Las uredinias de la roya del tallo, al estar principalmente en los tejidos del tallo y de la vaina de la hoja, suelen sobrevivir más tiempo que las de la roya de la hoja, que se limitan más a menudo a las láminas foliares. La tasa de crecimiento de ambas enfermedades es muy similar.
Las urediniosporas de la roya del tallo son bastante resistentes a las condiciones atmosféricas si su contenido de humedad es moderado (20 a 30 por ciento). El transporte a larga distancia se produce anualmente (800 km) a través de las Grandes Llanuras norteamericanas (Roelfs, 1985a), casi anualmente (2000 km) de Australia a Nueva Zelanda (Luig, 1985) y al menos tres veces en los últimos 75 años (8 000 km) de África Oriental a Australia (Watson y de Sousa, 1983).
Las eciosporas también pueden ser una fuente de inóculo de la roya del trigo. Históricamente, esto era importante en Norteamérica y en el norte y este de Europa. Por lo general, esta fuente de inóculo se ha eliminado o reducido considerablemente mediante la eliminación del agracejo común o europeo (Berberis vulgaris) por la proximidad de campos de trigo. Las aeciosporas infectan el trigo de forma similar a las urediniosporas.
Anfitriones
El trigo, la cebada, el triticale y algunas especies afines son los principales hospedadores de la enfermedad. P. graminis f. sp. tritici. Sin embargo, el patógeno estrechamente relacionado, P. graminis f. sp. secalises virulento en la mayoría de las cebadas y algunos trigos (por ejemplo, la línea E). Puccinia graminis f. sp. secalis puede atacar a Sr6 y Sr11 en un fondo de hospedador de la línea E (Luig, 1985). El principal hospedador alternativo en la naturaleza ha sido B. vulgaris L., una especie nativa de Europa, aunque otras especies han sido susceptibles en pruebas realizadas en invernaderos. Los hospedadores alternativos suelen ser susceptibles a todas o a ninguna de las formas específicas de P. graminis.
Anfitriones alternativos
El principal anfitrión alternativo para P. graminis es B. vulgarisque el hombre extendió por las latitudes septentrionales del hemisferio norte. Debido a su crecimiento erguido y tupido, con muchas espinas afiladas, constituía un excelente seto en las lindes de los campos. La madera era útil para fabricar mangos de herramientas, la corteza proporcionaba un tinte y el fruto se utilizaba para hacer mermeladas. Los colonos que llegaron a Norteamérica procedentes de Europa trajeron consigo el agracejo. El agracejo se extendió hacia el oeste con los humanos y se estableció como planta naturalizada desde Pensilvania a través de las Dakotas orientales y hacia el sur hasta el noreste de Kansas. Muchas especies de Berberis, Mahonia y Mahoberberis son sensibles al P. graminis (Roelfs, 1985b). El agracejo canadiense o de Allegheny, B. canadensisdebe añadirse a esta lista.
El hospedador alternativo era una fuente importante de nuevas combinaciones de genes de virulencia y agresividad en el patógeno (Groth y Roelfs, 1982). La cantidad de variación en el patógeno dificultó, si no imposibilitó, la obtención de resistencia. De las combinaciones de virulencia presentes un año, muchas no volverían a aparecer al año siguiente, pero sí muchas nuevas (Roelfs, 1982). El agracejo era la fuente de inóculo (aeciosporas) al principio de la temporada. Generalmente, los arbustos infectados estaban cerca de los campos de cereales de la temporada anterior, por lo que el inóculo viajaba distancias cortas sin la pérdida en número y viabilidad asociada al transporte a larga distancia. Un solo arbusto grande de agracejo puede producir unas 64 x 109 aeciosporas en pocas semanas (Stakman, 1923). Esto equivale a la producción diaria de 20 millones de uredinias, en una superficie de 400 m2.
El agracejo era una fuente importante de inóculo de roya del tallo en Dinamarca (Hermansen, 1968) y Norteamérica (Roelfs, 1982). El éxito de la reducción de las epidemias de roya del tallo en el norte de Europa y Norteamérica tras la eliminación del agracejo cerca de los campos de trigo ha llevado probablemente a sobredimensionar el papel de este hospedante alternativo en la generación de epidemias anuales en otros lugares.
Resistencia a P. graminis en Berberis se considera el resultado de la incapacidad del patógeno para penetrar directamente en la dura cutícula (Melander y Craigie, 1927). Berberis vulgaris se vuelve resistente a la infección unos 14 días después de que se desplieguen las hojas. Sin embargo, las infecciones se producen en las bayas, las espinas y los tallos, lo que sugiere que el endurecimiento de la cutícula puede no ser tan importante como se pensaba en un principio. En pruebas recientes de cultivares hospedadores alternativos, se ha observado una respuesta hipersensible especialmente con Berberis spp. (Mahonia).
Ciclo de vida
En la mayoría de las zonas del mundo, el ciclo vital del P. graminis f. sp. tritici consiste en continuas generaciones de urediniosporas. El hongo se propaga por urediniosporas aerotransportadas de una planta de trigo a otra y de un campo a otro. El inóculo primario puede originarse localmente (endémico) a partir de plantas voluntarias o ser transportado a grandes distancias (exodémico) por el viento y depositado por la lluvia. En Norteamérica, P. graminis se desplaza anualmente 2 000 km desde los trigos de invierno más meridionales hasta los trigos de primavera más septentrionales en 90 días o menos y en el ciclo uredinial puede sobrevivir el invierno a nivel del mar hasta al menos 35°N. La nieve puede proporcionar una cobertura que ocasionalmente permite P. graminis sobrevivir como infecciones en el trigo de invierno incluso a temperaturas bajo cero severas experimentadas a 45°N (Roelfs y Long, 1987). El ciclo sexual rara vez se produce, excepto en el noroeste del Pacífico de Estados Unidos (Roelfs y Groth, 1980) y en zonas locales de Europa (Spehar, 1975; Zadoks y Bouwman, 1985). Aunque el ciclo sexual produce una gran diversidad genética (Roelfs y Groth, 1980), también produce un gran número de individuos menos aptos debido a los frecuentes genes recesivos de virulencia (Roelfs y Groth, 1988) y al reordenamiento de genes de agresividad. Puccinia graminis ha desarrollado con éxito una estrategia de reproducción asexual que, al parecer, permite al hongo mantener los genes necesarios en bloques modificados ocasionalmente por mutación y selección.
La germinación de las uredosporas comienza en una a tres horas a temperaturas óptimas (Tabla 13.2) en presencia de agua libre. El período de humedad o rocío debe durar de seis a ocho horas a temperaturas favorables para que las esporas germinen y produzcan un tubo germinativo y un apresorio. El desarrollo visible se detendrá en la fase de apresorio hasta que se proporcione al menos 10 000 lux (siendo 16 000 la óptima) de luz. La luz estimula la formación de una clavija de penetración que penetra en un estoma cerrado. Si el germen se seca durante el periodo de germinación, el proceso se detiene irreversiblemente. El proceso de penetración dura unas tres horas a medida que la temperatura aumenta de 18° a 30°C (Rowell, 1984). El requisito de luz para la infección hace que sea mucho más difícil trabajar con P. graminis en el invernadero que con P. recondita. Lo más probable es que la luz rara vez tenga efecto en el campo, excepto cuando los periodos de rocío se disipan antes del amanecer.
Las urediniosporas se desarrollan en pústulas (uredinios) que rompen la epidermis y dejan al descubierto masas de esporas de color marrón rojizo. Los uredinios son más grandes que los de la roya de la hoja y tienen forma ovalada o alargada, con tejido epidérmico suelto o desgarrado a lo largo de los márgenes (Lámina 16). Las urediniosporas son estructuras equinuladas de color marrón rojizo, de forma elíptica a ovoide, que miden de 24 a 32 µm x 18 a 22 µm (Lámina 17).
A medida que el hospedador madura, se producen telias (Lámina 18) directamente a partir de infecciones de urediniosporas o pueden producirse teliosporas en una pústula uredinial madura. Las teliosporas son bicelulares de color marrón oscuro y tienen forma de cuña. Tienen paredes gruesas y miden de 40 a 60 µm x 18 a 26 µm. La célula apical es redondeada o ligeramente puntiaguda (Lámina 19). Las teliosporas son dicarióticas (n + n) y permanecen con la paja hasta la primavera. En esta época se produce la cariogamia y las teliosporas se vuelven diploides (2n). Con las lluvias primaverales y las temperaturas favorables, la teliospora germina, des-deriva de la meiosis y produce un basidio de cuatro células. Cada célula produce un estigma con una sola basidiospora haploide (1n). La basidiospora hialina es transportada por el viento a corta distancia (metros) hasta el agracejo. Las basidiosporas germinan y penetran directamente. Para una infección máxima, el tejido foliar del agracejo debe tener menos de dos semanas. La infección por una basidiospora da lugar a la producción de un picnio (1n). El picnio produce hifas receptivas y picniosporas de un solo tipo de apareamiento (+ o -) que sirven como gametos femenino y masculino para el hongo. Las picniosporas de un tipo de apareamiento deben transferirse a las hifas receptivas del tipo de apareamiento opuesto para iniciar el desarrollo de las aeciosporas. La transferencia de las picniosporas la realizan con frecuencia los insectos, que se sienten atraídos por el néctar picnial rezumante producido por el picnio. El apareamiento de los tipos + y - también puede verse facilitado por las salpicaduras de lluvia, el roce de las hojas, los animales más grandes y las infecciones vecinas que se unen. Las aeciosporas son dicarióticas (n + n) y se producen en aecios generalmente en la superficie inferior de las hojas del agracejo entre siete y diez días después de la fecundación. Las aeciosporas son el producto de una recombinación genética y pueden diferir en su virulencia y agresividad. El grado de variación depende de las diferencias entre los aislados parentales. Puccinia graminis f. sp. tritici se ha cruzado con otras formae speciales, y los cruces con P. graminis f. sp. secalis fueron relativamente fértiles (Johnson, 1949). En Australia, las pruebas apuntan a la recombinación de la roya del tallo del trigo y la roya escabrosa (P. graminis f. sp. secalis) (Burdon et al., 1981; Luig y Watson, 1972).
Las aeciosporas se liberan hidroscópicamente de los aecios y son transportadas por el aire hasta el trigo a distancias que van desde varios metros hasta quizás varios kilómetros. Las aeciosporas requieren condiciones de infección similares a las de las urediniosporas. La infección por aeciosporas da lugar a la producción de uredinias dicarióticas (n + n) con urediniosporas. El ciclo asexual que se repite consiste entonces en que las urediniosporas producen uredinia en un ciclo de aproximadamente 14 días en condiciones óptimas. En condiciones de campo, donde las temperaturas varían mucho, el ciclo puede alargarse o acortarse. Por lo general, las temperaturas más bajas en el campo, al menos en las primeras fases del ciclo de cultivo, tienden a alargar el periodo latente. En el norte de la India, se registró un período latente de 31 días para la roya del tallo (Joshi y Palmer, 1973).
Fuente: Las royas del trigo: R.P. Singh, J. Huerta-Espino, A.P. Roelfs
Modelo de infección por Puccinia gramnis
Puccinia graminis infecciones tienen lugar después:
- Algunas horas de humedad de la hoja en condiciones óptimas de temperatura. El hongo puede infectar en un amplio rango de temperaturas.
- El modelo parte de la base de que la infección necesita una temperatura del aire acumulada por hora de 80°C de humedad foliar en un intervalo de temperatura del aire de 10°C a 35°C. Prefiere temperaturas un poco más altas que P. tritici y la infección tiene que ir seguida de luz solar.
Humedad de la hoja para temperaturas medias horarias acumuladas para 80°C seguidas de un geriodo ligero (150 W/m²) para temperaturas medias horarias acumuladas para 30°C
- (si T <= 24°C entonces ∑(Th) si no ∑ Th-24
- 10°C < Temp. < 35°C
En FieldClimate P. graminis se calcula en las condiciones descritas anteriormente (línea verde). Cuando se muestra la infección 100% las condiciones han sido favorables para el hongo y hay que tener en cuenta una medida fitosanitaria (curativa).
Óxido amarillo
Roya amarilla del trigo causada por P. striiformis f. sp. tritici puede ser tan dañina como la roya del tallo. Sin embargo, la roya amarilla tiene una temperatura óptima de desarrollo más baja que la limita como enfermedad importante en muchas zonas del mundo. La roya amarilla es principalmente una enfermedad importante del trigo durante el invierno o principios de la primavera o en zonas elevadas.
La roya amarilla del trigo puede ser la causa de la roya amarilla de la cebada (Stubbs, 1985). En Europa, una forma specialis de P. striiformis que se encuentra comúnmente en la cebada y raramente en los trigos más susceptibles (Zadoks, 1961). Puccinia striiformis f. sp. hordei se introdujo en Sudamérica, donde se extendió por todo el continente (Dubin y Stubbs, 1986) y posteriormente se identificó en México y Estados Unidos (Roelfs et al., 1992).
Epidemiología
Puccinia striiformis tiene los requisitos de temperatura más bajos de los tres patógenos de la roya del trigo. Las temperaturas mínima, óptima y máxima para la infección de la roya amarilla son 0°, 11° y 23°C, respectivamente (Hogg et al., 1969). Puccinia striiformis con frecuencia puede invernar activamente en trigo sembrado en otoño. La mayor parte de los trabajos sobre epidemiología se han realizado en Europa y han sido revisados recientemente por Zadoks y Bouwman (1985) y Rapilly (1979).
En Europa, P. striiformis exceso de verano en el trigo (Zadoks, 1961). La cantidad de roya sobre estival depende de la cantidad de trigo voluntario, que, a su vez, está en función de la humedad en la temporada baja. Las esporas de la roya son transportadas por el viento al trigo sembrado en otoño. En el noroeste de Europa, la hibernación se limita a urediniomicelios en tejidos foliares vivos, ya que las temperaturas de -4°C matan las lesiones esporulantes expuestas. Las lesiones latentes pueden sobrevivir si la hoja sobrevive. En otras zonas del mundo, la nieve puede aislar las lesiones esporulantes de las bajas temperaturas, por lo que las temperaturas del aire inferiores a -4°C no consiguen eliminar las lesiones de roya. El periodo de latencia de la roya amarilla durante el invierno puede ser de hasta 118 días y se sospecha que puede ser de hasta 150 días bajo una cubierta de nieve (Zadoks, 1961).
En las zonas cercanas al ecuador, la roya amarilla tiende a recorrer un ciclo endémico desde altitudes más bajas a más altas y regresa siguiendo la fenología de los cultivos (Saari y Prescott, 1985). En latitudes más septentrionales, el ciclo se alarga en distancia y la roya de la raya se desplaza de las zonas montañosas a las estribaciones y llanuras.
Debido a su susceptibilidad a la luz ultravioleta, las urediniosporas de la roya amarilla probablemente no se transportan en estado viable tan lejos como las de las royas de la hoja y del tallo. Maddison y Manners (1972) encontraron que las urediniosporas de la roya amarilla son tres veces más sensibles a la luz ultravioleta que las de la roya del tallo. Aún así, Zadoks (1961) informa de que la roya amarilla fue transportada por el viento en estado viable más de 800 km. Las introducciones de la roya amarilla del trigo en Australia y Sudáfrica y de la roya amarilla de la cebada en Colombia probablemente contaron con la ayuda humana a través de los viajes en avión (Dubin y Stubbs, 1986; O'Brien et al., 1980). Sin embargo, la propagación de la roya amarilla de Australia a Nueva Zelanda, una distancia de 2 000 km, se produjo probablemente a través de urediniosporas transportadas por el aire (Beresford, 1982). Tal vez una espora media de la roya amarilla tenga menos probabilidades de ser transportada por el aire en estado viable a larga distancia que la de las otras royas del trigo, pero ciertamente algunas esporas deben ser capaces de sobrevivir al transporte a larga distancia en condiciones especiales y favorables. Existen varios ejemplos de migración secuencial de la roya amarilla. La virulencia del gen Yr2 (cultivares Siete Cerros, Kalyansona y Mexipak) se registró por primera vez en Turquía y, con el tiempo, se rastreó hasta el subcontinente de la India y Pakistán (Saari y Prescott, 1985) y puede estar asociada a los sistemas meteorológicos denominados "perturbación occidental". Como ya se ha mencionado, la roya amarilla de la cebada en Sudamérica migró desde su punto de introducción en Colombia hasta Chile en un periodo de pocos años (Dubin y Stubbs, 1986).
La mayoría de las zonas del mundo estudiadas parecen tener una fuente local o cercana de inóculo procedente de trigo voluntario (Line, 1976; Stubbs, 1985; Zadoks y Bouwman, 1985). Sin embargo, algunas pruebas apuntan a que el inóculo procede de gramíneas no cerealistas (Hendrix et al., 1965; Tollenaar y Houston, 1967). Los estudios futuros sobre la epidemiología de la roya amarilla deben tener en cuenta no sólo la presencia de la roya en gramíneas cercanas, sino también el hecho de que la roya debe aparecer en las gramíneas antes de su aparición en los cereales. Debe demostrarse que el fenotipo de virulencia es el mismo en ambos huéspedes y que se desplaza de las gramíneas al trigo durante la temporada de cultivo.
Las epidemias de roya amarilla en los Países Bajos pueden ser generadas por un solo uredinio por hectárea que sobreviva al invierno si la estación primaveral es favorable para el desarrollo de la roya (Zadoks y Bouwman, 1985). La detección visual de un único uredinio por hectárea es poco probable, sin embargo, a medida que se desarrollan focos alrededor del uredinio inicial, se hace progresivamente más fácil detectarlo.
Anfitriones
Puccinia striiformis es un patógeno de gramíneas y cereales: trigo, cebada, triticale y centeno. La roya amarilla es la única roya del trigo que se propaga sistemáticamente más allá del punto de infección inicial dentro de la planta.
Anfitriones alternativos
Sólo se conocen los estadios telial y uredinial de la roya amarilla. Eriksson y Henning (1894) buscaron el hospedador alternativo entre las especies de las Boraginaceae. Tranzschel (1934) sugirió que Aecidium valerianellauna roya de la valerianella, podría estar relacionada con P. striiformis. Mains (1933) pensaba que P. koeleriae Arth., P. arrhenatheri Eriks. y P. montanensis Ellisque tienen estados ecidiales en Berberis y Mahonia spp., podrían estar relacionados con P. striiformis.
Straib (1937) y Hart y Becker (1939) fracasaron en sus intentos de infectar a Berberis, Mahonia y Valerianella spp. El huésped alternativo de la roya, P. agropyri Ell. & Ev., es Clematis vitalba. Este óxido se parece mucho a P. striiformis Por ello, Viennot-Bourgin (1934) sugirió que el hospedante alternativo de la roya amarilla podría encontrarse en la familia de las clemátides. Las teliosporas germinan inmediatamente para producir basidiosporas (Wright y Lennard, 1980), y las teliosporas probablemente no ayudan al hongo como mecanismo de supervivencia invernal. Un factor epidemiológico a tener en cuenta es la posibilidad de infección del hospedante alternativo a finales del verano, por lo que las aeciosporas podrían infectar el trigo recién sembrado o las gramíneas tardías de estación fría. En algunas zonas de gran altitud de Asia occidental, la cosecha de trigo puede tardar 13 meses en madurar. En tales casos, las infecciones del hospedador alternativo a principios de la primavera serían posibles.
Ciclo de vida
Puccinia striiformis es probablemente una roya hemiforme, ya que el ciclo de vida parece consistir únicamente en los estadios uredinial y telial. Las uredias se desarrollan en franjas estrechas, amarillas y lineales, principalmente en hojas y espiguillas (Lámina 20). Cuando las cabezuelas están infectadas, las pústulas aparecen en las superficies internas de glumas y lemas (Lámina 21). Las urediniosporas son de color amarillo a naranja, más o menos esféricas, equinuladas y de 28 a 34 µm de diámetro (Lámina 22). Durante el desarrollo telial se forman rayas negras estrechas en las hojas. Las teliosporas son de color marrón oscuro, bicelulares y similares en tamaño y forma a las de P. triticina (Lámina 23). Las poblaciones de roya amarilla pueden existir, cambiar de virulencia y dar lugar a epidemias independientes de un hospedador alternativo. Las uredosporas son la única fuente conocida de inóculo para el trigo, y germinan e infectan a temperaturas más bajas.
Fuente: Las royas del trigo: R.P. Singh, J. Huerta-Espino, A.P. Roelfs
Puccinia striiformis Modelo de infección
Puccinia striiformis es la roya del trigo de climas fríos que tiene su temperatura óptima ya a partir de los 15°C. Sus infecciones se producen después de algunas horas de humedad de la hoja en condiciones de temperatura óptima. El hongo puede infectar en un amplio rango de temperaturas. El modelo asume que la infección necesita una temperatura del aire acumulada por hora de 80°C de humedad de la hoja en un rango de temperatura del aire de 5°C a 20°C. No se producen infecciones en periodos con intensidades de luz bajas.
Humedad de la hoja y luz para temperaturas medias horarias acumuladas para 80°C
- (si T
- 5°C < Temp. < 20°C
En FieldClimate una infección con P. striiformis se muestra el 23 de agosto tras un largo periodo de humedad foliar a temperaturas en torno a los 15°C (línea roja). Después de esa infección, deben tenerse en cuenta estrategias fitosanitarias curativas (sistémicas), mientras que antes de que la infección haya alcanzado 100% podrían realizarse aplicaciones protectoras.
Tizón de la cabeza por Fusarium
El tizón de la fusariosis o costra de los granos pequeños está causado por el hongo Fusarium graminearum (Schwabe), aunque los Países Bajos y otras zonas de Europa central informan de F. culmorum como la especie más prevalente (Snidjers, 1989). En Polonia, F. culmorum, F. graminearum y F. nivale han mostrado niveles similares de virulencia de moderada a grave, mientras que F. avenaceum ha demostrado ser de mediana a moderadamente virulenta. Sin embargo, en varios estudios destinados a identificar el organismo causal, hasta 18 Fusarium spp. fueron aislados e identificados (Mihuta-Grimm y Foster, 1989; Reis, 1985).
Artículo de L. Gilchrist, H.J. Dubin La sarna es frecuente en regiones cálidas y húmedas en las que la floración coincide con periodos lluviosos. La incidencia de esta enfermedad ha ido en aumento en los últimos diez años por diversas razones. Tal vez la razón más importante sea el aumento de la superficie en la que se rota el trigo con maíz u otros cereales. Otras razones son los cambios en el sistema de cultivo con fines de protección del suelo y los cambios en el cultivo de trigo de zonas tradicionales a zonas más húmedas y no tradicionales (Gilchrist et al., 1997).
La sarna del fusarium causa graves pérdidas de producción en todo el mundo, que pueden llegar al 50%. De forma similar, en Paraguay las condiciones climáticas de 1972 y 1975 favorecieron las epidemias de Fusarium y Septoria, que juntas causaron pérdidas de hasta el 70% (Viedma, 1989). Polonia, los Países Bajos, el Reino Unido, la antigua Checoslovaquia, la Federación Rusa, Francia y Austria son algunos de los países europeos que informan de la incidencia de la sarna. Zonas de Canadá, Estados Unidos, México, Guatemala, Brasil, Ecuador, Uruguay y Argentina en América están muy afectadas por Fusarium (Ireta y Gilchrist, 1994).
La sarna puede causar importantes daños en el rendimiento y la calidad, así como toxicosis en animales y humanos (Ireta y Gilchrist, 1994; Baht et al., 1989; Luo, 1988; Snidjers, 1989; Marasas et al., 1988). Los daños causados por la sarna en Estados Unidos se estimaron en más de $1.000 millones de USD en 1993 y en $500 millones de USD en 1994. En China, se calcula que la sarna puede afectar hasta a 7 millones de hectáreas, y se pueden perder 2,5 millones de toneladas de grano en años epidémicos. En China, India y Japón se han registrado enfermedades humanas relacionadas con la micotoxina de la fusariosis, mientras que en animales se han registrado enfermedades en numerosas partes del mundo (Dubin et al., 1997).
En la actualidad, existen normativas mundiales sobre micotoxinas (Van Egmond y Dekker, 1995). Sin embargo, en muchos países las normativas no se aplican, y muchas personas, sobre todo de zonas rurales, consumen los cereales sin ningún control, ya sea en grano o de forma indirecta como carne procedente de animales alimentados con grano contaminado. La tabla 16.1 muestra los principales efectos sobre los cerdos y las aves de corral inducidos por las toxinas más importantes producidas por algunos Fusarium especies.
Las condiciones climáticas húmedas y cálidas entre el espigado y la madurez aumentan la gravedad de la sarna. El punto de entrada de F. graminearum es la espiga, especialmente los órganos florales. Esto afecta al cuajado de las semillas y al llenado de los granos. Las espiguillas infectadas pierden rápidamente la clorofila y adquieren un color pálido. Más tarde se vuelven de color rosa o melocotón, especialmente en la base y los bordes de las glumas (Lámina 41). Si las condiciones ambientales siguen siendo favorables, la infección avanza a las espiguillas adyacentes y en algunos casos puede infectar toda la espiga, incluyendo el raquis y su pedúnculo. Cuando la infección es grave, los granos dañados se cubren de micelio y adquieren el aspecto de una masa algodonosa rosada. Si los niveles de la enfermedad son moderados, el grano puede estar arrugado, con poco peso y de color blanquecino (granos de lápida).
Principales efectos tóxicos en cerdos y aves de corral inducidos por las toxinas más importantes producidas por algunas especies de Fusarium
| Micotoxina | Signos clínicos |
| Zearalenona | Vulva roja e hinchada; prolapso vaginal en cerdos; los lechones pueden mostrar agrandamiento de las vulvas; problemas de fertilidad |
| Vomitoxina (desoxinivalenol, DON) | Disminución de la ingesta de alimento y aumento de peso en cerdos con DON a >2 mg/kg de alimento; vómitos; rechazo del alimento a concentraciones muy altas de DON (>20 mg/kg de alimento)a |
| Otros tricotecenos Toxina T-2 Toxina HT-2 Diacetoxiescirpenol> | Más tóxico que el DON; reducción de la ingesta de alimentos; emesis; irritación cutánea y gastrointestinal; neurotoxicidad; crías anormales; aumento de la sensibilidad a las enfermedades; hemorragias. |
| Ocharatoxina | Afecta principalmente a los túbulos proximales de los riñones en cerdos y aves de corral; los riñones están groseramente agrandados y pálidos; hígados grasos en aves de corral. |
amg/kg = partes por millón (ppm).
Fuente: Trenholm et al., 1984.
Fusarium graminearum (Lámina 42) puede atacar a las plantas de trigo en todas las etapas de crecimiento, causando enfermedades de pudrición de plántulas, tallos y raíces. Las infecciones primarias pueden surgir de ascosporas o macroconidias depositadas en glumas y anteras extruidas. Temperaturas de 10° a 30°C y humedad relativa superior al 95 por ciento durante 40 a 60 horas suelen ser suficientes para que los macroconidios infecten con éxito las espigas (Ireta, 1989).
Fusarium graminearum es uno de los pocos Fusarium especie que produce peritecios en condiciones de campo (Lámina 43, Lámina, 44). Los peritecios representan la fase sexual del hongo, Gibberella zeae, y se producen en las glumas del trigo. Los peritecios desempeñan un papel importante en la supervivencia del patógeno de un año a otro (Khonga y Sutton, 1988) y coexisten con micelios en residuos del cultivo anterior para constituir la fuente de inóculo inicial de la sarna. Las investigaciones llevadas a cabo en China demostraron que la temperatura más baja para la producción de peritecios era de 7° a 10°C, y la más adecuada de 15° a 20°C. El contenido de humedad del suelo más bajo para la producción de peritecios era del 50 al 60 por ciento, y el más adecuado del 70 al 80 por ciento (Wang, 1997).
Los factores que determinan el desarrollo de la enfermedad incluyen el clima, los niveles de inóculo y la fase de crecimiento del trigo. Las epidemias de sarna del trigo dependen principalmente de la cantidad de inóculo primario, más que del inóculo secundario. La invasión se produce sobre todo durante el periodo de floración. La infección secundaria con conidios (Lámina 45) se produce después de que las espigas enfermas aparezcan en el campo.
Los residuos de cultivos y las prácticas culturales desempeñan un papel importante en la conservación de F. graminearum y, en consecuencia, epidemias. Las infecciones en trigo sembrado en un campo de residuos de maíz pueden ser dos o tres veces más graves (Teich y Nelson, 1984). En general, el patógeno sólo era saprofito en rastrojos de arroz en las zonas de rotación arroz-trigo y en tallos de maíz en las zonas de siembra en seco de China (Wang, 1997). Si se ara el residuo, disminuye la supervivencia de los peritecios y se reduce la fuente primaria de inóculo (Reis, 1989).
Fusarium graminearum es un parásito facultativo y es patógeno en muchas otras gramíneas, incluidas malas hierbas comunes y cultivos de cereales (centeno, arroz, cebada y triticale). Si algunas prácticas, como la rotación con cultivos no hospedantes o la gestión de los residuos de cultivos, no son eficaces por sí solas, pueden, en combinación, reducir la fuente de inóculo primario. El control de la enfermedad se basa eficazmente en una gestión integrada, que incluye prácticas agronómicas adecuadas, la utilización de cultivares resistentes o tolerantes y aplicaciones químicas.
Biología del tizón de la cabeza por Fusarium
Patógenos ocasionales
El FHB está causado por especies fúngicas del género Fusarium. La especie más común causante de FHB es Fusarium graminearum (etapa sexual - Gibberella zeae). Este hongo es el mismo que se asocia con frecuencia a la podredumbre del tallo del maíz. Otro Fusarium especie causante de la FHB es Fusarium culmorum. Ambos F. graminearum y F. culmorum también puede causar la pudrición de las raíces de los granos pequeños. En la cebada, otros dos Fusarium especies, F. poae y F. avenaceumtambién puede causar el tizón de la semilla.
Supervivencia y propagación
El hongo persiste y se multiplica en los residuos de cultivos infectados de cereales pequeños y maíz. Cuando el tiempo es húmedo, las esporas del hongo son arrastradas por el viento o salpicadas sobre las cabezas de los cultivos de cereales. Las esporas pueden proceder del interior de un cultivo o ser arrastradas por el viento desde los cultivos circundantes, a veces a grandes distancias. Los cultivos de trigo y trigo duro son susceptibles de infección desde el periodo de floración (polinización) hasta la fase de desarrollo del grano. Las esporas del hongo causal pueden posarse en las anteras expuestas en el momento de la floración y luego crecer en los granos, glumas u otras partes de la cabeza. En el caso de la cebada de primavera, que florece cuando el cogollo está en la bota, la infección es más común después del periodo de floración, una vez que el cogollo atraviesa la vaina de la hoja. La infección en ambos cultivos puede continuar hasta cerca de la madurez del grano en condiciones ambientales favorables para el organismo u organismos.
Las condiciones más favorables para la infección son periodos prolongados (48 a 72 horas) de alta humedad y temperaturas cálidas (75 a 85 grados Fahrenheit (24°C a 30°C)). Sin embargo, la infección se produce a temperaturas más bajas cuando la humedad alta persiste durante más de 72 horas. Las infecciones tempranas pueden producir esporas transportadas por el aire, que son responsables de la propagación secundaria de la enfermedad, especialmente si el cultivo tiene una floración irregular debido a los macollos tardíos.
Dado que el desarrollo de la FHB depende de condiciones ambientales favorables desde la floración (aparición de la cabeza en la cebada) hasta el desarrollo del grano, la aparición y gravedad de la enfermedad varía de un año a otro. Una combinación de factores que puede conducir a las pérdidas más severas de rendimiento y calidad son: abundante inóculo, períodos prolongados o repetidos de humedad y alta humedad durante la floración (emergencia de la cabeza en la cebada) a través del desarrollo del grano, y el uso de un cultivar muy susceptible.
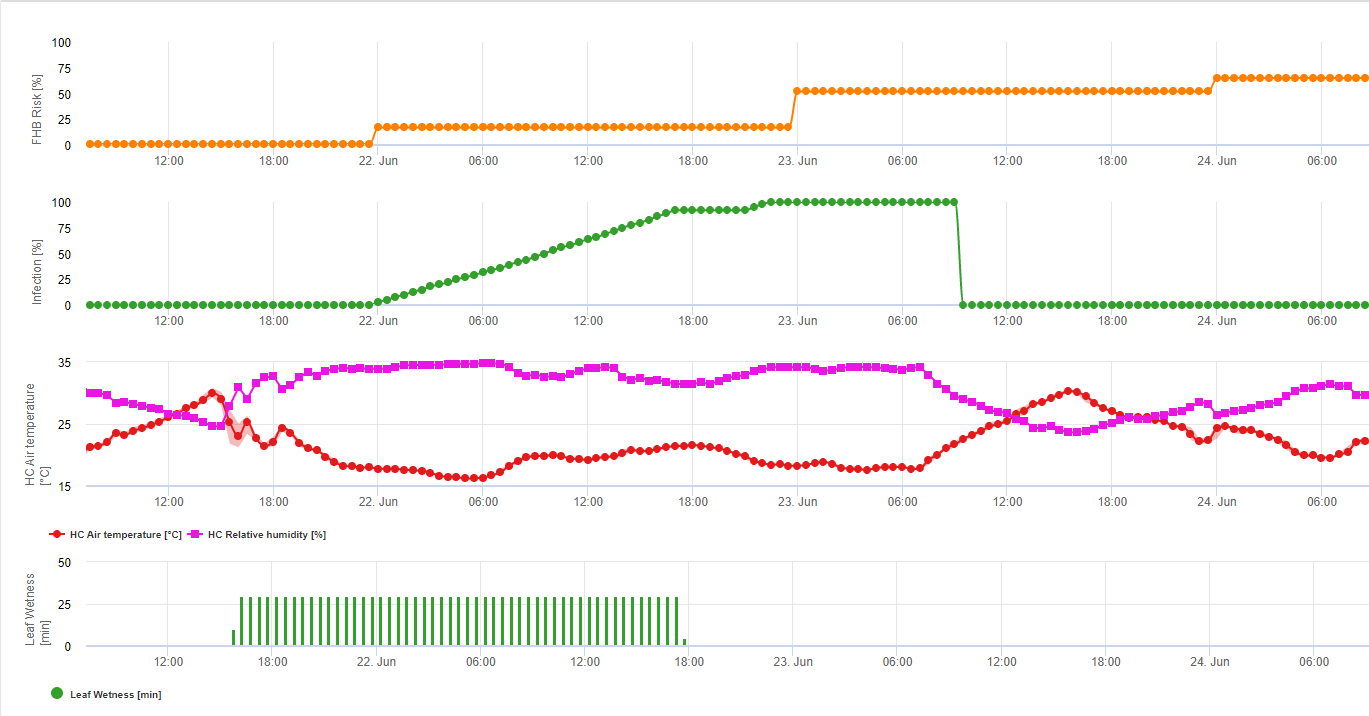
Modelo de infección por el tizón de la fusariosis
Se sabe que los agentes fúngicos pertenecientes al complejo Fusarium Head Blight en el trigo se ven favorecidos por temperaturas cálidas de 20 °C a 30 °C y largos periodos húmedos. Los periodos de varios días de humedad en las hojas provocan síntomas visibles tempranos. Pero los síntomas pueden observarse tras un periodo de latencia más largo si la infección va seguida de un periodo de humectación de la hoja de 18 horas o incluso menos. Los síntomas también pueden aparecer tras la inoculación artificial a temperaturas de 15°C.
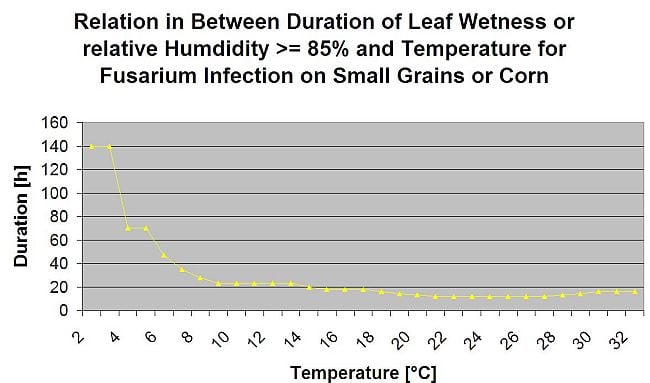


Resumiendo todas las diferentes combinaciones de temperatura y humedad que hemos encontrado en la literatura, hemos decidido señalar las infecciones por Fusarium Head bligh si la temperatura y el periodo de humedad de la hoja o periodos con más de 85% de humedad relativa superan los valores visualizados en el siguiente gráfico.
Las infecciones se inician con una lluvia de 2 mm. Se puede suponer que existe una infección por Fusarium Head Blight si el valor de progreso de la infección alcanza 100%. El cálculo de este valor de progreso sigue la relación entre la duración de las condiciones húmedas y la temperatura mostrada en el gráfico anterior.
Este modelo se utiliza para visualizar los días de infección y las condiciones climáticas durante el clima. El conocimiento por parte de los cultivadores del estado de desarrollo de las distintas variedades de trigo permite decidir la aplicación de una pulverización curativa inmediatamente después de la infección.
Alerta por micotoxinas de fusarium
Los ensayos de infección con periodos prolongados de humectación de las hojas de Fusarium head blight dan lugar a contenidos elevados de micotoxinas. A partir de esta información, se asume que un periodo de humectación de la hoja de 48 horas o más durante los estadios 61 y 69 supone un alto riesgo de micotoxinas. Las experiencias realizadas a lo largo de los análisis de DON en trigo cultivado comercialmente mostraron que los periodos de humedad de la hoja suficientemente largos para la infección después de una infección inicial en las fases 61 a 69 pueden aumentar también los valores de DON. En el caso de periodos de humedad foliar más largos, las micotoxinas pueden aumentar hasta el estadio 85. FieldClimate acumula una cifra de riesgo proporcional al progreso de la infección por cada periodo de infección exitoso durante el periodo que se ha seleccionado como adecuado para este cálculo. 6 periodos de infección acabados de completar supondrían un riesgo de 100%. Normalmente, el periodo de humedad de la hoja que conduce a una infección por fusarium es superior al mínimo necesario. Por lo tanto, la mayoría de las infecciones por fusarium provocarán un aumento del riesgo superior a 17%. El valor de riesgo que apunta a una situación problemática de micotoxinas depende de la historia del campo. El trigo cultivado después de maíz sin laboreo o el trigo sin laboreo después de maíz sin laboreo sólo puede conllevar un pequeño riesgo si no se pulveriza en la situación óptima. En el trigo no rociado tenemos que esperar un aumento de los valores de DON ya después de 35% de riesgo. El trigo después del trigo sin laboreo que sigue a cualquier otro cultivo que no sea maíz o trigo puede conllevar un riesgo mayor de 50%. Si tenemos trigo después de maíz o trigo con labranza el riesgo que se acsted puede extenderse a 70%. El trigo de primer año debe someterse a pruebas de DON si el riesgo supera los 100%.
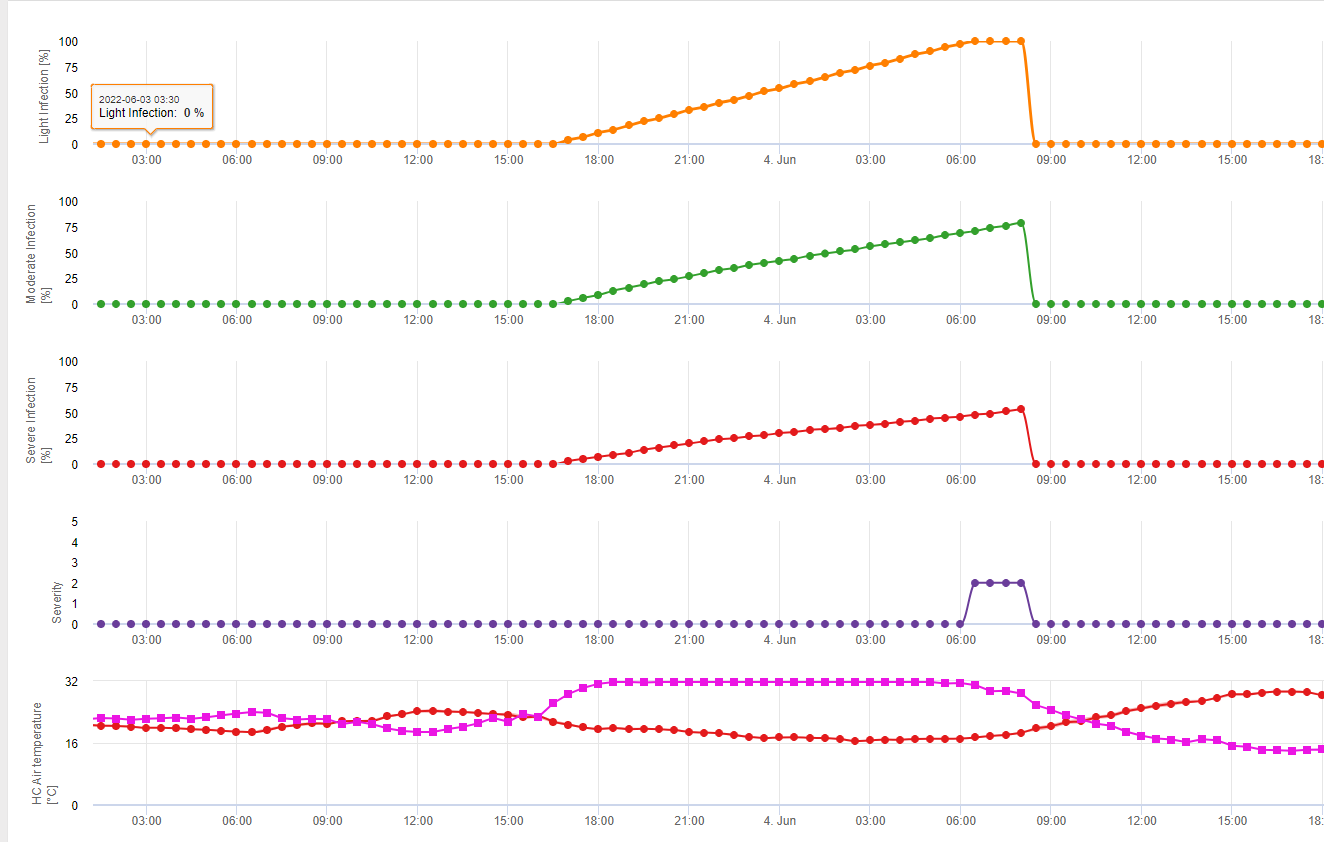
1) Fusarium Head Blight Modelo de riesgo que calcula los periodos de riesgo de infección. Cuando se alcanza la infección 100% (línea verde), el riesgo (línea azul) es muy alto y las condiciones para el hongo han sido favorables para la infección. En función del método de aplicación (curativo, preventivo), la línea azul indica el periodo de riesgo.
2) Tizón de la cabeza por Fusarium: en este modelo la infección del FHB se calcula por la precipitación (se necesitan 2mm), la humedad relativa (por encima de 85%) o la humedad de la hoja, la temperatura durante el proceso. Si la infección alcanza los 100%, se habrán alcanzado las condiciones óptimas para el hongo patógeno. A continuación, el modelo calcula el riesgo de micotoxinas del FHB.
Mancha moteada de la hoja
Existen dos enfermedades principales de Septoria en el trigo. Se trata de la mancha Septoria tritici, provocada por el hongo Septoria tritici (teleomorfo: Mycophaerella graminicola), y Septoriosis nodular causada por el hongo Septoria nodorum (teleomorfo: Leptosphaeria nodorum). Ambas enfermedades causan graves pérdidas de rendimiento que oscilan entre el 31 y el 53% (Eyal, 1981; Babadoost y Herbert, 1984; Polley y Thomas, 1991). En todo el mundo están afectadas más de 50 millones de hectáreas de trigo, que crecen principalmente en zonas de alta pluviosidad. Durante los últimos 25 años, estas enfermedades han ido en aumento y se han convertido en un importante factor limitante de la producción de trigo en determinadas zonas. Cuando las epidemias son graves, los granos de los cultivares de trigo susceptibles se marchitan y no son aptos para la molienda. Las epidemias de Septoria tritici blotch y Septoria nodorum blotch del trigo están asociadas a condiciones climáticas favorables (lluvias frecuentes y temperaturas moderadas), prácticas culturales específicas, disponibilidad de inóculo y presencia de cultivares de trigo susceptibles (Eyal et al., 1987).
Septoria spp. Biología
Después de Erick De Wolf, Septoria Tritici Blotch, Kansas State University, abril de 2008 Septoria tritici mancha conocida como mancha moteada de la hoja, está causada por el hongo Septoria tritici. Se distribuye por todas las zonas trigueras del mundo y constituye un grave problema en muchas regiones. La mancha de Septoria tritici es más dañina cuando la enfermedad ataca las hojas superiores y las cabezas de las variedades susceptibles a finales de la temporada.
Síntomas
Septoria tritici Los síntomas de la mancha aparecen por primera vez en otoño. Los síntomas iniciales son pequeñas manchas amarillas en las hojas. Estas lesiones suelen adquirir un color bronceado claro a medida que envejecen, y los cuerpos fructíferos del hongo pueden verse incrustados en las lesiones de las axilas. Las lesiones tienen forma irregular y varían de elípticas a largas y estrechas (Figura 1). Las lesiones contienen pequeñas motas redondas negras que son los cuerpos fructíferos del hongo. Los cuerpos fructíferos negros parecen granos de pimienta negra y normalmente pueden verse sin ayuda de una lupa. La enfermedad comienza en las hojas inferiores y avanza gradualmente hasta la hoja bandera. Las vainas de las hojas también son susceptibles de ser atacadas. En años húmedos, el hongo de la mancha moteada de la hoja puede desplazarse a los cogollos y causar lesiones marrones en las glumas y las axilas, conocidas como mancha de las glumas. Estas lesiones a menudo se vuelven de color bronceado claro a medida que envejecen y los cuerpos fructíferos del hongo se ven a menudo incrustados en las lesiones de las glumas.
La fase de la mancha de la gluma puede causar una pérdida significativa de rendimiento, pero no se conoce bien la relación entre la gravedad de la enfermedad y la pérdida de rendimiento. Septoria tritici puede confundirse con otras enfermedades de las hojas que presentan síntomas muy similares: mancha bronceada y Stagonspora nodorum por ejemplo. Es frecuente que las plantas estén infectadas por más de una de estas enfermedades foliares, y puede ser necesario realizar exámenes de laboratorio para diagnosticar con precisión qué enfermedades son las más prevalentes. El examen de laboratorio es casi siempre necesario para distinguir la causa de la mancha de la gluma. Conocer la especie no es importante para las decisiones de pulverización porque las tres enfermedades responden de forma similar a los fungicidas. Sin embargo, saber cuáles son las enfermedades más prevalentes es una parte importante de la selección de variedades, ya que diferentes genes controlan la resistencia a las enfermedades.
La forma más fiable de distinguir la mancha por Septoria tritici de las otras enfermedades es por la presencia de los cuerpos fructíferos negros del hongo. El hongo que causa la mancha bronceada no produce este tipo de estructura reproductiva. Sin embargo, en condiciones húmedas, el hongo que causa la mancha Stagonospora nodorum producirá cuerpos fructíferos de color marrón claro. Además de la diferencia de color, estas estructuras también son más pequeñas que las producidas por Septoria tritici.
Ciclo de vida
Septoria tritici sobrevive durante el verano en los residuos de un cultivo de trigo anterior e inicia las infecciones en otoño. Existen algunas pruebas de que el hongo es capaz de sobrevivir en asociación con otras gramíneas hospedadoras y semillas de trigo. Estas fuentes del hongo son probablemente más importantes cuando no hay residuos de trigo. Independientemente de las prácticas de rotación o de gestión de residuos, suele haber suficiente inóculo para iniciar las infecciones otoñales. Septoria tritici La mancha se ve favorecida por el clima fresco y húmedo. El intervalo óptimo de temperatura es de 16 a 21 °C; sin embargo, pueden producirse infecciones durante los meses de invierno a temperaturas tan bajas como 5 °C. La infección requiere al menos 6 horas de humedad en las hojas, y hasta 48 horas de humedad para una infección máxima. Una vez que se ha producido la infección, el hongo tarda entre 21 y 28 días en desarrollar los característicos cuerpos fructíferos negros y producir una nueva generación de esporas. Las esporas producidas en estos cuerpos fructíferos se exudan en masas pegajosas y requieren lluvia para salpicarlas sobre las hojas superiores y los cogollos.
Infección por Septoria tritici
Picnidiosporas de S. tritici germinan en agua libre de ambos extremos de la espora o de las células intercalares (Weber, 1922). La germinación de las esporas no comienza hasta unas 12 horas después del contacto con la hoja. Los tubos germinativos crecen al azar sobre la superficie de la hoja. Weber (1922) sólo observó la penetración directa entre las células epidérmicas, pero otros concluyeron que la penetración a través de los estomas abiertos y cerrados es el principal medio de penetración en el hospedador (Benedict, 1971; Cohen y Eyal, 1993; Hilu y Bever, 1957). Kema et al. (1996) sólo observaron penetración estomática. Las hifas que crecen a través de los estomas se contraen hasta alcanzar un diámetro de aproximadamente 1 μm, y luego se ensanchan tras alcanzar la cavidad subestomática.
Las hifas crecen paralelas a la superficie de la hoja por debajo de las células epidérmicas, después a través del mesófilo hasta las células de la parte inferior de la epidermis, pero no dentro de la epidermis. No se forman haustorios y el crecimiento hifal está limitado por las células del esclerénquima alrededor de los haces vasculares, excepto cuando las hifas son muy densas. Los haces vasculares no son invadidos. Las hifas crecen intercelularmente a lo largo de las paredes celulares a través del mesófilo, ramificándose en el tabique o en el centro de una célula. No aparecen síntomas macroscópicos durante unos 9 días, salvo alguna célula muerta ocasional, pero las células del mesófilo mueren rápidamente a los 11 días. Los picnidios se desarrollan en cámaras substomáticas. Las hifas rara vez crecen dentro de las células huésped (Hilu y Bever, 1957; Kema et al, 1996; Weber, 1922).
La infección exitosa sólo se produce después de al menos 20 horas de alta humedad. Sólo se desarrollan unas pocas motas marrones si las hojas permanecen húmedas durante 5-10 horas después de la deposición de las esporas (Holmes y Colhoun, 1974) o hasta 24 horas (Kema et al., 1996). Las relaciones huésped-parásito son las mismas en trigos resistentes o susceptibles. La germinación de las esporas en la superficie de la hoja es la misma independientemente de la susceptibilidad. El número de penetraciones exitosas es aproximadamente el mismo, pero el crecimiento hifal es más rápido en cultivares susceptibles, resultando en más lesiones. Las hifas se extienden más allá de la zona necrótica en todos los cultivares. Una toxina puede jugar un papel en la patogénesis (Cohen y Eyal, 1993; Hilu y Bever, 1957). Por el contrario, la colonización se redujo considerablemente en una línea resistente (Kema et al., 1996).
Stagonospora (Septoria) y Septoria patógenos de los cereales: El proceso de infección
B.M. Cunfer, Departamento de Patología Vegetal, Universidad de Georgia, Griffin, GA
El proceso de infección se ha estudiado más intensamente para Stagonospora (Septoria) nodorum y Septoria tritici. Un estudio en profundidad sobre Septoria passerinii está disponible. Casi toda la información comunicada se refiere a la infección por picnidiosporas. Sin embargo, el proceso de infección de otras formas de esporas es bastante similar. La información presentada se refiere principalmente a la infección de hojas en condiciones óptimas. Algunos estudios se realizaron con plantas de semillero intactas, mientras que otros se llevaron a cabo con hojas desprendidas. Infección del coleóptilo y la plántula de trigo por S. nodorum fue descrito en detalle por Baker (1971) y revisado por Cunfer (1983). Aunque no se han hecho comparaciones precisas, parece que el proceso de infección tiene muchas similitudes en cada sistema huésped-parásito y es típico de muchos patógenos necrótrofos. Se excluye la información sobre los factores que influyen en el desarrollo de los síntomas y la expresión de la enfermedad, pero han sido revisados por otros autores (Eyal et al., 1987; King et al., 1983; Shipton et al., 1971). Se incluye un resumen de los factores que afectan a la longevidad de las esporas en la superficie de las hojas.
Papel de los cirros y supervivencia de las esporas en la superficie de la hoja La información más detallada sobre la función del cirro que recubre las picnidiosporas exudadas del picnidio corresponde a S. nodorum. El cirro es un gel formado por compuestos proteínicos y sacáridos. Su composición y función son similares a las de otros hongos de la familia Sphaeropsidales (Fournet, 1969; Fournet et al., 1970; Griffiths y Peverett, 1980). Las funciones principales de los componentes de los cirros son la protección de las picnidiosporas frente a la desecación y la prevención de la germinación prematura.
El cirro protege las picnidiosporas de modo que algunas permanecen viables al menos 28 días (Fournet, 1969). Cuando el cirro se diluía con agua, si la concentración de la solución de cirro era >20%, germinaban menos de 10% de picnidiosporas. A menor concentración, los componentes proporcionan nutrientes que estimulan la germinación de las esporas y la elongación de los tubos germinativos. La longitud de los tubos germinativos aumentó hasta una concentración de cirros de 15%, y luego disminuyó moderadamente a concentraciones más altas (Harrower, 1976). Brennan et al. (1986) informaron de una mayor germinación en cirros diluidos. Los componentes de los cirros redujeron la germinación a una humedad relativa de 10-60%. Una vez que las esporas se dispersan, los efectos estimulantes del fluido de cirros son probablemente insignificantes (Griffiths y Peverett, 1980).
A una humedad relativa de 35-45%, las esporas de S. tritici en cirros permanecieron viables al menos 60 días (Gough y Lee, 1985). Los componentes de los cirros pueden actuar como inhibidores de la germinación de las esporas, o el alto potencial osmótico de los cirros puede impedir la germinación. Las picnidiosporas de S. nodorum no sobrevivieron durante 24 horas a una humedad relativa superior a 80% a 20 C. Las esporas sobrevivieron dos semanas o más a una humedad relativa <10% (Griffiths y Peverett, 1980). Cuando el fluido cirroso de S. nodorum se diluyó con agua, aproximadamente dos tercios de las picnidiosporas perdieron viabilidad en 8 horas, y después de 30 horas a la luz del día, sólo 5% germinaron. Cuando las esporas se almacenaron en la oscuridad, 40% siguieron siendo viables después de 30 horas (Brennan et al., 1986).
Conidios secos de S. nodorum, a la sombra y a la luz solar directa, sobrevivieron a la intemperie al menos 56 horas (Fernandes y Hendrix, 1986a). La germinación de las picnidiosporas de S. nodorum fue inhibida por la UV-B continua (280-320 nm), mientras que la germinación de las de S. tritici no lo fue. La extensión del tubo germinativo bajo UV-B continua fue inhibida para ambos hongos, en comparación con la oscuridad (Rasanayagam et al., 1995).
Infección por Septoria nodorum
El proceso de penetración en el huésped y el desarrollo de S. nodorum dentro de la hoja fue examinada en detalle por varios investigadores (Baker y Smith, 1978, Bird y Ride 1981, Karjalainen y Lounatmaa, 1986; Keon y Hargreaves, 1984; Straley, 1979; Weber, 1922). Las picnidiosporas tienden a alojarse en las depresiones entre dos células epidérmicas, y muchos intentos de penetración en las hojas comienzan allí. Las esporas germinan en la superficie de la hoja en respuesta a la humedad libre (Fernandes y Hendrix, 1986b). Comienzan a germinar 2-3 horas después de la deposición, y después de 8 horas la germinación puede alcanzar 90%. La penetración en la hoja comienza unas 10 horas después de la deposición de las esporas (Bird y Ride, 1981; Brönnimann et al., 1972; Holmes y Colhoun, 1974).
Al inicio de la germinación, el tubo germinativo está rodeado de un material amorfo que se adhiere a la hoja. Los tubos germinativos que crecen desde cualquiera de los extremos de una espora y desde las células intercalares tienden a crecer a lo largo de las depresiones entre las células y a menudo se orientan a lo largo del eje largo de la hoja (O'Reilly y Downes, 1986). Las hifas de las esporas que no están en las depresiones crecen al azar con ramificaciones ocasionales (Straley, 1979). Se forma un apresorio con una púa de infección que penetra la cutícula y las paredes periclinales de las células epidérmicas directamente en el lumen celular, lo que provoca la muerte rápida de las células.
Muchas penetraciones son primero subcuticulares o el crecimiento lateral de una hifa ocurre dentro de la pared celular antes del crecimiento hacia el citoplasma (Bird y Ride, 1981; O'Reilly y Downes, 1986). La penetración a través de estomas abiertos y cerrados también se produce y puede ser más rápida que la penetración directa (Harrower, 1976; Jenkins, 1978; O'Reilly y Downes, 1986; Straley, 1979). Los tubos germinativos se ramifican en los estomas y en las uniones de las células epidérmicas. La penetración de un tubo germinativo en un estoma puede producirse sin formación de un apresorio. En ocasiones, la penetración se produce a través de los tricomas (Straley, 1979). Aparentemente, la mayoría de los intentos de penetración fracasan, formándose densas papilas en las células en el lugar del intento de penetración (Karjalainen y Lounatmaa, 1986; Bird y Ride, 1981).
Tras la penetración, las células epidérmicas mueren rápidamente y se lignifican, y las hifas crecen hacia el mesófilo. Las células del mesófilo se deforman y el material lignificado se deposita en el exterior de algunas células, que se colapsan. La lignificación se produce antes de que las hifas alcancen la célula. El proceso es el mismo en todos los cultivares, pero se desarrolla más lentamente en los cultivares resistentes. Las hifas crecen intercelularmente entre las células epidérmicas y después en el mesófilo. Cuando penetran en el mesófilo, el deterioro del cloroplasto comienza en 6-9 días (Karjalainen y Lounatmaa, 1986).
Sin embargo, la tasa fotosintética empieza a disminuir un día después de la infección y antes de que los síntomas sean visibles (Krupinsky et al, 1973). El tejido esclerénquima alrededor de los haces vasculares impide la infección del tejido vascular. Los haces vasculares bloquean la propagación de las hifas a través del mesófilo, excepto cuando el tejido esclerénquima es joven y no está completamente formado (Baker y Smith, 1978).
Stagonospora nodorum libera una amplia gama de enzimas que degradan la pared celular, como amilasa, pectina metil esterasa, poligalacturonasas, xilanasas y celulasa in vitro y durante la infección de hojas de trigo (Baker, 1969; Lehtinen, 1993; Magro, 1984). La información relacionada con la degradación de la pared celular por las enzimas concuerda con las observaciones histológicas. Estas enzimas pueden actuar conjuntamente con las toxinas. La sensibilidad enzimática puede estar relacionada con la resistencia y la tasa de colonización fúngica (Magro, 1984). Como muchos necrótrofos, los patógenos Septoria y Stagonospora producen compuestos fitotóxicos in vitro. El deterioro celular y la muerte antes del crecimiento hifal en el tejido mesófilo (Bird y Ride, 1981) es consistente con la producción de toxinas. Sin embargo, no se ha establecido un papel definitivo para las toxinas en el proceso de infección y su relación con la resistencia del huésped (Bethenod et al, 1982; Bousquet et al, 1980; Essad y Bousquet, 1981; King et al, 1983). Las diferencias en el rango de hospedadores entre las cepas de trigo y cebada adaptadas de S. nodorum puede estar relacionada con la producción de toxinas (Bousquet y Kollmann, 1998). El inicio de la germinación de las esporas y el porcentaje de esporas germinadas no están influidos por la susceptibilidad del hospedador (Bird y Ride, 1981; Morgan 1974; Straley, 1979; Straley y Scharen, 1979; Baker y Smith, 1978).
Bird y Ride (1981) informaron que la extensión de los tubos germinativos en la superficie de la hoja era más lenta en los cultivares resistentes que en los susceptibles. Este mecanismo, expresado al menos 48 horas después de la deposición de las esporas, indica una resistencia a la elongación de los tubos germinativos previa a la penetración. Hubo menos penetraciones exitosas en cultivares resistentes, y la penetración procedió más lentamente en cultivares resistentes (Baker y Smith, 1978; Bird y Ride, 1981). Se propuso que la lignificación limitaba la infección tanto en cultivares resistentes como susceptibles, pero otros factores ralentizaban el desarrollo del hongo en las líneas resistentes. En las líneas susceptibles, las hifas de crecimiento más rápido pueden escapar a la lignificación de las células huésped.Cuatro días después de la inoculación de cebada con un aislado de biotipo de trigo de S. nodorum, las hifas crecían a través de la cutícula y a veces en las capas externas de celulosa de las paredes celulares epidérmicas. Debajo de las hifas de penetración se depositaban papilas gruesas que no penetraban en las células (Keon y Hargreaves, 1984).
Infección por Septoria passerinii
Green y Dickson (1957) presentan una descripción detallada del proceso de infección de S. passerinii en la cebada. El proceso de infección es similar al S. tritici. Al igual que S. tritici, el tiempo necesario para la penetración en las hojas es considerablemente mayor que el de S. tritici. S. nodorum. Los tubos germinativos se ramifican y crecen sobre la superficie de la hoja al azar, pero a veces a lo largo de depresiones entre células epidérmicas. La penetración en la hoja se produce casi exclusivamente a través de los estomas. Las hifas germinativas se hinchan y, si la penetración no tiene éxito, las hifas siguen alargándose. No se produce penetración 48 horas después de la deposición de las esporas. Después de 72 horas, los tubos germinativos se engrosan sobre los estomas, crecen entre las células protectoras y en las caras urfales de las células accesorias y en las cavidades substomáticas. La penetración directa entre las células epidérmicas sólo se observa en raras ocasiones.
La germinación de las esporas y la penetración en el huésped son las mismas en los cultivares resistentes y susceptibles. La extensión de las hifas dentro de las hojas es mucho menor en los cultivares resistentes y se observan papilas en muchas paredes celulares, pero no en todas. Las hifas crecen bajo la epidermis de un estoma a otro, pero no penetran entre las células epidérmicas. El mesófilo está colonizado, pero no se forman haustorios. Cuando las células del mesófilo se necrosan, las células epidérmicas se colapsan. El desarrollo micelial en la hoja es escaso y suele estar bloqueado por haces vasculares. En las hojas más jóvenes, si la vaina vascular está menos desarrollada, las hifas pasan entre el haz y la epidermis. Los picnidios se forman en cavidades substomáticas, principalmente en la superficie superior de la hoja (Green y Dickson, 1957).
Factores que afectan a la longevidad de las esporas en la superficie de la hoja Entre los patógenos Stagonospora y Septoria de los cereales, sólo se dispone de información definitiva sobre el proceso de infección en el caso de S. nodorum, S. triticiy S. passerinii. Al igual que muchos otros patógenos necrótrofos, ninguno de los dos grupos de patógenos provoca la reacción de hipersensibilidad. Una diferencia significativa en el proceso de infección entre los patógenos Septoria y Stagonospora es que la germinación y penetración de las esporas es mucho más rápida en el caso de Septoria y Stagonospora. S. nodorum que para S. tritici y S. passerinii. Esto influye considerablemente en la epidemiología de las enfermedades.
Los patógenos de Septoria penetran en la planta principalmente a través de los estomas, mientras que S. nodorum penetra tanto directamente como a través de los estomas. S. nodorum penetra y mata rápidamente las células epidérmicas, pero S. tritici y S. passerinii no matan las células epidérmicas hasta que las hifas se han ramificado a través del mesófilo de la hoja y comienza una rápida necrosis. Los estudios histológicos del crecimiento del hongo tras la penetración en el hospedador coinciden con los datos generados por los estudios epidemiológicos de la resistencia del hospedador. La resistencia ralentiza la tasa de colonización del hospedador, pero no tiene un efecto apreciable en el proceso de desarrollo de la lesión.
Los mecanismos que controlan la respuesta del hospedador, ya estén relacionados con enzimas y toxinas u otros metabolitos liberados por los patógenos durante la infección, aún no están claros. Existe poca información sobre la infección por ascosporas. El proceso de infección es probablemente muy similar al de las picnidiosporas. Las ascosporas de Phaeosphaeria nodorum germinan en un amplio rango de temperaturas y sus tubos germinativos penetran directamente en la hoja. Sin embargo, según Rapilly et al. (1973), las ascosporas, a diferencia de las picnidiosporas, no germinan en agua libre.
Modelo de infección por Septoria spp.
Las infecciones por Septoria son posibles a bajas temperaturas, mientras que las temperaturas inferiores a 7°C pueden no provocar una infección en un plazo de 2 días. La temperatura óptima de la enfermedad se alcanza en la zona de 16 a 21°C. Las infecciones son posibles en un periodo de alta humedad relativa o de humedad foliar de 14 horas o más. Para cumplir las condiciones hemos decidido separar en modelos las infecciones débiles, moderadas y graves. Las infecciones débiles pueden darse si es posible que el patógeno infecte el tejido del huésped. Esto significa que las infecciones débiles pueden tener lugar si las temperaturas son mínimas y los periodos de humedad de las hojas tienen una duración crítica. Una infección moderada tendrá lugar en condiciones en las que la mayoría de los ensayos de infecitón conducen a resultados razonables y las infecciones graves tienen lugar en condiciones en las que el patógeno dispone de condiciones óptimas para la infección.
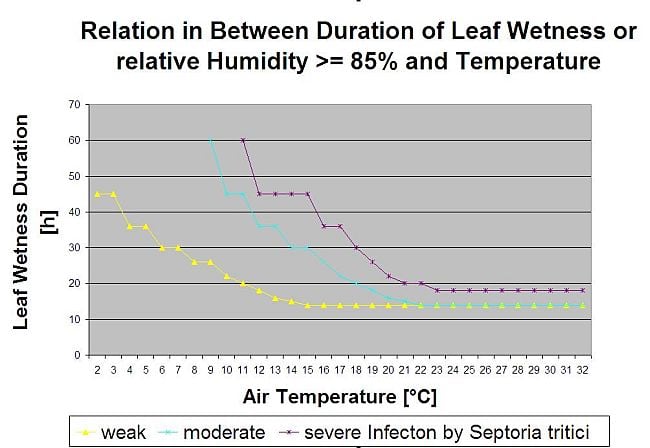


Comienza la infección tras una lluvia de 0,5 mm. Decidimos no utilizar un modelo para la formación de picnidios. Se supone que la condición necesaria para la formación de picnidios es un periodo con una humedad relativa superior a 85%. Se espera que el tiempo de vida de los picnidios sea de 24 horas. En todos los climas en los que Septoria tritici tiene posibilidades de infectar, encontraremos 2 horas cumpliendo estas condiciones casi todos los días alrededor de la salida del sol.
Evaluación de la gravedad de la infección
Para poder evaluar la presión de la infección por Septoria tritici entre el estadio 10 (primera hoja a través del coleóptilo) y el estadio 32 (segundo nudo al menos 2 cm por encima del primer nudo) y entre el 32 y el 51 (inicio del espigado), debemos evaluar la gravedad de las infecciones en función de las condiciones climáticas. Esta evaluación se realiza en una escala de 1 a 5. Se da una gravedad de 1 si la infección es grave. Se da una severidad de 1 si se cumplen las condiciones para una infección débil y ha llovido menos de 5 mm, de lo contrario el valor de severidad correspondiente será 2. Se da una severidad de 3 si se cumplen las condiciones para una infección débil y ha llovido menos de 5 mm, de lo contrario el valor de severidad correspondiente será 2. La gravedad será 3 si se cumple la condición de infección moderada y ha llovido menos de 5 mm. Si ha llovido más de 5 mm durante una infección moderada o menos de 5 mm durante una infección grave, la gravedad será 4.
Una infección grave con más de 5 mm de lluvia corresponde a un valor de gravedad de 5.
Septoria tritici evaluación de la presión de la enfermedad
El clima es sólo uno de los factores que determinan la presión de la enfermedad en el campo. Los otros dos factores son el historial del campo y la susceptibilidad de la variedad cultivada. Si podemos acumular los valores de severidad de la enfermedad desde el estadio 10 al 32 hasta un valor de 4, podemos esperar una presión débil de la enfermedad por el clima. Si este valor alcanza 6 podemos esperar una presión moderada de la enfermedad y si alcanza 10 podemos esperar una alta presión de la enfermedad por el clima. Conocer la susceptibilidad de la variedad y el historial del campo nos llevará a pulverizar o no sobre una presión de enfermedad débil o moderada en esta situación. Tener un valor acumulado de 10 puede conducir a una pulverización en la fase 32 de todos modos. La decisión de pulverizar en una fase posterior depende más del clima primaveral. Si somos capaces de acumular los valores de severidad desde el estadio 10 hasta un valor de 6, podemos esperar una presión débil de la enfermedad. Si este valor alcanza 10 podemos esperar una presión moderada de la enfermedad y si este valor alcanza 15 podemos esperar una alta presión de la enfermedad debido a la situación climática.
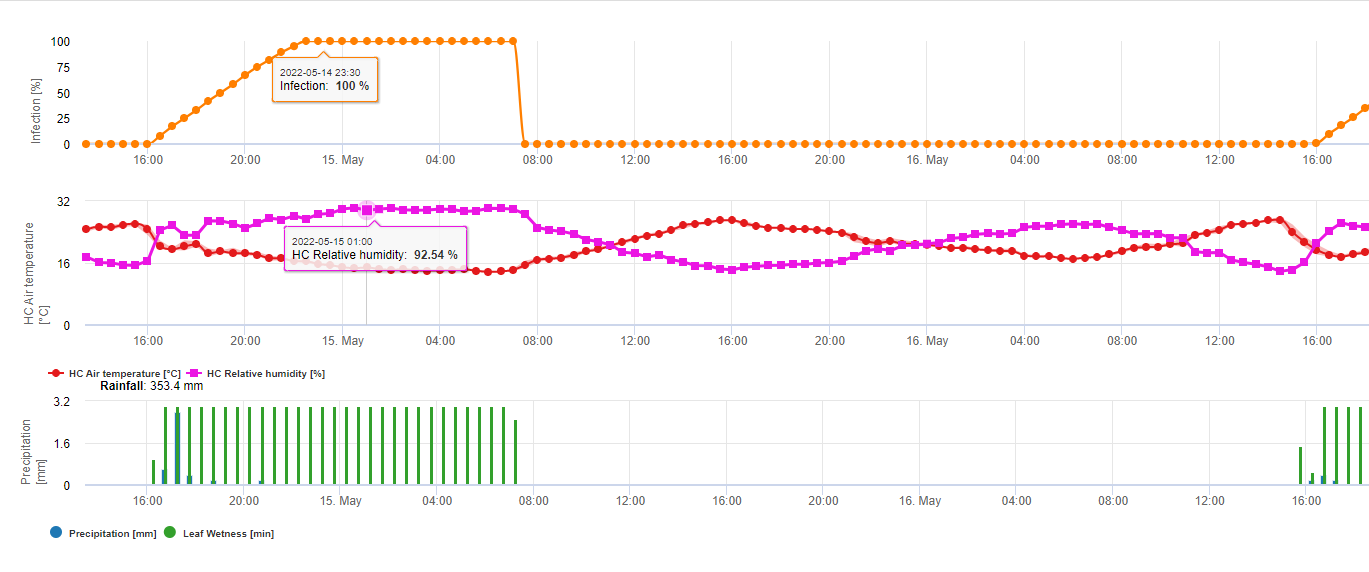
En FieldClimate mostramos el Septoria tritici Severidad junto con las tres diferentes severidades de infección en un gráfico (véase arriba). Debido a las precipitaciones y a los largos periodos de humedad de las hojas, se dan las condiciones para una infección grave por S. tritici han sido campo lleno los días 14 y 16 de mayo. Los niveles de gravedad alcanzan el valor más alto de 5 el 14 de mayo, lo que significa que ahora hay un alto riesgo de infección.
La biología de la infección por Stagonospora nodorum difiere en cierta medida de la de S. tritici, pero esta diferencia no es lo suficientemente grande como para crear un modelo independiente. Por lo tanto, sugerimos utilizar este modelo para todo el complejo de enfermedades causadas por Stagnospora y Septoria en cereales, incluyendo S. passerinii. S. tritici y S. passerinii tienden a necesitar periodos de humectación de la hoja más largos que S. nodorum. En zonas con una alta presión de S. nodorum Las infecciones clasificadas como débiles, con un valor de gravedad de 2, deben tratarse con más seriedad que en otros ámbitos.
Para Septoriosis nodular En FieldClimate se muestra un modelo de riesgo (véase más arriba). Se determinó un riesgo elevado el 17 de junio y el 7 de julio (100%). Dependiendo de la fase de la planta susceptible a la infección, deben tenerse en cuenta las medidas fitosanitarias si el riesgo alcanza los 80% (véase también la previsión meteorológica, protección fitosanitaria). Si el riesgo es de 100% y ya se ha detectado una infección, deben tomarse medidas fitosanitarias sistémicas (aplicación curativa) para proteger la planta.
Explosión de arroz
En los trópicos, las esporas del añublo están presentes en el aire durante todo el año, lo que favorece el desarrollo continuo de la enfermedad. La infección provocada por el hongo daña más al arroz de secano que al de regadío. Rara vez ataca las vainas de las hojas. La infección primaria comienza cuando las semillas se siembran densamente en semilleros para el trasplante mecánico.
En los países templados, se aloja en los residuos de cultivos infestados o en las semillas. Los cielos nublados, las lluvias frecuentes y las lloviznas favorecen el desarrollo y la gravedad del añublo del arroz. Los altos niveles de nitrógeno, la elevada humedad relativa y las hojas húmedas favorecen la infección causada por el hongo. La tasa de esporulación es más alta con el aumento de la humedad relativa de 90% o superior. En cuanto a la humedad de las hojas, la temperatura óptima para la germinación del patógeno es de 25-28 °C. El cultivo de arroz en suelo aeróbico en zonas húmedas donde prevalece el estrés por sequía también favorece la infección.
Un hongo que causa el añublo del arroz. Sus conidióforos se producen en racimos a partir de cada estoma. Raramente son solitarios con 2-4 septos. La zona basal de los conidióforos está hinchada y se estrecha hacia el ápice más claro. Los conidios del hongo miden 20-22 x 10-12 µm. Los conidios son bispados, translúcidos y ligeramente oscurecidos. Son obclavas y se estrechan en el ápice. Son truncadas o se prolongan en un diente corto en la base.
Además de en la planta del arroz, el hongo también sobrevive en Agropyron repens (L.) Gould, Agrostis palustris, A. tenuis, Alopecurus pratensis, Andropogon sp., Anthoxanthum odoratum, Arundo donax L., Avena byzantina, A. sterilis, A. sativa, Brachiaria mutica (Forssk.) Stapf, Bromus catharticus, B. inermis, B. sitchensis, Canna indica, Chikushichloa aquatica, Costus speciosus, Curcuma aromatica, Cynodon dactylon (L.) Pers., Cyperus rotundus L., C. compressus L., Dactylis glomerata, Digitaria sanguinalis (L.) Scop, Echinochloa crus-galli (L.) P. Beauv., Eleusine indica (L.) Gaertn, Eragrostis sp., Eremochloa ophiuroides, Eriochloa villosa, Festuca altaica, F. arundinacea, F. elatior, F. rubra, Fluminea sp., Glyceria leptolepis, Hierochloe odorata, Holcus lanatus, Hordeum vulgare, Hystrix patula, Leersia hexandra Sw., L. japonica, L. oryzoides, Lolium italicum, L. multiflorum, L. perenne, Muhlenbergia sp., Musa sapientum, Oplismenus undulatifolius (Ard.) Roem. & Schult., Panicum miliaceum L., P. ramosum (L.) Stapf, P. repens L., Pennisetum typhoides (L.) R. Br., Phalaris arundinacea L., P. canariensis, Phleum pratense, Poa annua L., P. trivialis, Saccharum officinarum, Secale cereale, Setaria italica (L.) P. Beauv., S. viridis (L.) P. Beauv, Sorghum vulgare, Stenotaphrum secundatum, Triticum aestivum, Zea mays L., Zingiber mioga, Z. officinale y Zizania latifolia..
Las conidias se producen en las lesiones de la planta de arroz unos 6 días después de la inoculación. La producción de esporas aumenta con el incremento de la humedad relativa. La mayoría de las esporas se producen y liberan durante la noche. Tras la germinación de las esporas, se produce la infección. Los tubos de infección se forman a partir de los apresorios y posteriormente de la penetración a través de la cutícula y la epidermis. Tras entrar en la célula, el tubo de infección forma una vesícula para dar lugar a las hifas. En la célula, las hifas crecen libremente.
El añublo del arroz infecta a la planta de arroz en cualquier fase de crecimiento. Las plántulas de arroz o las plantas en la fase de ahijamiento suelen morir por completo. Asimismo, las infecciones graves en las panículas suelen causar pérdidas en el rendimiento del arroz.
Antracnosis
El modelo de R. solani en los campos evalúa el riesgo de esta enfermedad en función de la temperatura, la humedad de las hojas y la radiación global. Los controles duran 120 horas:
- En caso de humedecimiento consecutivo de la hoja acumula valores dependientes de la temperatura por cada minuto.
- 12 °C a 15 °C acumula 1 por minuto
- 16 °C a 17 °C acumula 2 por minuto
- 18°C y más acumula 4 por minuto - Al final de los periodos de humectación de las hojas, evalúa los valores acumulados
- si son superiores a 4096 aumenta el riesgo en 64 puntos y resta 4096 al valor>
- si el residuo es superior a 2048 aumenta el riesgo en 16 y resta 2048 al valor
- Si el residuo es superior a 1024, aumenta el riesgo en 4 y resta 1024 al valor. - Si la radiación global es consecutiva superior a 800 W/m² acumule el tiempo en minutos y si la radiación se vuelve inferior evalúe los valores:
- Valor > 512 = ValorRiesgo - 32 Puntos , Valor - 512
- Valor > 256 = ValorRiesgo - 8 Puntos , Valor - 256
- Valor >128= RisKValue - 2 Puntos, Valor -128
El modelo da como resultado un valor de riesgo entre 0 y 100 que indica los tiempos favorables para R. solani en los campos.
Sistema de apoyo
El modelo señala los periodos de alto riesgo de esta enfermedad. En los periodos en los que el riesgo es bajo, no habrá que aplicar ninguna pulverización. En los periodos con riesgo moderado, el intervalo de pulverización puede prolongarse y, en los periodos con riesgo elevado, puede ser necesario reducir el intervalo de pulverización o utilizar compuestos más eficaces.
Literatura
Enfermedades de la roya
- Anikster, Y., Bushnell, W.R., Eilam, T., Manisterski, J. & Roelfs, A.P. 1997. Puccinia recondita causing leaf rust on cultivated wheats, wild wheats, and rye. Can. J. Bot. 75: 2082-2096.
- Azbukina, Z. 1980. Economical importance of aecial hosts of rust fungi of cereals in the Soviet Far East. En Proc. 5th European and Mediterranean Cereal Rusts Conf. p.199-201. Bari, Roma. Bari, Roma.
- Beresford, R.M. 1982. La roya amarilla (Puccinia striiformis), una nueva enfermedad del trigo en Nueva Zelanda. Cer. 10: 35-41.
- Biffen, R.H. 1905. Mendel's laws of inheritance and wheat breeding. J. Agric. Sci. 1: 4-48.
- Borlaug, N.E. 1954. La producción mexicana de trigo y su papel en la epidemiología de la roya del tallo en Norteamérica. Fitopatología, 44: 398-404.
- Buchenauer, H. 1982. Control químico y biológico de la roya de los cereales. En K.J. Scott & A.K. Chakravorty, eds. The rust fungi, p. 247-279. Londres, Academic Press. Londres, Academic Press.
- Burdon, J.J., Marshall, D.R. & Luig, N.H. 1981. Isozyme analysis indicates that a virulent cereal rust pathogen is somatic hybrid. Nature, 293: 565-566.
- Casulli, F. 1988. Sobreestacionalización de la roya de la hoja del trigo en el sur de Italia. En Proc. 7th European and Mediterranean Cereal Rusts Conf. 5-9 Sept. p. 166-168. Viena. Viena.
- Chester, K.S. 1946. La naturaleza y prevención de las royas de los cereales ejemplificadas en la roya de la hoja del trigo. En Chronica botanica. Walthan, MA, USA. 269 pp.
- Craigie, J.H. 1927. Experiments on sex in rust fungi. Nature, 120: 116-117.
- Cummins, G.B. & Caldwell, R.M. 1956. The validity of binomials in the leaf rust fungus complex of cereals and grasses. Phytopathology, 46: 81-82.
- Cummins, G.B. & Stevenson, J.A. 1956. A check list of North American rust fungi (Uredinales). Plant Dis. Rep. Suppl., 240: 109-193.
- d'Oliveira, B. & Samborski, D.J. 1966. Fase aecial de Puccinia recondita en Ranunculaceae y Boraginaceae en Portugal. En Proc. Cereal Rusts Conf., Cambridge, p 133-150.
- DeBary, A. 1866. Neue Untersuchungen uber die Uredineen insbesondere die Entwicklung der Puccinia graminis und den Zusammenhang duselben mit Aecidium berberis. En Monatsber Preuss. Akad. Wiss., Berlín, p. 15-20.
- de Candolle, A. 1815. Uredo rouille des cereales. En Flora francaise, famille des champignons, p. 83.
- Dubin, H.J. & Stubbs, R.W. 1986. Propagación epidémica de la roya amarilla de la cebada en Sudamérica. Plant Dis, 70: 141-144.
- Dubin, H.J. & Torres, E. 1981. Causas y consecuencias de la epidemia de roya de la hoja del trigo de 1976-1977 en el noroeste de México. Ann. Rev. Phytopath. 19: 41-49.
- Eriksson, J. 1894. Uber die Spezialisierung des Parasitismus bei dem Getreiderostpilzen. Ber. Deut. Bot. Ges. 12: 292-331.
- Eriksson, J. & Henning, E. 1894. Die Hauptresultate einer neuen Untersuchung uber die Getreideroste. Z. Pflanzenkr., 4: 66-73, 140-142, 197-203, 257-262.
- Eriksson, J. & Henning, E. 1896. Die Getreideroste. Ihre Geschichte und Natur sowie Massregein gegen dieselben, p. 463. Estocolmo, P.A. Norstedt y Soner. Estocolmo, P.A. Norstedt y Soner.
- Ezzahiri, B., Diouri, S. & Roelfs, A.P. 1992. The-Role of the alternate host, Anchusa italica, in the epidemiology of Puccinia recondita f. sp. tritici on durum wheats in Morocco. En F.J. Zeller & G. Fischbeck, eds. Proc. 8th European and Mediterranean Cereal Rusts and Mildews Conf., 1992, p. 69-70. Heft 24 Weihenstephan, Alemania.
- Fontana, F. 1932. Observaciones sobre la roya del grano. P.P. Pirone, trad. Clásicos No. 2. Washington, DC, Amer. Phytopathol. Society. (Publicado originalmente en 1767).
- Green, G.J. & Campbell, A.B. 1979. Cultivares de trigo resistentes a Puccinia graminis tritici en el oeste de Canadá: su desarrollo, rendimiento y valor económico. Can. J. Plant Pathol, 1: 3-11.
Groth, J.V. & Roelfs, A.P. 1982. The effect of sexual and asexual reproduction on race abundance in cereal rust fungus populations. Phytopathology, 72: 1503-1507. - Hare, R.A. & McIntosh, R.A. 1979. Genetic and cytogenetic studies of the durable adult plant resistance in 'Hope' and related cultivars to wheat rusts. Z. Pflanzenzüchtg, 83: 350-367.
- Hart, H. & Becker, H. 1939. Beitrage zur Frage des Zwischenwirts fur Puccinia glumarum Z. Pflanzenkr. (Pflanzenpathol.) Pflanzenschutz, 49: 559-566.
- Hendrix, J.W., Burleigh, J.R. & Tu, J.C. 1965. Oversummering of stripe rust at high elevations in the Pacific Northwest-1963. Plant Dis. Rep., 49: 275-278.
- Hermansen, J.E. 1968. Studies on the spread and survival of cereal rust and mildew diseases in Denmark. Contrib. No. 87. Copenhagen, Department of Plant Pathology, Royal Vet. Copenhague, Department of Plant Pathology, Royal Vet. Agriculture College. 206 pp.
- Hirst, J.M. & Hurst, G.W. 1967. Transporte de esporas a larga distancia. En P.H. Gregory & J.L. Monteith, eds. Airborne microbes, p. 307-344. Cambridge University Press. Cambridge University Press.
- Hogg, W.H., Hounam, C.E., Mallik, A.K. & Zadoks, J.C. 1969. Factores meteorológicos que afectan a la epidemiología de las royas del trigo. WMO Tech. Note No. 99. 143 pp.
- Huerta-Espino, J. & Roelfs, A.P. 1989. Especialización fisiológica de la roya de la hoja en trigo duro. Phytopathology, 79: 1218 (abstr.).
- Hylander, N., Jorstad, I. & Nannfeldt, J.A. 1953. Enumeratio uredionearum Scandinavicarum. Opera Bot. 1: 1-102.
- Johnson, R. 1981. Resistencia duradera a las enfermedades. En J.F. Jenkyn & R.T. Plumb, eds. Strategies for control of cereal diseases, p. 55-63. Oxford, Reino Unido, Blackwell. Oxford, Reino Unido, Blackwell.
- Johnson, T. 1949. Cruces intervarietales en Puccinia graminis. Can. J. Res. Sect. C, 27: 45-63.
- Joshi, L.M. & Palmer, L.T. 1973. Epidemiology of stem, leaf, and stripe rusts of wheat in northern India. Plant Dis. Rep., 57: 8-12.
- Katsuya, K. & Green, G.J. 1967. Reproductive potentials of races 15B and 56 of wheat stem rust. Can. J. Bot. 45: 1077-1091.
- Kilpatrick, R.A. 1975. Nuevos cultivares de trigo y longevidad de la resistencia a la roya, 1971-1975. USDA, Agric. Res. Serv. Northeast Reg (Rep.), ARS-NE 64. 20 pp.
- Le Roux, J. & Rijkenberg, F.H.J. 1987. Pathotypes of Puccinia graminis f. sp. tritici with increased virulence for Sr24. Plant Dis, 71: 1115-1119.
- Lewellen, R.T., Sharp, E.L. & Hehn, E.R. 1967. Major and minor genes in wheat for resistance to Puccinia striiformis and their response to temperature changes. Can. J. Bot. 45: 2155-2172.
- Line, R.F. 1976. Factores que contribuyeron a una epidemia de roya amarilla del trigo en el valle de Sacramento, California, en 1974. Plant Dis. Rep., 60: 312-316.
- Line, R.F., Qayoum, A. & Milus, E. 1983. Durable resistance to stripe rust of wheat. En Proc. 4th Int. Cong. Plant Pathol. p. 204. Melbourne. Melbourne.
- Luig, N.H. 1985. Epidemiología en Australia y Nueva Zelanda. En A.P. Roelfs & W.R. Bushnell, eds. Cereal rusts, vol. 2, Diseases, distribution, epidemiology, and control, p. 301-328. Orlando, FL, USA, Academic Press. Orlando, FL, EE.UU., Academic Press.
- Luig, N.H. & Rajaram, S. 1972. The effect of temperature and genetic background on host gene expression and interaction to Puccinia graminis tritici. Phytopathology, 62: 1171-1174.
- Luig, N.H. & Watson, I.A. 1972. The role of wild and cultivated grasses in the hybridization of formae speciales of Puccinia graminis. Aust. J. Biol. Sci. 25: 335-342.
- Maddison, A.C. & Manners, J.G. 1972. Sunlight and viability of cereal rust urediospores. Trans. Br. Mycol. Soc., 59: 429-443.
- Mains, E.B. 1932. Host specialization in the leaf rust of grasses Puccinia rubigovera. Mich. Acad. Sci. 17: 289-394.
- Mains, E.B. 1933. Studies concerning heteroecious rust. Mycologia, 25: 407-417.
- Mains, E.B. & Jackson, H.S. 1926. Especialización fisiológica en la roya de la hoja del trigo, Puccinia triticina Erikss. Phytopathology, 16: 89-120.
- Manners, J.G. 1960. Puccinia striiformis Westend. var. dactylidis var. nov. Trans. Br. Mycol. Soc., 43: 65-68.
- McIntosh, R.A. 1976. Genetics of wheat and wheat rusts since Farrer: Farrer memorial oration 1976. J. Aust. Aust. Sci. 42: 203-216.
- McIntosh, R.A. 1992. Close genetic linkage of genes conferring adult-plant resistance to leaf rust and stripe rust in wheat. Plant Pathol, 41: 523-527.
- McIntosh, R.A., Luig, N.H., Milne, D.L. & Cusick, J. 1983. Vulnerability of triticales to wheat stem rust. Can. J. Plant Pathol. 5: 61-69.
- McIntosh, R.A., Hart, G.E., Devos, K.M., Gale, M.D. & Rogers, W.J. 1998. Catalogue of gene symbols for wheat. En Proc. 9th Int. Wheat Genetics Symp., 2-7 ago. 1998. Saskatoon Saskatchewan, Canadá.
- Melander, L.W. & Craigie, J.H. 1927. Nature of resistance of Berberis spp. to Puccinia graminis. Phytopathology, 17: 95-114.
- Mont, R.M. 1970. Estudios de resistencia inespecífica a la roya del tallo en trigo de primavera. M.Sc. thesis. St Paul, MN, USA, Universidad de Minnesota. 61 pp.
- Nagarajan, S. & Joshi, L.M. 1985. Epidemiología en el subcontinente indio. En A.P. Roelfs & W.R. Bushnell, eds. The cereal rusts, vol. 2, Diseases, distribution, epidemiology, and control, p. 371-402. Orlando, FL, USA, academic Press. Orlando, FL, EE.UU., academic Press.
- O'Brien, L., Brown, J.S., Young, R.M. & Pascoe, T. 1980. Occurrence and distribution of wheat stripe rust in Victoria and susceptibility of commercial wheat cultivars. Aust. Plant Pathol. Soc. Newsl., 9: 14.
- Pérez, B. & Roelfs, A.P. 1989. Resistencia a la roya de la hoja del trigo de cultivares terrestres y sus derivados. Phytopathology, 79: 1183 (abstr.).
- Pretorius, Z.A., Singh, R.P., Wagoire, W.W. & Payne, T.S. 2000. Detection of virulence to wheat stem rust resistance gene Sr31 in Puccinia graminis f. sp. tritici in Uganda. Phytopathology, 84: 203.
- Rajaram, S., Singh, R.P. & van Ginkel, M. 1996. Approaches to breed wheat for wide adaptation, rust resistance and drought. En R.A. Richards, C.W. Wrigley, H.M. Rawson, G.J. Rebetzke, J.L. Davidson & R.I.S. Brettell, eds. Proc. 8th Assembly Wheat Breeding Society of Australia, p. 2-30. Canberra, The Australian National University. Canberra, Universidad Nacional Australiana.
- Rapilly, F. 1979. Epidemiología de la roya amarilla. Ann. Rev. Phytopathol. 17: 5973.
- Robbelen, G. & Sharp, E.L. 1978. Modo de herencia, interacción y aplicación de genes que condicionan la resistencia a la roya amarilla. Fortschr. Pflanzenzucht. Beih. Z. Pflanzenzucht., 9: 1-88.
- Roelfs, A.P. 1978. Estimación de las pérdidas causadas por la roya en cereales de grano pequeño en Estados Unidos 1918-1976. Misc. Publ. USDA, 1363: 1-85.
Roelfs, A.P. 1982. Efectos de la erradicación del agracejo sobre la roya del tallo en Estados Unidos. Plant Dis., 66: 177-181. - Roelfs, A.P. 1985a. Epidemiología en Norteamérica. En A.P. Roelfs & W.R. Bushnell, eds. The cereal rusts, vol. 2, Diseases, distribution, epidemiology, and control, p. 403-434. Orlando, FL, USA, Academic Press. Orlando, FL, EE.UU., Academic Press.
- Roelfs, A.P. 1985b. Wheat and rye stem rust. En A.P. Roelfs & W.R. Bushnell, eds. The cereal rusts, vol. 2, Diseases, distribution, epidemiology, and control, p. 3-37. Orlando, FL, USA, Academic Press. Orlando, FL, EE.UU., Academic Press.
- Roelfs, A.P. 1986. Development and impact of regional cereal rust epidemics. En K.J. Leonard & W.E. Fry, eds. Plant disease epidemiology, vol. 1, p. 129-150. New York, NY, USA, MacMillan. Nueva York, NY, EE.UU., MacMillan.
- Roelfs, A.P. 1988. Genetic control of phenotypes in wheat stem rust. Ann. Rev. Phytopathol. 26: 351-367.
- Roelfs, A.P. & Groth, J.V. 1980. A comparison of virulence phenotypes in wheat stem rust populations reproducing sexually and asexually. Phytopathology, 70: 855-862.
- Roelfs, A.P. & Groth, J.V. 1988. Puccinia graminis f. sp. tritici, black stem rust of Triticum spp. In G.S. Sidhu, ed., Advances in plant pathology, vol. 6, Genetics of pathogenic fungi, p. 345-361. Advances in plant pathology, vol. 6, Genetics of pathogenic fungi, p. 345-361. Londres, Academic Press. Londres, Academic Press.
- Roelfs, A.P. & Long, D.L. 1987. Desarrollo de Puccinia graminis en Norteamérica durante 1986. Plant Dis, 71: 1089-1093.
- Roelfs, A.P. & Martell, L.B. 1984. Ure-dospore dispersal from a point source within a wheat canopy. Phytopathology, 74: 1262-1267.
- Roelfs, A.P., Huerta-Espino, J. & Marshall, D. 1992. La roya amarilla de la cebada en Texas. Plant Dis, 76: 538.
- Rowell, J.B. 1981. Relation of postpenetration events in Idaed 59 wheat seedling to low receptivity to infection by Puccinia graminis f. sp. tritici. Phytopathology, 71: 732-736.
- Rowell, J.B. 1982. Control of wheat stem rust by low receptivity to infection conditioned by a single dominant gene. Phytopathology, 72: 297-299.
- Rowell, J.B. 1984. Infección controlada por Puccinia graminis f. sp. tritici en condiciones artificiales. En. A.P. Roelfs & W.R. Bushnell, eds. The cereal rusts, vol. 1, Origins, specificity, structure, and physiology, p. 291-332. Orlando, FL, USA, Academic Press. Orlando, FL, USA, Academic Press.
- Saari, E.E. & Prescott, J.M. 1985. Distribución mundial en relación con las pérdidas económicas. En A.P. Roelfs & W.R. Bushnell, eds. The cereal rusts, vol. 2, Diseases, distribution, epidemiology, and control, p. 259-298. Orlando, FL, USA, Academic Press. Orlando, FL, EE.UU., Academic Press.
Saari, E.E., Young, H.C., Jr. & Fernkamp, M.F. 1968. Infection of North American Thalictrum spp. with Puccinia recondita f. sp. tritici. Fitopatología, 58: 939-943. - Samborski, D.J. 1985. Wheat leaf rust. En A.P. Roelfs y W.R. Bushnell, eds. The cereal rusts, vol. 2, Diseases, distribution, epidemiology, and control, p. 39-59. Orlando, FL, USA, Academic Press. Orlando, FL, USA, Academic Press.
- Savile, D.B.O. 1984. Taxonomy of the cereal rust fungi. En W.R. Bushnell & A.P. Roelfs, eds. The cereal rusts, vol. 1, Origins, specificity, structures, and physiology, p. 79-112. Orlando, FL, USA, Academic Press. Orlando, FL, EE.UU., Academic Press.
- Sharp, E.L. & Volin, R.B. 1970. Additive genes in wheat conditioning resistance to stripe rust. Phytopathology, 601: 1146-1147.
- Singh, R.P. 1992. Genetic association of leaf rust resistance gene Lr34 with adult plant resistance to stripe rust in bread wheat. Phytopathology, 82: 835-838.
- Singh, R.P. & Rajaram, S. 1992. Genetics of adult-plant resistance to leaf rust in "Frontana" and three CIMMYT wheats. Genome, 35: 24-31.
- Singh, R.P. & Rajaram, S. 1994. Genetics of adult plant resistance to stripe rust in ten spring bread wheats. Euphytica, 72: 1-7.
- Singh, R.P., Mujeeb-Kazi, A. & Huerta-Espino, J. 1998. Lr46: A gene conferring slow-rusting resistance to leaf rust in wheat. Phytopathology, 88: 890-894.
- Skovmand, B., Fox, P.N. & Villareal, R.L. 1984. Triticale in commercial agriculture: progress and promise. Adv. Agron. 37: 1-45.
- Spehar, V. 1975. Epidemiología de la roya del trigo en Europa. En Proc. 2nd Int. Winter Wheat Conf., 9-19 de junio, p. 435-440. Zagreb, Yugoslavia. Zagreb, Yugoslavia.
- Stakman, E.C. 1923. Enfermedades del trigo. 14. El problema de la roya del trigo en los Estados Unidos. En Proc. 1st Pan Pac. Sci. Congr., p. 88-96.
- Straib, W. 1937. Untersuchungen uben dasn Vorkommen physiologischen Rassen der Gelbrostes (Puccinia glumarum) in den Jahren 1935-1936 und uber die Agressivitat eninger neuer Formes auf Getreide un Grasern. Arb. Biol. Reichsant. Land. Fortw. Berlin-Dahlem, 22: 91-119.
- Stubbs, R.W. 1985. La roya amarilla. En A.P. Roelfs & W.R. Bushnell, eds. The cereal rusts, vol. 2, Diseases, distribution, epidemiology, and control, p. 61-101. Orlando, FL, USA, Academic Press. Orlando, FL, USA, Academic Press.
- Stubbs, R.W. & de Bruin, T. 1970. Bestrijding van gele roest met het systemische fungicide oxycaroxin 'Plantvax'. Gewasbescherming, 1: 99-104.
- Stubbs, R.W., Prescott, J.M., Saari, E.E. & Dubin, H.J. 1986. Manual de metodología de enfermedades de los cereales, p. 46. México, DF, CIMMYT. México, DF, CIMMYT.
- Sunderwirth, S.D. & Roelfs, A.P. 1980. Greenhouse evaluation of the adult plant resistance of Sr2 to wheat stem rust. Phytopathology, 70: 634-637.
- Tollenaar, H. & Houston, B.R. 1967. A study on the epidemiology of stripe rust, Puccinia striiformis West in California. Can. J. Bot. 45: 291-307.
- Tozzetti, G.T. 1952. V. Alimurgia: Verdadera naturaleza, causas y tristes efectos de las royas, los juanetes, los tizones y otras enfermedades del trigo y de la avena en el campo. En L.R. Tehon, trad. Phytopathological Classics No. 9, p. 139. St Paul, MN, USA. St Paul, MN, USA, American Phytopathol. Society. (Publicado originalmente en 1767).
- Tranzschel, W. 1934. Promezutocnye chozjaeva rzavwiny chlebov i ich der USSR. (Los huéspedes alternativos de los hongos de la roya de los cereales y su distribución en la URSS). En Bull. Plant Prot., Ser. 2, p. 4-40. (En ruso con resumen en alemán).
- Viennot-Bourgin, G. 1934. La rouille jaune der graminees. Ann. Ec. Natl. Agric. Grignon Ser., 3, 2: 129-217.
- Wallwork, H. & Johnson, R. 1984. Transgressive separation for resistance to yellow rust in wheat. Euphytica, 33: 123-132.
- Watson, I.A. & de Sousa, C.N.A. 1983. Transporte a larga distancia de esporas de Puccinia graminis tritici en el hemisferio sur. En Proc. Linn. Soc. N.S.W., 106: 311-321.
- Wright, R.G. & Lennard, J.H. 1980. Origen de una nueva raza de Puccinia striiformis. Trans. Br. Mycol. Soc., 74: 283-287.
- Zadoks, J.C. 1961. Yellow rust on wheat studies of epidemiology and physiologic specialization. Neth. J. Plant Pathol, 67: 69-256.
- Zadoks, J.C. & Bouwman, J.J. 1985. Epidemiology in Europe. En A.P. Roelfs & W.R. Bushnell, eds. The cereal rots , vol. 2, Diseases, distribution, epidemiology, and control , p. 329-369. Orlando, FL, USA, Academic Press. Orlando, FL, USA, Academic Press
Tizón de la cabeza por Fusarium
- Baht, C.V., Beedu, R., Ramakrishna, Y. & Munshi, R.L. 1989. Outbreak of trichothecene toxicosis associated with consumption of mould-damaged wheat products in Kashmir Valley, India. Lancet, p. 35-37.
- Bai, G. 1995. Sarna del trigo: epidemiología, herencia de la resistencia y marcadores moleculares ligados a la resistencia de los cultivares. Ph.D. thesis. West Lafayette, IN, USA, Purdue University.
- Chen, P., Liu, D. & Sun, W. 1997. New countermeasures of breeding wheat for scab resistance. En H.J. Dubin, L. Gilchrist, J. Reeves & A. McNab, eds. Fusarium head scab: global status and future prospects. México, DF, CIMMYT.
- Diaz de Ackermann, M. & Kohli, M.M. 1997. Research on fusarium head blight of wheat in Uruguay. En H.J. Dubin, L. Gilchrist, J. Reeves & A. McNab, eds. Fusarium head scab: global status and future prospects. México, DF, CIMMYT.
- Dill-Macky, R. 1997. Fusarium head blight: Recent epidemics and research efforts in the upper midwest of United States. En H.J. Dubin, L. Gilchrist, J. Reeves & A. McNab, eds. Fusarium head scab: global status and future prospects. México, DF, CIMMYT.
- Dubin, H.J., Gilchrist, L., Reeves, J. & McNab?, A. 1997. Fusarium head scab: global status and future prospects. México, DF, CIMMYT.
- Galich, M.T.V. 1997. Fusarium head blight in Argentina. En H.J. Dubin, L. Gilchrist, J. Reeves & A. McNab, eds. Fusarium head scab: global status and future prospects. México, DF, CIMMYT.
- Gilchrist, L., Rajaram, S., Mujeeb-Kazi?, A., van Ginkel, M.,Vivar, H. & Pfeiffer, W. 1997. En H.J. Dubin, L. Gilchrist, J. Reeves & A. McNab, eds. Fusarium head scab: global status and future prospects. México, DF, CIMMYT.
- Ireta, J. 1989. Selección de un modelo de crecimiento para la fusariosis del trigo causada por Fusarium graminearum Schw. En M.M. Kohli, ed. Taller sobre la Fusariosis de la espiga en America del Sur. México, DF, CIMMYT.
- Ireta, M.J. & Gilchrist, L. 1994. Fusarium head scab of wheat (Fusarium graminearum Schwabe). Informe Especial de Trigo No. 21b. México, DF, CIMMYT.
- Khonga, E.B. & Sutton, J.C. 1988. Inoculum production and survival of Giberella zeae in maize and wheat residues. Can. J. Plant Pathol. 10(3): 232-240.
- Luo, X.Y. 1988. Fusarium toxin contamination in China. Proc. Japan Assoc. Mycotoxicology Suppl., 1: 97-98. Marasas, W.F.O., Jaskiewickz, K., Venter, F.S. & Schalkwyk, D.J. 1988. Fusarium moniliforme contamination of maize in oesophageal cancer areas in Transkei. S. AF. Med. J., 74: 110-114.
- Mihuta-Grimm, L. & Foster, R.L. 1989. Scab on wheat and barley in southern Idaho and evaluation of seed treatment for eradication of Fusarium spp. Plant Dis., 73: 769-771.
- Miller, J.D. & Armison, P.G. 1986. Degradation of deoxynivalenol by suspension cultures of the Fusarium head blight resistant wheat cultivar Frontana. Can. J. Plant Pathol. 8: 147-150.
- Miller, J.D., Young, J.C. & Sampson, D.R. 1985. Deoxynivalenol and Fusarium head blight resistance in spring cereals. J. Phytopathol, 113: 359-367.
- Reis, E.M. 1985. Doencas do trigo III. Fusariose. Brasil, Merck Sharp Dohme.
- Reis, E.M. 1989. Fusariosis: biologia y epidemiologia de Gibberella zeae en trigo. En M.M. Kohli, ed. Taller sobre la Fusariosis de la espiga en América del Sur. México, DF, CIMMYT.
- Schroeder, H.W. & Christensen, J.J. 1963. Factores que afectan la resistencia del trigo a la sarna causada por Gibberella zeae. Phytopathology, 53: 831-838.
- Snidjers, C.H.A. 1989. Current status of breeding wheat for Fusarium head blight resistant and mycotoxin problem in the Netherlands. Foundation of Agricultural Plant Breeding, Wageningen. En M.M. Kohli, ed. Taller sobre la Fusariosis de la espiga en América del Sur. México, DF, CIMMYT.
- Snijders, C.H.A. 1990. The inheritance of resistance to head blight caused by Fusarium culmorum in winter wheat Euphytica, 50: 11-18.
- Teich, A.H. & Nelson, K. 1984. Survey of Fusarium head blight and possible effects of cultural practices in wheats fields in Lambton County in 1983. Can. Plant Dis. Surv., 64(1): 11-13.
- Trenholm, H.L., Friend, D.H. & Hamilton, R.M.G. 1984. Vomitoxin and zearalenone in animal feed. Publicación 1745 E del Ministerio de Agricultura de Canadá.
- Van Egmond, H.P. & Dekker, W.H. 1995. Normativa mundial sobre micotoxinas en 1994. Nat. Toxins, 3: 332.
- Viedma, L. 1989. Importancia y distribucion de la fusariosis de trigo en Paraguay. En M.M. Kohli, ed. Taller sobre la Fusariosis de la espiga en America del Sur. México, DF, CIMMYT.
- Wang, Y.Z. 1997. Epidemiology and management of wheat scab in China En H.J. Dubin, L. Gilchrist, J. Reeves & A. McNab, eds. Fusarium head scab: global status and future prospects. México, DF, CIMMYT.
- Wang, Y.Z. & Miller, J.D. 1988. Effects of metabolites on wheat tissue in relation to Fusarium head blight resistance. J. Phytopathol, 122: 118-125.
Tizón de la cabeza por Fusarium
- Infektion und Ausbreitung von Fusarium spp. an Weizen in Abhängigkeit der Anbaubedingungen im Rheinland, Lienemann, K.
- E.-C. Oerke und H.-W. Dehne
Efectos de la actividad del agua, la temperatura y el pH en el crecimiento de aislados de Fusarium moniliforme y Fusarium proliferatum del maíz, Sonia Marin, Vicente Sanchis y Naresh Magan - Interacción de Fusarium graminearum y F. moniliforme en mazorcas de maíz: progreso de la enfermedad, biomasa fúngica y acumulación de micotoxinas, L. M. Reid, R. W. Nicol, T. Ouellet, M. Savard, J. D. Miller, J. C. Young, D. W. Stewart y A. W. Schaafsma.
- Evaluierung von Einflussfaktoren auf den Fusarium-Ährenbefall des Weizens, Wolf, P. F. J.; Schempp, H.; Verreet, J.-A.
Septoria spp.
- Baker, C.J. 1971. Morfología de la infección de plántulas por Leptosphaeria nodorum. Trans. Brit. Mycol. Soc. 56:306-309.
- Baker, C.J. 1969. Estudios sobre Leptosphaeria nodorum Müller y Septoria tritici Desm. en el trigo. Tesis doctoral. Universidad de Exeter.
- Baker E.A., y Smith, I.M. 1978. Desarrollo de las reacciones resistentes y susceptibles en el trigo a la inoculación con Septoria nodorum. Trans. Brit. Mycol. Soc. 71:475-482.
- Benedict, W.G. 1971. Differential effect of light intensity on the infection of wheat by Septoria tritici Desm. under controlled environmental conditions. Physiol. Pl. Pathol. 1:55-56.
- Bird, P.M., y Ride, J.P. 1981. The resistance of wheat to Septoria nodorum: fungal development in relation to host lignification. Physiol. Pl. Pathol. 19:289-299.
- Patógenos Stagonospora y Septoria de los cereales: The Infection Process 45 Bethenod, O., Bousquet, J., Laffray, D., and Louguet, P. 1982. Reexamen des modalités d'action de l'ochracine sur la conductance stomatique des feuilles de plantules de blé, Triticum aestivum L., cv "Etoile de Choisy".Agronomie 2:99-102.
- Bousquet, J.F., y Kollman, A. 1998. Variation in metabolite production by Septoria nodorum isolates adapted to wheat or to barley. J. Phytopathol. 146:273-277.
- Bousquet, J.F., Belhomme de Franqueville, H., Kollmann, A., y Fritz, R. 1980. Action de la septorine, phytotoxine synthétisée par Septoria nodorum, sur la phosphorylation oxydative dans les mitochondries isolées de coléoptiles de blé. Can. J. Bot. 58:2575-2580.
- Brennan, R.M., Fitt, B.D.L., Colhoun, J., y Taylor, G.S. 1986. Factors affecting the germination of Septoria nodorum pycnidiospores. J. Phytopathol. 117:49-53.
- Brönnimann, A., Sally, B.K., y Sharp, E.L. 1972. Investigaciones sobre Septoria nodorum en trigo de primavera en Montana. Plant Dis. Reptr. 56:188-191.
- Cohen, L., y Eyal, Z. 1993. The histology of processes associated with the infection of resistant and susceptible wheat cultivars with Septoria tritici. Plant Pathol. 42:737-743.
- Cunfer, B.M. 1983. Epidemiología y control de Septoria nodorum transmitida por semillas. Seed Sci. Tecnol. 11:707- 718.
- Essad, S., y Bousquet, J.F. 1981. Action de l'ochracine, phytotoxine de Septoria nodorum Berk., sur le cycle mitotique de Triticum aestivum L. Agronomie 1:689-694.
- Eyal, Z., Scharen, A.L., Prescott, J.M., y van Ginkel, M. 1987. Las enfermedades Septoria del trigo: Concepts and methods of disease management. CIMMYT. México D.F. 46 pp.
- Fernandes, J.M.C., y Hendrix, J.W. 1986a. Viability of conidia of Septoria nodorum exposed to natural conditions in Washington. Fitopathol. Bras. 11:705-710.
- Fernandes, J.M.C., y Hendrix, J.W. 1986b. Efectos de la humedad de la hoja y de la temperatura sobre el crecimiento hifal y el desarrollo de síntomas en hojas de trigo infectadas por Septoria nodorum. Fitopathol. Bras. 11:835-845.
- Fournet, J. 1969. Properiétés et role du cirrhe du Septoria nodorum Berk. Ann. Phytopathol. 1:87-94. Fournet, J., Pauvert, P., y Rapilly, F. 1970. Propriétés des gelées sporifères de quelques Sphaeropsidales et Melanconiales. Ann. Phytopathol. 2:31-41.
- Gough, F.J., y Lee, T.S. 1985. Moisture effects on the discharge and survival of conidia of Septoria tritici. Phytopathology 75:180-182.
- Green, G.J., y Dickson, J.G. 1957. Pathological histology and varietal reactions in Septoria leaf blotch of barley. Phytopathology 47:73-79.
- Griffiths, E., y Peverett, H. 1980. Effects of humidity and cirrhus extract on survival of Septoria nodorum spores. Trans. Brit. Mycol. Soc. 75:147-150.
- Harrower, K.M. 1976. Función de los cirros en Leptosphaeria nodorum. APPS Newsletter 5:20-21.
- Hilu, H.M., y Bever, W.M. 1957. Inoculation, oversummering, and suscept-pathogen relationship of on Triticum species. Phytopathology 47:474-480.
- Holmes, S.J.I., y Colhoun, J. 1974. Infection of wheat by Septoria nodorum and S. tritici. Trans. Brit. Mycol. Soc. 63:329-338.
- Jenkins, P.D. 1978. Interacción en las enfermedades de los cereales. Tesis doctoral. Universidad de Gales.
- Karjalainen, R., y Lounatmaa, K. 1986. Ultrastructure of penetration and colonization of wheat leaves by Septoria nodorum. Physiol. Mol. Pl. Pathol. 29:263-270.
- Kema, G.H.J., DaZhao, Y., Rijkenberg, F.H.J., Shaw, M.W., y Baayen, R.P. 1996. Histología de la patogénesis de Mycosphaerella graminicola en trigo. Phytopathology 86:777-786.
- Keon, J.P.R., y Hargreaves, J.A. 1984. The response of barley leaf epidermal cells to infection by Septoria nodorum. New Phytol. 98:387-398.
- King, J.E., Cook, R.J., y Melville, S.C. 1983. A review of Septoriadiseases of wheat and barley. Ann.Appl. Biol. 103:345-373.
- Krupinsky, J.M., Scharen, A.L., y Schillinger, J.A. 1973. Pathogen variation in Septoria nodorum Berk, in relation to organ specificity, apparent photosynthetic rate and yield of wheat. Physiol. Pl. Pathol. 3:187-194.
- Lehtinen, U. 1993. Plant cell wall degrading enzymes of Septoria nodorum. Physiol. Mol. Pl. Pathol. 43:121-134.
- Magro, P. 1984. Production of polysacchride-degrading enzymes in culture and during pathogenesis. Plant Sci. Letters 37:63-68.
- Morgan, W.M. 1974. Estudios fisiológicos de enfermedades del trigo causadas por Septoria spp. y Fusarium culmorum. Ph. D. thesis. University of London.
- O'Reilly, P., y Downes, M.J. 1986. Forma de supervivencia de Septoria nodorum en trigo de invierno asintomático. Trans. Brit. Mycol. Soc. 86:381-385.
- Rapilly, F., Foucault, B., y Lacazedieux, J. 1973. Études sur l'inoculum de Septoria nodorum Berk. (Leptosphaeria nodorum Müller) agent de la septoriose du blé I. Les ascospores. Ann. Phytopathol. 5:131-141.
- Rasanayagam, M.S., Paul, N.D., Royle, D.J., y Ayres, P.G. 1995. Variation in responses of Septoria tritici and S. nodorum to UV-B irradiation in vitro. Mycol. Res. 99:1371-1377.
- Shipton, W.A., Boyd, W.R.J., Rosielle, A.A., y Shearer, B.L. 1971. Las enfermedades comunes del trigo por Septoria. Bot. Rev. 37:231-262.
- Straley, M. L. 1979. Pathogenesis of Septoria nodorum (Berk.) Berk. On wheat cultivars varying in resistance to glume blotch. Ph. D. thesis. Montana State University. 99 pp.
- Straley, M.L., y Scharen, A.L. 1979. Desarrollo de Septoria nodorum en hojas de trigo resistentes y susceptibles. Phytopathology 69:920-921.
- Weber, G.F. 1922. Enfermedades por Septoria de los cereales. Fitopatología 12:537-585.
- Babadoost, M. & Herbert, T.T. 1984. Factors affecting infection of wheat seedlings by Septoria nodorum. Phytopathology, 74: 592-595.
- Eyal, Z.E. 1981. Control integrado de las enfermedades por Septoria del trigo. Plant Dis., 65: 763-768.
- Eyal, Z., Sharen, A.L., Prescott, J.M. & van Ginkel, M. 1987. Las enfermedades Septoria del trigo: conceptos y métodos de manejo de enfermedades. México, DF, CIMMYT.
- Polley, R.W. & Thomas, M.R. 1991. Surveys of disease of wheat in England and Wales, 1976-1988. Ann. Appl. Biol. 119: 1-20.
- Henze, Mathias: Entwicklung einer anbauparameter- und witterunsabhängigen Befallsprognose von Septoria tritici, CUVILLER VERLAG, Göttingen 2008
- B.M. Cunfer: Stagonospora and Septoria Pathogens of Cereals: The Infection Process, en Septoria and Stagonospora Diseases of Cereals: A Compilation of Global Research, M. van Ginkel, A. McNab, and J. Krupinsky editors, Proceedings of the Fifth International Septoria Workshop September 20-24, 1999, CIMMYT, México.
Equipamiento recomendado
Compruebe qué conjunto de sensores se necesita para vigilar las posibles enfermedades de este cultivo.