Girasol modelos de enfermedad
Mildiú velloso
El hongo causante del mildiu en los girasoles se conoce con los nombres de Plasmopara halstedii o Plasmopara helianthi. El complejo fúngico patógeno infecta a una amplia gama de géneros de la familia Asteraceae, incluidas especies silvestres y cultivadas de Helianthus. La enfermedad está presente allí donde se cultivan girasoles.
Ciclo de vida
Partiendo de una sola oospora que germina y da lugar a un zoosporangio, la diferenciación y liberación de las zoosporas son las etapas posteriores del desarrollo. En presencia de agua libre, las zoosporas se desplazan pronto a los lugares de infección (raíz, hipocótilo) si están disponibles. Tras el enquistamiento y la elongación del tubo germinal (este último suele terminar en un apresorio contra una célula huésped), el hongo desarrolla una estructura de infección (clavija de infección) para la penetración directa. En condiciones experimentales, se demostró que los tubos germinales no suelen formar apresorios en agua, pero sí lo hacen en presencia de células huésped (Gray et al., 1985). Tras la penetración, el hongo crece intracelularmente y luego intercelularmente, y una vez establecido en un huésped susceptible (compatible) comienza a colonizar sistémicamente toda la planta creciendo preferentemente hacia el ápice del brote y, en menor medida, en dirección a la raíz. Cuando las condiciones son favorables, la esporulación asexual tiene lugar en las hojas afectadas y ocasionalmente en los tejidos subterráneos. Los esporangios completamente desarrollados se diseminan por el viento y, dado que son efímeros y sensibles a la sequía y a la luz solar directa, su supervivencia depende de la situación meteorológica del momento. También se producen oosporas en las partes infectadas de la planta, principalmente en la raíz y en los tejidos inferiores del tallo, mientras que las hojas y las partes superiores de la planta, excepto las semillas, están libres de estas esporas en reposo (Sackston, 1981; Virányi, 1988; Onan y Onogur, 1991). La etapa más susceptible del desarrollo del hospedador es entre la germinación y la emergencia (Meliala et al. 2000).
Supervivencia y fuente de inóculo
Con respecto a la infección primaria, P. halstedii es un patógeno transmitido por el suelo. Sus oosporas sirven como inóculo primario en los tejidos subterráneos de las plántulas jóvenes de girasol. También puede ser transmitido por el viento, causando una infección secundaria de hojas y/o inflorescencias. En este último caso, el hongo también puede ser transmitido por las semillas: las semillas afectadas transportan internamente el micelio y/o las oosporas. Las oosporas se desarrollan principalmente en la raíz y en los tejidos inferiores del tallo de las plantas afectadas por el mildiu, con o sin síntomas visibles y, con los residuos vegetales del cultivo de girasol precedente, llegan al suelo. Las oosporas son longevas y pueden sobrevivir durante al menos 6-8 años (Sackston, 1981; Virányi, 1988). En general, se cree que las oosporas germinan principalmente en condiciones húmedas. Sin embargo, hasta ahora sólo se dispone de unos pocos resultados sobre la dinámica de germinación. Se demostró que un choque de baja temperatura previo a la humedad y la presencia de exudados del huésped liberados por las raíces mejoran el proceso de germinación (Delanoe, 1972). En otro informe (Spring & Zipper 2000), no se pudieron observar tales efectos de la temperatura y se informó de que las oosporas recién desarrolladas germinaban espontáneamente en agua en un periodo de 10-30 días, pero a una tasa muy variable (1-17%).
Sin embargo, la infección secundaria se considera un factor importante en la propagación de la enfermedad en determinadas regiones en condiciones ambientales favorables. Aparte de que la infección secundaria de la inflorescencia puede dar lugar a una infección latente de las semillas por P. halstedii (Sackston, 1981), a partir de lesiones foliares locales el hongo es capaz de avanzar y crecer hacia el tallo causando una infección sistémica (Spring 2001).
Epidemiología
La naturaleza del inóculo (oospora o zoospora), las variables climáticas (humedad relativa, temperatura), el lugar de infección (edad del tejido), así como la reacción del cultivar son factores que influyen o determinan el proceso de infección, la incidencia de la enfermedad y su gravedad. Las zoosporas, originadas por esporulación sexual o asexual, requieren agua libre para conservar la viabilidad y la capacidad de desplazarse hacia los focos de infección. En consecuencia, las precipitaciones o el riego intensivo serán un requisito previo para el inicio de la infección. Diversos estudios han demostrado que, si durante las dos primeras semanas después de la siembra se producían suficientes precipitaciones o el correspondiente suministro de agua, aumentaba la incidencia de la infección primaria desde el suelo. Sin embargo, el tiempo que favorece la infección es relativamente corto e incluso los girasoles susceptibles se vuelven resistentes con la edad (Sackston, 1981). Tourvieille et al. (2008a) descubrieron que el riesgo de ataque de mildiú velloso parecía mayor si se producían precipitaciones intensas cuando las plántulas de girasol se encontraban en su fase más susceptible, mientras que las precipitaciones intensas antes de la siembra o después de la emergencia no tenían ningún efecto sobre el porcentaje de plantas enfermas. Göre (2009) que la baja temperatura y extensas lluvias de primavera en aproximadamente 85% pérdida de rendimiento y menor calidad de la producción de girasol en la región de Mármara de Trace. Además de las condiciones ambientales, la intensidad de la enfermedad también puede estar influenciada por la agresividad de la población de patógenos. Sakr et al. (2009) fueron capaces de diferenciar las dos cepas de patógenos en términos de su agresividad basándose en el periodo latente de la población y la densidad de esporulación.
Aspectos relacionados con las semillas
P. halstedii se ha encontrado en semillas de girasol procedentes de plantas infectadas de forma natural, ya sea en forma de micelio o de oosporas (Novotel'nova, 1966). Doken (1989) informó de que el micelio sólo se encontraba en el tegumento y en la capa interna del pericarpio; estaba ausente del embrión. Tras la inoculación artificial, Cohen y Sackston (1973) confirmaron que las yemas de girasol inoculadas con P. halstedii se infectaron sistémicamente y produjeron semillas infectadas. Se observaron oosporas en semillas de plantas inoculadas e infectadas naturalmente en el campo. Se conocen otros registros de infección de semillas en Irán (Zad, 1978), Turquía (Döken, 1989) y Alemania (Spring, 2001). El hongo suele invadir el ovario y el pericarpio, pero no llega a crecer en el embrión (Novotel'nova, 1966; Döken, 1989). La infección de las semillas se produce regularmente en plantas infectadas sistémicamente si sobreviven hasta la fase de floración. En tales casos, el desarrollo del embrión suele retrasarse o inhibirse. Además, estas plantas son enanas y rara vez se cosechan. Pueden aumentar el stock local de oosporas en un campo, pero para la dispersión a larga distancia del patógeno derivada de las semillas parecen ser menos importantes que las semillas de plantas asintomáticas infectadas tardíamente (Spring, 2001). Este último tipo de infección depende mucho de las condiciones meteorológicas durante la floración. Así, en años secos, el número de semillas contaminadas por el patógeno es muy bajo y puede no superar varias de cada mil, pero puede ser mucho mayor tras un periodo fresco y húmedo en junio/julio. Por ejemplo, Spring (2001) descubrió que cerca de 10% de las semillas de un campo de Alemania estaban contaminadas y Döken (1989), en condiciones experimentales favorables, observó estructuras fúngicas en 28% de las semillas examinadas.
Efecto en la calidad de las semillas
Las semillas de girasol producidas en plantas afectadas por el mildiu están poco desarrolladas, son incoloras o, en raras ocasiones, parecen sanas. Incluso en este último caso, dichas semillas infectadas son de mala calidad; producen plántulas anormales y el porcentaje de germinación es bajo (Döken, 1989).
Para más información, visite la página web de CABI.
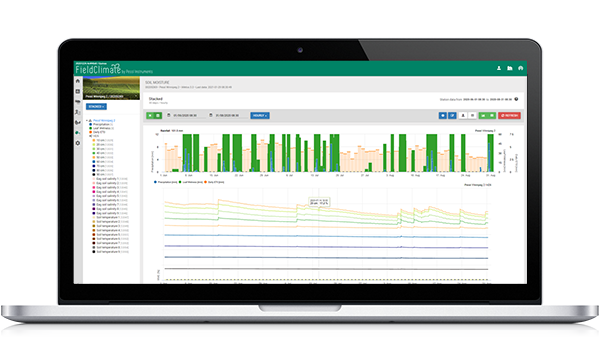
Modelo en FieldClimate
Sensores usados: temperatura del suelo, precipitaciones, humedad de las hojas, temperatura del aire y humedad relativa.
Empezamos a calcular el avance de la infección cuando la temperatura oscila entre 6 y 32°C, con un óptimo de 18 a 24°C, y la temperatura del suelo es superior a 10°C. Más adelante, las condiciones húmedas son favorables para la enfermedad (lluvia, humedad relativa superior a 70%).
Los makrosporangios se forman con temperaturas del suelo superiores a 10°C y precipitaciones (humedad rel. superior a 70%). Se reinicia si la humedad relativa cae por debajo de 50%.
Si la Makrosporangia está completamente desarrollada - comienzan los cálculos para una infección del suelo o una infección del aire (en el gráfico llamada infección primaria) (en condiciones de humedad de la hoja).
Los esporangios se forman en condiciones húmedas (más de 95% h.r.), en la oscuridad y a temperaturas superiores a 12°C. La reaparición se produce durante el día y cuando los esporangios no están completamente desarrollados.
Si los esporangios están completamente desarrollados, se inicia el cálculo de la infección secundaria en función de la temperatura del aire.
En el Gráfico se observa a finales de abril un periodo húmedo de larga duración, que dio lugar a la formación de macrosporas y a una infección del suelo (infección primaria de las raíces). El 1 de mayo no se determinó una infección aérea (denominada aquí infección primaria), pero las condiciones han sido favorables, por lo que se determinó el 2 de mayo. Si las plántulas de girasol se encuentran en una fase sensible en ese momento (recién sembradas) hay que tener en cuenta las medidas de control (fungicidas sistémicos profilácticos, sobre todo ácidos fosfóricos).
Referencias:
- Achbani EH, Lamrhari A, Serrhini MN, Douira A, Tourvieille de Labrouche D, 1999. Evaluación de la eficacia de los tratamientos de semillas contra Plasmopara halstedii. Bulletin OEPP, 29(4):443-449; 15 ref.
- Achbani EH, Tourvieille D, 1993. Le tournesol au Maroc. Phytoma, 448:30-32.
- Agrawal SC, Gupta RK, Prasad KVV, 1991. A case of downy mildew of sunflower in Madhya Pradesh. Journal of Oilseeds Research, 8(1):126
- Albourie JM, Tourvieille J, Labrouhe DTde, 1998. Resistance to metalaxyl in isolates of the sunflower pathogen Plasmopara halstedii. European Journal of Plant Pathology, 104(3):235-242; 27 ref.
- Albourie JM, Tourvieille J, Tourvieille de Labrouhe D, 1998. Resistencia al metalaxil en aislados franceses de mildiu. En: Gulya T, ed. Vear F, ed. Proc. Third Sunflower Downy Mildew Symposium, Fargo, USA: ISA, 235-242.
- Bán R, Kovács A, Körösi K, Perczel M, Turóczi G, 2014. First report on the occurrence of a new pathotype, 714, of Plasmopara halstedii (sunflower downy mildew) in Hungary. Plant Disease, 98(11):1580-1581.
- Bán R, Kovács A, Perczel M, Körösi K, Turóczi G, 2014. Primer informe sobre el aumento de la distribución del patotipo 704 de Plasmopara halstedii en Hungría. Enfermedades de las plantas, 98(6):844.
- Batinica J, Bes A, Dimic N, Numic R, Radman L, Ristanovic M, Vaclav V, 1973. A contribution to the knowledge of harmful fauna and the causes of diseases of sunflower in the area of its cultivation in the republic of Bosnia and Hercegovina. Radovi Poljoprivrednog Fakulteta Univerziteta u Sarajevu, 21/22(24/25):203-210
- Berlese AN, De-Toni JB, 1888. Phycomycetteae. En: Sylloge fungorum, VII:242.
- Bohár G, Vajna L, 1996. Ocurrencia de hongos microscópicos patógenos de Ambrosia artemisifolia var. elatior (L.) Descourt. en Hungría. Növényvédelem, 32:527-528.
- Borovkov AY, McClean PE, 1993. A tandemly repeated sequence from the Plasmopara halstedii genome. Gene, 124(1):127-130
- Borovkova IG, Borovkov AY, McClean PE, Gulya TJ, Vick BA, 1992. Restriction fragment length polymorphisms and RAPD markers in DNA of Plasmopara halstedii, the downy mildew fungus of sunflower. Proceedings of the 13th International Sunflower Conference Volume 2, Pisa, Italy, 7-11 September 1992., 1420-1425; 9 ref.
- Bouterige S, Robert R, Bouchara JP, Marot-Leblond A, Molinero V, Senet JM, 2000. Producción y caracterización de dos anticuerpos monoclonales específicos de Plasmopara halstedii. Applied and Environmental Microbiology, 66(8):3277-3282; 33 ref.
- Bouterige S, Robert S, Marot-Leblond A, Senet JM, 2000. Development of an ELISA test to detect Plasmopara halstedii antigens in seed. En: Proc. 15th Int. Sunflower Conference Toulouse, France: ISA (F):44-49.
- CABI/EPPO, 1998. Distribution maps of quarantine pests for Europe (editado por Smith, I. M. y Charles, L. M. F.). Wallingford, Reino Unido: CAB International, xviii + 768 pp.
- CABI/EPPO, 2014. Plasmopara halstedii. Mapa de distribución. Mapas de distribución de enfermedades de las plantas, No.October. Wallingford, Reino Unido: CABI, Mapa 286 (Edición 6).
- Choi YJ, Park MJ, Shin HD, 2009. First Korean report of downy mildew on Coreopsis lanceolata caused by Plasmopara halstedii. Patología vegetal, 58(6):1171.
- CMI, 1988. Mapas de distribución de las enfermedades de las plantas. Map No. 286. Wallingford, Reino Unido: CAB International.
- Cohen Y, Sackson WE, 1974. Seed infection and latent infection of sunflowers by Plasmopara halstedii. Canadian Journal of Botany, 52:231-238.
- Delanoe D, 1972. Biologie et epidemiologie du mildiou du tournesol (Plasmopara helianthi Novot.). CETIOM Informations Techniques, 29:1-49.
- Delen N, Onogur E, Yildiz M, 1985. Sensitivity levels to metalaxyl in six Plasmopara helianthi Novot. isolates. Revista de Fitopatología Turca, 14(1):31-36
- Delos M, Penaud A, Lafon S, Walser P, De Guenin MC, Tourvieille J, Molinero V, Tourvieille D, 1997. Le mildiou de tournesol - Une maladie toujours d'actualitT. Phytoma, 495á:15-16.
- Doken MT, 1989. Plasmopara halstedii (Farl.) Berl. et de Toni en semillas de girasol y el papel de las semillas infectadas en la producción de plantas con síntomas sistémicos. Revista de Fitopatología, 124(1-4):23-26
- Duarte LL, Choi YJ, Barreto RW, 2013. First report of downy mildew caused by Plasmopara halstedii on Gerbera jamesonii in Brazil. Enfermedades de las plantas, 97(10):1382.
- OEPP, 2014. Base de datos PQR. París, Francia: Organización Europea y Mediterránea de Protección de las Plantas.
- Organización Europea y Mediterránea de Protección de las Plantas, 2008. Plasmopara halstedii. Boletín OEPP/EPPO, 38(3):343-348.
- García GM, Gulya TJ, 1991. Distribución de razas de mildiu del girasol en Dakota del Norte y Minnesota. En: Proceedings of the 1991 Sunflower Research Workshop, Fargo, USA: National Sunflower Association, 3-5.
- Giresse X, Labrouhe DTDe , Richard-Cervera S, 2007. Twelve polymorphic expressed sequence tags-derived markers for Plasmopara halstedii, the causal agent of sunflower downy mildew, 7:1363-1365.
- Göre ME, 2009. Epidemic outbreaks of downy mildew caused by Plasmopara halstedii on sunflower in Thrace, part of the Marmara region of Turkey. Plant Pathology, 58(2):396.
- Gray AB, Sackston WE, Thauvette L, 1985. El desarrollo de estructuras de infección de Plasmopara halstedii en suspensiones de células de girasol. Canadian Journal of Botany, 63(10):1817-1819
- Gray B, Sackston WE, 1983. Estudios de cultivos de tejidos y cultivos celulares de girasol inoculados con Plasmopara halstedii. Canadian Journal of Plant Pathology, 5:206.
- Greathead DJ, Greathead AH, 1992. Biological control of insect pests by insect parasitoids and predators: the BIOCAT database. Biocontrol News and Information, 13(4):61N-68N.
- Gullino ML, Garibaldi A, 1988. Enfermedades criptogámicas de las principales plantas florales cultivadas en maceta. Panorama Floricolo, 13(5):4-8.
- Gulya TJ, 1995. A simple method to assess root response of downy mildew "resistant" sunflower lines. En: Proceedings of the 17th Sunflower Research Workshop, Fargo, USA: National Sunflower Association, 63-66.
- Gulya TJ, 1995. Propuesta de un sistema revisado de clasificación de razas de mildiu del girasol. En: Proceedings of the 17th Sunflower Research Workshop, Fargo, USA: National Sunflower Association, 76-78.
- Gulya TJ, 1996. Enfermedades del girasol en las Grandes Llanuras del Norte. En: Proceedings of the 18th Sunflower Research Workshop, Fargo, USA: National Sunflower Association, 24-27.
- Gulya TJ, 2000. Resistencia a metalaxil en mildiu del girasol y control mediante genética y fungicidas alternativos. En: Proc. 15th Int. Sunflower Conference Toulouse, France: ISA (G):16-21.
- Gulya TJ, 2007. Distribution of Plasmopara halstedii races from sunflower around the world, 3:121-134.
- Gulya TJ, Rashid KY, Masirevic SM, 1997. Enfermedades del girasol. En: Schneiter AA, ed. Tecnología y producción del girasol. Número 35 de la serie Agronomy. Wisconsin, USA: Amer. Soc. Agronomy, 263-379.
- Gulya TJ, Sackston WE, Viranyi F, Masirevic S, Rashid KY, 1991. New races of the sunflower downy mildew pathogen (Plasmopara halstedii) in Europe and North and South America. Journal of Phytopathology, 132(4):303-311
- Gulya TJ, Tourvieille de Labrouhe D, Masirevic S, Penaud A, Rashid K, Viranyi F, 1998. Proposal for standardized nomenclature and identification of races of Plasmopara halstedii (sunflower downy mildew). En: Gulya T, ed. Vear F, ed. Third Sunflower Downy Mildew Symposium. Fargo, EE.UU.: ISA, 130-136.
- Gulya TJ, Virányi F, Nowell D, Serrhini MN, Arouay K, 1996. New races of sunflower downy mildew from Europe and Africa. En: Proceedings of the 18th Sunflower Research Workshop, Fargo, USA: National Sunflower Association, 181-184.
- Gulya TJ, Woods DM, Bell R, Mancl MK, 1991. Enfermedades del girasol en California. Plant Disease, 75(6):572-574
- Hall G, 1989. Registros inusuales o interesantes de Oomycetes fitopatógenos. Patología vegetal, 38(4):604-611
- Harmon PF, Dunkle LD, Latin R, 2003. A rapid PCR-based method for the detection of Magnaporthe oryzae from infected perennial ryegrass. Plant Disease, 87(9):1072-1076.
- Heller A, Rozynek B, Spring O, 1997. Razones citológicas y fisiológicas del tipo de infección latente en girasol causada por Plasmopara halstedii. Journal of Phytopathology, 145(10):441-445; 15 ref.
- Henning AA, Franca Neto JB, 1985. Raza fisiológica y fuentes de resistencia al mildiu velloso (Plasmopara halstedii (Farl.) Berlese et de Toni) en Brasil. En: Actas de la XI Conferencia Internacional de Girasol, Mar del Plata, Argentina: Volumen 2, 407-409.
- Hong CX, 2006. Mildiú velloso de Rudbeckia fulgida cv. Goldsturm por Plasmopara halstedii en Virginia. Plant Disease, 90(11):1461. HTTP://www.apsnet.org
- Hua Z, Ma G, 1996. A review of sunflower diseases research of China. En: Proceedings of the 14th International Sunflower Conference, Beijing, China: ISC-LAAS, 754-759.
- Intelmann F, Spring O, 2002. Analysis of total DNA by minisatellite and simple-sequence repeat primers for the use of population studies in Plasmopara halstedii. Canadian Journal of Microbiology, 48(6):555-559; 25 ref.
- CIPF, 2010. Primer hallazgo de Plasmopara halstedii en el Reino Unido. Informe oficial de plagas de la CIPF, No. GBR-23/1. Roma, Italia. Roma, Italia: FAO.
- Jardine DJ, Gulya TJ, 1994. First report of downy mildew on sunflowers caused by Plasmopara halstedii in Kansas. Enfermedades de las plantas, 78(2):208
- Kinga R, Bíró J, Kovács A, Mihalovics M, Nébli L, Piszker Z, Treitz M, Végh B, Csikász T, 2011. Aparición de una nueva raza de mildiu del girasol en la región sureste de la Gran Llanura húngara. (Újabb napraforgó-peronoszpóra rassz megjelenése Magyarországon, a Dél-kelet Alföldi régióban.) Növényvédelem, 47(7):279-286.
- Kola K, 1980. Estudio comparativo de variedades de girasol para evaluar su resistencia a enfermedades fúngicas en la zona de Zadrima. Buletini i Shkencave Bujqesore, 19:87-94.
- Komjáti H, Walcz I, Virányi F, Zipper R, Thines M, Spring O, 2007. Characteristics of a Plasmopara angustiterminalis isolate from Xanthium strumarium. European Journal of Plant Pathology, 119(4):421-428.
- Kucmierz J, 1976. Plasmopara helianthi Novot, una nueva especie de hongo para Polonia. Fragmenta Floristica et Geobotanica, 22(3):373-375
- Labrouhe DDe , Walser P, Serre F, Roche S, Vear F, 2008. Relaciones entre la pluviometría primaveral y la infección del girasol por Plasmopara halstedii (mildiu). Córdoba, España, 8-12 de junio de 2008. En: Proceedings of the 17th International Sunflower Conference Vol ed. por Velasco, L.. Saville, España: Consejería de Agricultura y Pesca, 97-102.
- Lafon S, Penaud A, Walser P, De Guenin M-Ch, Molinero V, Mestres R, Tourvieille D, 1996. Le mildiou du tournesol toujour sou surveillance. Phytoma, 484:35-36.
- Leite RMVBde C, Henning AA, Rodrigues SR, Oliveira MFde, 2007. Detection and variability of Plasmopara halstedii in Brazil and resistance of sunflower genotypes to downy mildew. (Detección y variabilidad de Plasmopara halstedii en Brasil y evaluación de la resistencia de genotipos de girasol al mildiú). Summa Phytopathologica, 33(4):335-340.
- Leppik EE, 1966. Origen y especialización del complejo Plasmopara halstedii en las Compositae. Boletín Fitosanitario de la FAO, 14:72-76.
- Liese AR, Gotlieb AR, Sackston WE, 1982. Use of enzyme-linked immunosorbent assay (ELISA) for the detection of downy mildew (Plasmopara halstedii) in sunflower. En: Actas de la 10ª Conferencia Internacional sobre el Girasol, Surfers Paradise, Australia, 173-175.
- Ljubich A, Gulya TJ, 1988. Infección sistémica de mildiu limitada por cotiledones. En: Proceedings of the 1988 Sunflower Research Workshop, Bismarck, EE.UU.: National Sunflower Association, 9.X.2009.
- Masirevic S, 1992. Razas de mildiu velloso (Plasmopara halstedii) en girasol presentes en nuestra región y en el mundo. Zbornik Radova, 20:405-408.
- Mayee CD, Patil MA, 1987. Mildiu del girasol en la India. Tropical Pest Management, 33(1):81-82
- Melero-Vara JM, García-Baudín C, López-Herrera CJ, Jiménez-Díaz RM, 1982. Control del mildiu del girasol con metalaxil. Enfermedades de las Plantas, 66(2):132-135
- Melero-Vara JM, Molinero Luiz L, Merino A, Dominguez J, 1996. Razas de Plasmopara halstedii presentes en Espana y evaluacion de susceptibilidad en hibridos comerciales. En: Proceedings of the ISA Symposium I, Disease Tolerance in Sunflower, Beijing, China: Asociación Internacional del Girasol, 7-13.
- Meliala C, Vear F, Labrouhe DTde, 2000. Relación entre la fecha de infección del mildiu del girasol (Plasmopara halstedii) y el desarrollo de los síntomas. Helia, 23(32):35-44.
- Molinero-Ruiz ML, Domfnguez J, Melero-Vara JM, 2002. Razas de aislados de Plasmopara halstedii de España y estudios sobre su virulencia. Enfermedades de las Plantas, 86(7):736-740; 28 ref.
- Moses GJ, 1989. New occurrence of downy mildew of sunflower in Andhra Pradesh. Revista de Investigación APAU, 17(1):73
- Nandeeshkumar P, Ramachandra K, Prakash HS, Niranjana SR, Shetty H, 2008. Induction of resistance against downy mildew on sunflower by rhizobacteria, 3(4):255-262.
- Nandeeshkumar P, Sarosh BR, Kini KR, Prakash HS, Shetty HS, 2009. Elicitation of resistance and defense related proteins by beta-amino butyric acid in sunflower against downy mildew pathogen Plasmopara halstedii. Archives of Phytopathology and Plant Protection, 42(11):1020-1032.
- Nandeeshkumar P, Sudisha J, Ramachandra KK, Prakash HS, Niranjana SR, Shekar SH, 2008. Chitosan induced resistance to downy mildew in sunflower caused by Plasmopara halstedii. PMPP Physiological and Molecular Plant Pathology, 72(4/6):188-194.
- Nikolov G, 1981. Apron 35 SD, un preparado eficaz en el control del mildiu velloso del girasol. Rastitelna Zashchita, 29(3):40-41
- Nishimura M, 1922. Estudios sobre Plasmopara halstedii. J. Coll. Agric, 3(XI):185-210.
- Novotel'nova NS, 1966. Mildiu del girasol. Moscú, URSS: Nauka.
- Onan E, Onogur E, 1989. Downy mildew of sunflower (Plasmopara helianthi Novot.). Ege Universitesi Ziraat Fakultesi Dergisi, 26(1):271-286
- Onan E, Onogur E, 1991. Studies on relation between host and pathogen of sunflower downy mildew (Plasmopara helianthi Novot.). Revista de Fitopatología Turca, 20(1):1-10
- Oros G, Viranyi F, 1987. Glasshouse evaluation of fungicides for the control of sunflower downy mildew (Plasmopara halstedii). Anales de Biología Aplicada, 110(1):53-63
- Patil MA, Mayee CD, 1988. Investigations of downy mildew of sunflower in India. En: Proceedings of the 12th International Sunflower Conference, Novi Sad, Yugoslavia: 2:42.
- Patil MA, Phad HB, Ramtirthkar MS, 1993. Occurrence and distribution of recently introduced sunflower downy mildew in Maharashtra. Journal of Maharashtra Agricultural Universities, 18(1):129-130
- Rahmani Y, Madjidieh-Ghassemi S, 1975. Research on relative resistance of different varieties and inbred lines of sunflower to downy mildew Plasmopara helianthi Novt. in greenhouse and in the experimental field test, 1973. Iranian Journal of Plant Pathology, 11(3/4):96-104; 42-45
- Rashid KY, 1991. Mildiu del girasol en Manitoba. En: Proceedings of the Sunflower Research Workshop, Fargo, EE.UU.: National Sunflower Association, 12.II.1991.
- Rashid KY, 1993. Incidencia y virulencia de Plasmopara halstedii en girasol en el oeste de Canadá durante 1988-1991. Canadian Journal of Plant Pathology, 15(3):206-210
- Rivera Y, Rane K, Crouch JA, 2014. Primer informe de mildiu velloso causado por Plasmopara halstedii en Susana de ojos negros (Rudbeckia fulgida cv. 'Goldsturm') en Maryland. Enfermedades de las plantas, 98(7):1005-1006.
- Roeckel-Drevet P, Coelho V, Tourvieille J, Nicolas P, Labrouhe DTde, 1997. Lack of genetic variability in French identified races of Plasmopara halstedii, the cause of downy mildew in sunflower Helianthus annuus. Canadian Journal of Microbiology, 43(3):260-263; 23 ref.
- Roeckel-Drevet P, Tourvieille J, Drevet JR, Says-Lesage V, Nicolas P, Labrouhe DTde, 1999. Development of a polymerase chain reaction diagnostic test for the detection of the biotrophic pathogen Plasmopara halstedii in sunflower. Canadian Journal of Microbiology, 45(9):797-803; 27 ref.
- Rozynek B, Spring O, 2000. Pathotypes of sunflower downy mildew in southern parts of Germany. Helia, 23(32):27-34; 18 ref.
- Rozynek B, Spring O, 2001. Inoculación del disco foliar, una prueba rápida y precisa para la detección de la tolerancia al metalaxil en el mildiu del girasol. Journal of Phytopathology, 149(6):309-312; 17 ref.
- Ruiz MLM, Domínguez J, Vara JMM, Gulya TJ, 2000. Tolerancia al metalaxil en aislados españoles de Plasmopara halstedii. En: Proc. 15th Int. Sunflower Conference Toulouse, France: ISA, (G):11-15.
- Sackston WE, 1981. Mildiu del girasol. En: Spencer DE, ed. The Downy Mildews. Londres, Reino Unido: Academic Press, 545-575.
- Sackston WE, 1992. On a treadmill: breeding sunflowers for resistance to disease. Annual Review of Phytopathology, 30:529-551; 123 ref.
- Sackston WE, Anas O, Paulitz T, 1992. Biological control of downy mildew of sunflower. En: Abstracts of the American Phytopathological Society North-East Division Meeting, Portland, EEUU: 33.
- Sakr N, Ducher M, Tourvieille J, Walser P, Vear F, Labrouhe DTde, 2009. Un método para medir la agresividad de Plasmopara halstedii (mildiu del girasol). Revista de Fitopatología, 157(2):133-136.
- Says-Lesage V, Meliala C, Nicolas P, Roeckel-Drevet P, Tourvieille de Labrouhe D, Archambault D, Billaud F, 2001. Prueba molecular para demostrar la presencia de mildiu (Plasmopara halstedii) en las semillas de girasol. OCL - Ole^acute~agineux, Corps Gras, Lipides, 8(3):258-260; 5 ref.
- Schuck E, Jobim CIP, 1988. Enfermedades del girasol (Helianthus annuus L.) en Viamao y Santo Augusto, Rio Grande do Sul. Agronomia Sulriograndense, 24(2):221-232; 12 ref.
- Simay EI, 1993. Incidencia de microhongos raros observados en las zonas de Budateteny y Cinkota de Budapest. Mikologiai Kozlemenyek, 32(1-2):81-89
- Skoric D, 1994. Mejora genética del girasol para la resistencia a enfermedades dominantes. En: Proceedings of the EUCARPIA Oil and Protein Crops Section, Symposium on Breeding of Oil and Protein Crops, Albena, Bulgaria, 30-48.
- Spring O, 2000. Homothallic sexual reproduction in Plasmopara halstedii, the downy mildew of sunflower. Helia, 23(32):19-26; 13 ref.
- Spring O, 2001. Nonsystemic infections of sunflower with Plasmopara halstedii and their putative role in the distribution of the pathogen. Journal of Plant Diseases and Protection, 108:329-336.
- Spring O, Benz A, Faust V, 1991. Impact of downy mildew (Plasmopara halstedii) infection on the development and metabolism of sunflower. Zeitschrift fur Pflanzenkrankheiten und Pflanzenschutz, 98(6):597-604
- Spring O, Haas K, 2002. La composición de ácidos grasos de Plasmopara halstedii y su importancia taxonómica. European Journal of Plant Pathology, 108(3):263-267; 20 ref.
- Spring O, Miltner F, Gulya TJ, 1994. Nuevas razas de mildiu del girasol (Plasmopara halstedii) en Alemania. Revista de Fitopatología, 142(3-4):241-244
- Spring O, Rozynek B, Zipper R, 1998. Infecciones de espora única con mildiu del girasol. Journal of Phytopathology, 146(11/12):577-579; 7 ref.
- Spring O, Zipper R, 2000. Isolation of oospores of sunflower downy mildew, Plasmopara halstedii, and microscopical studies on oospore germination. Journal of Phytopathology, 148(4):227-231; 15 ref.
- Spring O, Zipper R, 2006. Evidence for asexual genetic recombination in sunflower downy mildew, Plasmopara halstedii. Mycological Research, 110(6):657-663.
- Sudisha J, Niranjana SR, Sukanya SL, Girijamba R, Devi NL, Shetty HS, 2010. Relative efficacy of strobilurin formulations in the control of downy mildew of sunflower. Journal of Pest Science, 83(4):461-470.
- Thanassoulopoulos CC, Mappas CB, 1992. First report of downy mildew of sunflower in Greece. Enfermedades de las plantas, 76(5):539
- Tourvieille J, Roeckel-Drevet P, Nicolas P, Tourvieille de Labrouhe D, 1996. Caracterización de las razas de mildiu del girasol (Plasmopara halstedii) por RAPD. En: Proceedings of the 14th International Sunflower Conference, Pekín, 781-785.
- Vida R, 1966. Mildiú velloso del girasol: un regreso significativo. Növényvédelem, 32:533-535.
- Virányi F, 1984. Investigaciones recientes sobre el mildiú velloso del girasol en Hungría. Helia, 7:35-38.
- Virányi F, 1988. Factores que afectan a la formación de oosporas en Plasmopara halstedii. En: Proceedings of the 12th International Sunflower Conference, Novi Sad, Yugoslavia, Vol, 2:32.
- Viranyi F, Gulya TJ, 1995. Inter-isolate variation for virulence in Plasmopara halstedii (sunflower downy mildew) from Hungary. Plant Pathology, 44(4):619-624
- Virányi F, Gulya TJ, 1995a. Variación patógena en Plasmopara halstedii. En: Abstracts of papers of the 1st International Symposium on Downy Mildew Fungi, Gwatt, Suiza: Federation of European Microbiological Societies, Ciba-Geigy.
- Virányi F, Gulya TJ, 1996. Expresión de la resistencia en el patosistema Plasmopara halstedii - girasol. En: Proceedings of the ISA Symposium I, Disease Tolerance in Sunflower, Beijing, China: Asociación Internacional del Girasol, 14-21.
- Viranyi F, Sziraki I, 1986. Establecimiento de cultivos duales de Plasmopara halstedii y girasol. Transacciones de la Sociedad Micológica Británica, 87(2):323-325
- Viranyi F, Walcz I, 2000. Population studies on Plasmopara halstedii: host specificity and fungicied tolerance. En: Proceedings of the 15th International Sunflower Conference Toulouse, France: ISA, (I):55-60.
- Walcz I, Bogßr K, Virßnyi F, 2000. Estudio sobre un aislado de Ambrosia de Plasmopara halstedii. Helia, 23(33):19-24; 8 ref.
- Yang SM, Wei SE, 1988. Enfermedades del girasol cultivado en la provincia de Liaoning, República Popular China. Plant Disease, 72(6):546
- Yorinori FT, Henning AA, Ferreira LP, Homechin M, 1985. Enfermedades del girasol en Brasil. En: Actas de la 11ª Conferencia Internacional de Girasol, Mar del Plata, Brasil, 459.
- Zad J, 1978. Transmission of sunflower downy mildew by seed. Iranian Journal of Plant Pathology, 14(1/4):1-2; 1-7
- Zazzerini A, 1978. La propagación de Plasmopara helianthi Novot en relación con la pendiente. Phytopathologia Mediterranea, 17(3):153-156
- Zazzerini A, 1983. Enfermedad por Peronospora (Plasmopara helianthi Novot.) del girasol: razas fisiológicas del parásito y métodos de identificación del material infectado. Informatore Fitopatologico, 33(2):117-119
- Zimmer DE, 1974. Especialización fisiológica entre razas de Plasmopara halstedii en América y Europa. Phytopathology, 64(11):1465-1467
Podredumbre por Sclerotinia
La germinación carpogénica de los esclerocios se ve estimulada por períodos de humedad continua del suelo. En la superficie del suelo se forman apotecios de los que se liberan ascosporas al aire. La infección de la mayoría de las especies de cultivos se asocia principalmente a las ascosporas, pero no suele producirse una infección directa del tejido vegetal sano e intacto a partir de las ascosporas germinativas. En cambio, la infección del tejido de hojas y tallos de plantas sanas sólo se produce cuando las ascosporas germinativas colonizan tejidos muertos o senescentes, normalmente partes de flores como pétalos abscisos, antes de la formación de estructuras de infección y penetración. La germinación miceliogénica de esclerocios en la superficie del suelo también puede dar lugar a la colonización de materia orgánica muerta con la subsiguiente infección de plantas vivas adyacentes. Sin embargo, en algunos cultivos, por ejemplo el girasol, la germinación miceliogénica de los esclerocios puede iniciar directamente el proceso de infección de las raíces y el tallo basal que da lugar a la marchitez. Se desconoce el estímulo para la germinación miceliogénica y la infección en girasol, pero probablemente depende de señales nutricionales en la rizosfera derivadas de las plantas huésped.
El proceso de infección
La infección de tejidos sanos depende de la formación de un apresorio, cuya estructura puede ser simple o compleja en función de la superficie del hospedador. En la mayoría de los casos, la penetración se produce directamente a través de la cutícula y no a través de los estomas. Los apresorios se desarrollan a partir de la ramificación dicotómica terminal de las hifas que crecen en la superficie del hospedador y consisten en una almohadilla de hifas anchas, multiseptadas y cortas que están orientadas perpendicularmente a la superficie del hospedador a la que están unidas por mucílago. Los apresorios complejos suelen denominarse cojines de infección. Aunque los primeros investigadores consideraban que la penetración de la cutícula era un proceso puramente mecánico, los estudios ultraestructurales demuestran que la digestión enzimática de la cutícula también desempeña un papel en el proceso de penetración. Se sabe poco sobre S. sclerotiorum Sin embargo, el genoma codifica al menos cuatro enzimas similares a las cutinasas (Hegedus, sin publicar). Una gran vesícula, formada en la punta del apresorio antes de la penetración, parece liberarse en la cutícula del hospedador durante la penetración. Tras la penetración de la cutícula, se forma una vesícula subcuticular desde la que se abren en abanico grandes hifas que crecen sobre la pared subcuticular de la epidermis y la disuelven.
Infección por degradación enzimática de las células epidémicas: El ácido oxálico actúa en relación con las enzimas degradadoras de la pared celular, como la poligalacturonasa (PG), para provocar la destrucción del tejido huésped creando un entorno propicio para el ataque de la PG a la pectina de la laminilla media. Esto, a su vez, libera derivados de bajo peso molecular que inducen la expresión de genes PG adicionales. De hecho, la actividad general de las PG es inducida por la pectina o los monosacáridos derivados de la pectina, como el ácido galacturónico, y es reprimida por la presencia de glucosa. El examen de los patrones de expresión de los genes Sspg individuales ha revelado que la interacción entre las PG y con el hospedador durante las distintas fases de la infección está finamente coordinada. (Dwayne D. Hegedus *, S. Roger Rimmer: Sclerotinia sclerotiorum: ¿Cuándo ''ser o no ser'' un patógeno? FEMS Microbiology Letters 251 (2005) 177-184)
Buscando condiciones climáticas para la infección de S. sclerotiorum ha de tener en cuenta la formación de apotecios, la esporulación, la infección directa por apotecios (aunque no se produzca con mucha frecuencia) y la infección a partir de micelios establecidos por degradación enzimática de las células epidémicas . Formación de apotecios y esporulación tiene lugar si a una lluvia de más de 8 mm le sigue un periodo de humedad relativa elevada de más de 20 horas a una temperatura óptima de 21°C a 26°C.
Infección directa por apotecios puede esperarse tras un periodo de humectación de las hojas seguido de 16 horas de humedad relativa superior a 90% bajo condiciones óptimas de 21°C a 26°C ("infección de apresorios"). Mientras que crecimiento saprofítico seguido de una degradación enzimática de las células epidérmicas ("infección hidrolítica") puede esperarse bajo una humedad relativa ligeramente inferior de 80% que dure un periodo de 24 horas en condiciones óptimas de 21°C a 26°C.
Literatura:
- Lumsden, R.D. (1976) Pectolytic enzymes of Sclerotinia sclerotiorum and their localization on infected bean. Can. J. Bot. 54,2630-2641.
- Tariq, V.N. y Jeffries, P. (1984) Appressorium formation by Sclerotinia sclerotiorum: scanning electron microscopy. Trans. Brit. Mycol. Soc. 82, 645-651.
- Boyle, C. (1921) Estudios sobre la fisiología del parasitismo. VI. Infección por Sclerotinia libertiana. Ann. Bot. 35, 337-347.
- Abawi, G.S., Polach, F.J. y Molin, W.T. (1975) Infection of bean by ascospores of Whetzelinia sclerotiorum. Fitopatología 65, 673-678.
- Tariq, V.N. y Jeffries, P. (1986) Ultrastructure of penetration of Phaseolus spp. by Sclerotinia sclerotiorum. Can. J. Bot. 64, 2909- 2915.
- Marciano, P., Di Lenna, P. y Magro, P. (1983) Oxalic acid, cell wall degrading enzymes and pH in pathogenesis and their significance in the virulence of two Sclerotinia sclerotiorum isolates on sunflower. Physiol. Plant Pathol. 22, 339-345.
- Fraissinet-Tachet, L. y Fevre, M. (1996) Regulation by galacturonic acid of ppectinolytic enzyme production by Sclerotinia sclerotiorum. Curr. Microbiol. 33, 49-53.
Uso práctico del modelo de la esclerotinia
El modelo de infección de la pata blanca muestra los periodos en los que se espera la formación de apotecios. Si estos periodos coinciden con el periodo de floración de la colza o la colza, cabe esperar que S. sclerotiorum infecciones durante un periodo húmedo. Las esporas formadas en los apotecios pueden estar disponibles de uno a varios días. La oportunidad de las infecciones se indica mediante el cálculo del progreso de la infección para las infecciones directas o indirectas por apresorios o por la degradación de la pared celular encimática. Si la línea de progreso de la infección alcanza 100% se debe suponer una infección. Estas infecciones deben cubrirse preventivamente o con un fungicida de acción curativa contra S. sclerotiorum debe utilizarse.
Moho gris
Molde gris (Botrytis cinerea) es una enfermedad devastadora con un alto impacto económico en la producción. B. cinerea infecta las flores y los frutos próximos a la madurez.
El hongo patógeno tiene un rango de hospedadores muy amplio, infectando a más de 200 hospedadores diferentes. El hongo se desarrolla de forma saprofítica y parasitaria.
Síntomas
En los girasoles el patógeno causa un moho gris en la cabeza y el tallo. Al mismo tiempo, las hojas empiezan a secarse. Estos síntomas se producen durante la maduración de los granos en el cogollo. Se observan manchas marrones en el envés. Estas manchas están cubiertas por el micelio del hongo y las esporas, dando la apariencia de un polvillo. Las esporas pueden propagarse en condiciones climáticas húmedas.
Los esclerocios negros desprovistos de médula aparecen en los restos del cultivo después de la cosecha o directamente en las plantas si se cosechan demasiado tarde.
El hongo pasa el invierno en la superficie del suelo o en el suelo como micelio o esclerocio. En primavera, la forma invernante empieza a germinar y a producir conidios. Estos conidios se propagan por el viento y la lluvia e infectan los tejidos de las nuevas plantas.
La germinación es posible con una humedad relativa superior a 85%. La temperatura óptima de germinación es de 18°C. El hongo patógeno puede reproducirse varias veces.
Opciones de control: El control de las semillas puede proteger a las plantas del damping- off. El control químico es difícil debido a la resistencia del patógeno. Por lo tanto, se intenta aplicar estrategias de control natural con Trichoderma harzianum.
Condiciones para modelar la infección
B. cinerea Las infecciones están relacionadas con la humedad libre. Por ello, en la producción en campo abierto se determina la humedad de las hojas, que es un buen indicador.
Bulger et al. (1987) estudiaron la correlación de los periodos de humedad foliar durante la floración y la aparición de moho gris en los frutos. Encontraron que para un mayor riesgo de infección a 20°C se necesita un periodo de tiempo de más de 32 horas de humectación de la hoja. A temperaturas más bajas, los periodos de humectación de las hojas tienen que ser más largos para que se produzca la infección de la enfermedad.
FieldClimate indica riesgo de Botrytis cinerea en función de los periodos de humedad de las hojas y de la temperatura durante estos periodos.
El gráfico siguiente muestra la duración de las hojas mojadas en función de la temperatura real necesaria para un Botrytis infección. Si el riesgo es superior a 0, cada periodo de humectación de las hojas superior a 4 horas aumentará el riesgo en la misma proporción.
Un día con un periodo de humedad de la hoja inferior a 4 horas se considera un día seco y reducirá el riesgo en 20% del valor real.
Utilización práctica del modelo de molde gris: El modelo indica períodos con riesgo de Botrytis infección. Este período de riesgo durante la floración de la fresa dará lugar a frutos infectados. Cuanto más dure el periodo de riesgo y cuanto mayor sea el riesgo, mayor será la probabilidad y el número de frutos infectados. El riesgo que puede tenerse en cuenta depende del mercado. Los productores que venden sus frutas a los supermercados no asumirán ningún riesgo, sabiendo que no pueden vender frutas infectadas. En cambio, los productores que venden su fruta directamente al público pueden asumir un riesgo mayor.
Literatura:
- Bulger M.A., Ellis M. A., Madden L. V. (1987): Influence of temperature and wetness druation on infection of strawberry flowers by Botrytis cinerea and disease incidence of fruit originating from infected flowers. Ecology and Epidemiology; Vol 77 (8): 1225-1230.
- Sosa-Alvarez M., Madden L.V., Ellis M.A. (1995): Efectos de la temperatura y la duración de la humedad sobre la esporulación de Botrytis cinerea en residuos foliares de fresa. Enfermedades de las plantas 79, 609-615.
TomCast
TOMCAST (TOMato disease foreCASTing) es un modelo informático basado en datos de campo que intenta predecir el desarrollo de enfermedades fúngicas, concretamente el Tizón Temprano, la Mancha Foliar por Septoriosis y la Antracnosis en el tomate. Los registradores de datos colocados en el campo registran cada hora los datos de humedad y temperatura de las hojas. Estos datos se analizan durante un periodo de 24 horas y pueden dar lugar a la formación de una Valor de gravedad de la enfermedad (VSE)esencialmente un incremento del desarrollo de la enfermedad. A medida que se acumulan DSV, la presión de la enfermedad sigue aumentando en el cultivo. Cuando el número de DSV acumulados excede el intervalo de pulverización, se recomienda una aplicación de fungicida para aliviar la presión de la enfermedad.
TOMCAST deriva del modelo original F.A.S.T. (Forecasting Alternaria solani on Tomatoes) desarrollado por los doctores Madden, Pennypacker y MacNab? en la Universidad Estatal de Pensilvania (PSU). El modelo F.A.S.T. de la PSU fue modificado posteriormente por el Dr. Pitblado en el Ridgetown College de Ontario en lo que ahora reconocemos como el modelo TOMCAST utilizado por la Extensión Universitaria del Estado de Ohio. DSV son: Un valor de severidad de la enfermedad (DSV) es la unidad de medida dada a un incremento específico del desarrollo de la enfermedad (tizón temprano). En otras palabras, un DSV es una representación numérica de la rapidez o lentitud con que la enfermedad (tizón temprano) se está acumulando en un campo de tomates. El VDS viene determinado por dos factores: la humedad de la hoja y la temperatura durante las horas de "humedad de la hoja". A medida que aumenta el número de horas de humedad de la hoja y la temperatura, el DSV se acumula a un ritmo más rápido. Vea la Tabla de Valores de Severidad de la Enfermedad a continuación.
Por el contrario, cuando hay menos horas de humedad foliar y la temperatura es más baja, los DSV se acumulan lentamente, si es que lo hacen. Cuando el número total de DSV acumulados supera un límite preestablecido, denominado intervalo o umbral de pulverización, se recomienda una pulverización fungicida para proteger el follaje y el fruto del desarrollo de la enfermedad.
El intervalo de pulverización (que determina cuándo se debe pulverizar) puede oscilar entre 15 y 20 DSV. El DSV exacto que debe utilizar un agricultor suele proporcionarlo el transformador y depende de la calidad del fruto y del uso final de los tomates. Seguir un intervalo de pulverización de 15 DSV es un uso conservador del sistema TOMCAST, lo que significa que pulverizará con más frecuencia que un agricultor que utilice un intervalo de pulverización de 19 DSV con el sistema TOMCAST. La compensación está en el número de pulverizaciones aplicadas durante la temporada y la posible diferencia en la calidad de la fruta.
En la Michigan Staate University se han iniciado estudios para probar el sistema de previsión de enfermedades TomCast, con el fin de utilizarlo en la gestión de las plagas foliares de la zanahoria. TomCast se ha utilizado comercialmente en la producción de tomate, y recientemente se ha adaptado para su uso en la gestión de enfermedades del espárrago. Las zanahorias de procesamiento 'Early Gold' se plantaron con una sembradora de vacío de precisión en la MSU Muck Soils Research Farm en tres filas separadas 18 pulgadas en una cama elevada de 50 pies de largo. Las camas de zanahorias se espaciaron en centros de 64 pulgadas y el espaciamiento entre hileras de semillas fue de 1 pulgada. Cada una de las cuatro repeticiones del experimento se ubicó en bloques separados de zanahorias que consistían en 36 camas. En cada repetición se colocaron al azar 17 camas de tratamiento de 6 metros de largo en un patrón de tablero de ajedrez. Los tratamientos se aplicaron con un pulverizador de mochila de CO2 que se calibró para suministrar 50 galones por acre de solución de pulverización utilizando boquillas de abanico plano 8002. Los tratamientos consistieron en un tratamiento sin tratar y diferentes aplicaciones programadas de Bravo Ultrex 82.5WDG (22.4 oz/A) alternadas con Quadris 2.08SC (6.2 fl oz/A). El programa químico se aplicó en un programa de calendario de 10 días, así como cuando lo predijo el pronosticador de enfermedades TomCast. Se utilizaron tres umbrales de predicción diferentes de 15, 20 y 25 DSV para programar las aplicaciones de fungicidas. Cuando los valores diarios acumulados de DSV alcanzaban el umbral determinado, se aplicaba una pulverización. Cada régimen de tratamiento se inició en cuatro niveles diferentes de presión de la enfermedad (0%, rastro, 5% y 10% tizón foliar). Los primeros tratamientos se aplicaron el 2 de julio y la última aplicación de cualquier tratamiento se realizó el 21 de septiembre. Se marcaron tres metros de cada hilera central de los bloques de pulverización antes de la primera aplicación y se utilizaron para las calificaciones semanales de la enfermedad (véanse los gráficos, más abajo). Los rendimientos se tomaron de la misma sección de tres metros de hilera cosechando a mano las zanahorias y desmochándolas y pesándolas.
Esto indica que el primer tratamiento en zanahoria debe hacerse tan pronto como podamos encontrar la primera incidencia de la enfermedad en campo. A partir de ahora funcionó bien mediante el uso del modelo TomCast con un umbral de 20 DSV acumulados desde la última pulverización.
Fieldclimate determina la gravedad de una infección por Alternaria en dos modelos diferentes:
Fuente: Jim Jasinski, Coordinador de TOMCAST para OHIO, INDIANA y MICHIGAN
Modelo TomCast de Alternaria
En función de las condiciones climáticas de horas de humedad de la hoja y temperatura del aire, se determinan los valores de gravedad de una Infección (de 0 - 4, véase la tabla anterior).
Equipamiento recomendado
Compruebe qué conjunto de sensores se necesita para vigilar las posibles enfermedades de este cultivo.